碱诱导鸭蛋蛋清凝胶特性的变化规律
凌子庭 - 蒋爱民 - 周 佺,3 ,3 范 红 艾民珉 - 曹媛媛 -
(1.华南农业大学食品学院,广东 广州 510642;2.畜禽产品精准加工与地方安全联合工程研究中心,广东 广州 510642;3.广州市食品药品监督管理局审评认证中心,广东 广州 510000)
凝胶是指胶体粒子或高分子溶质在分散介质中形成整体构造而失去流动性,或胶体全体虽含有大量液体介质但处于固化状态的物质[1]。蛋清可以通过热处理、碱处理、酶处理等方式形成凝胶[2],其凝胶特性会受到蛋白质浓度、pH、盐种类、加热温度和加热时间等因素的影响[3-5]。在热处理过程中,蛋清蛋白质先从天然状态转变为部分展开状态(熔融球状态),然后分子内氢键和疏水相互作用的官能团在适当的条件下形成分子间相互作用,形成凝胶网络[6]。李俐鑫等[4]在pH 7的情况下采用热处理(75 ℃以上)诱导蛋清形成了质构特性较好的凝胶。然而,在碱性环境中,蛋清蛋白质在较高的加热温度下会发生降解,从而影响凝胶的质构等特性。Gomes等[7]发现加热温度由90 ℃上升至100 ℃时,pH 9.5的蛋清溶液热聚集程度下降,说明在利用热处理制备碱诱导鸭蛋蛋清凝胶时,还需要考虑加热温度对其凝胶特性影响。
团队[8]前期研究表明,碱诱导鸭蛋蛋清的加碱量>0.50%时,会出现刺鼻碱味,影响碱诱导鸭蛋蛋清的应用。因此,研究拟在优选的10%蛋白质浓度的蛋清中加入0.50% NaOH的基础上,以相隔5 ℃为梯度,选取65~95 ℃范围内的7个加热温度,采用水浴加热方式制备碱诱导鸭蛋蛋清凝胶。通过测定流变、质构、持水性、pH、色泽、蛋白质电泳、网络蛋白及可溶性蛋白等指标,研究温度对碱诱导鸭蛋蛋清凝胶特性的影响,以期为热制备具有优良凝胶特性的碱诱导鸭蛋蛋清凝胶提供理论依据。
1 材料与方法
1.1 材料、试剂与仪器
鸭蛋:广州市天河区长湴市场;
氢氧化钠:分析纯,广州化学试剂厂;
其他试剂均为分析纯;
流变仪:MCR101型,奥地利安东帕有限公司;
凯氏定氮仪:KJELTEC8200型,丹麦福斯公司;
色差仪:Serie SP60型,美国X-Rite公司;
质构仪:XT.AT.plus型,英国Stable Micro System公司;
高速分散机:T25数显型,德国IKA公司;
紫外分光光度计:UV-2600型,日本岛津株式会社;
pH计:PH 0-14型,德国赛多利斯公司。
1.2 试验方法
1.2.1 样品制备 取新鲜鸭蛋,手工分离蛋清蛋黄并去除蛋壳及系带,所得蛋清液用打蛋器搅打2 min后置于4 ℃冰箱静置4 h,弃去上层泡沫备用。采用自动凯氏定氮法测定蛋清中蛋白质的含量。根据蛋清中蛋白质的含量取适量蛋清于烧杯中,加入适量经灭菌处理的蒸馏水至20.00 g,所得调整后蛋清中的蛋白质浓度为10%。边搅拌边加入1 mL NaOH溶液,使得蛋清中碱的质量分数为0.50%,搅拌均匀后用保鲜膜封口,置于4 ℃冰箱静置24 h。静置结束后置于不同温度的水浴锅中加热30 min,加热结束后置于25 ℃、RH 50%的人工气候培养箱中平衡12 h。
1.2.2 pH测定 称取蛋清凝胶5.000 g,在1∶15的稀释比例下按GB 5009.237—2016《食品安全国家标准 食品pH值的测定》测定样品pH值。
Type: Vietnam. Transplant collected from Son La Province, Van Ho District, Tan Xuan Municipality, Cot Moc Village, at ca. 1000 m a.s.l. 20°40′33.3″N, 104°39′0.3″E, 10 Nov 2015, L. Averyanov, CPC 7158a,b /13279 (holotype, LE, not seen).
1.2.3 色泽测定 取整块凝胶样品,置于透明塑料袋中,利用色差仪测定样品色泽。L*值代表亮度,其值越小,亮度越暗。a*代表红绿方向颜色变化,-a*值为绿色,+a*值为红色。b*值代表蓝黄方向颜色变化,-b*值为蓝色,+b*值为黄色。
1.2.4 动态黏弹性温度扫描 上样初始温度20 ℃,上样后平衡3 min,角速度1 rad/s,应变1%。升温阶段与冷却阶段的温度变化速度为2 ℃/min,扫描范围20~95 ℃。
1.2.5 可溶性蛋白含量测定 准确称取2.000 g蛋清凝胶,加入38 mL蒸馏水,以10 000 r/min分散2 min,然后置于离心机中,在4 ℃下5 000 r/min离心15 min。利用考马斯亮蓝法测定上清液蛋白质含量,以牛血清蛋白为标准曲线[9]。
1.2.6 网络蛋白含量测定 参考Wu等[10]的方法并略作修改:凝胶样品切成1.5 mm的薄片,转移一定样品(精确到0.01 g)到带旋盖的瓶子中,按料液比1∶20(g/mL)加入0.01 mol/L、pH 7的磷酸钠缓冲液。溶液中加入0.02% NaN3抑制细菌生长。将瓶子置于25 ℃的水浴中轻轻震荡,使非网络蛋白从凝胶片中扩散54 h。扩散结束时,用镊子取出凝胶片,并用0.01 mol/L、pH 7的磷酸钠缓冲液漂洗2次。漂洗后的凝胶片的蛋白质含量采用凯氏定氮法测定,结果即为网络蛋白含量。
1.2.7 持水性测定 参考王健一等[11]的方法并略作修改:将样品切成1 cm×1 cm×1 cm的立方体记录其质量(m1),用一层滤纸包裹,置于50 mL离心管中,离心管底部放置脱脂棉,用于吸水。在4 ℃条件下4 000 r/min离心10 min,离心完毕后取出样品并称重(m2),按式(1)计算持水性。
(1)
式中:
WHC——持水性,%;
m1——离心前质量,g;
m2——离心后质量,g。
1.2.8 十二烷基硫酸钠—丙烯酰胺凝胶电泳(SDS-PAGE) 参照Laemmli[12]的方法略作修改:称取3 g蛋白凝胶样品,添加5% SDS 27 mL,以12 000 r/min均质1 min。匀浆在85 ℃加热1 h,然后置于离心机中,在室温下7 500×g离心10 min。取上清液100 μL,1∶1加入样品处理液,摇匀后进行5 min沸水浴。取样品10 μL注入浓缩胶的凹槽。垂直式凝胶电泳装置进行电泳,采用60 V和120 V电压,电泳后的凝胶置于20%甲醇、10%乙酸和0.25%考马斯亮蓝染色液中染色(85 ℃,15 min),然后用20%甲醇和10%乙酸脱色,直至背景清晰。
1.2.9 凝胶质构 参考陈青等[13]的方法并略作修改:采用质构分析仪进行应力松弛测试。选用的夹具为P/0.5 s,测试模式为 HOLD TEST。具体测试参数为测前速度2 mm/s,测中速度1 mm/s,测后速度2 mm/s,压缩应变50%,触发力5 g,测试时间180 s。测试结果取下压过程最大的回弹力为坚实度,测试结束时的回弹力与坚实度的比值为弹性。
1.3 数据统计
各指标重复测定3次,采用Origin 9.5软件绘图,利用Photoshopcs6进行电泳图颜色处理,利用SPSS 18进行Pearson相关性分析,数据显著性则利用 SPSS 18进行单因素ANOVA分析。
2 结果与分析
2.1 温度对蛋清凝胶pH及色泽的影响
根据凝胶的pH检测结果,随着加热温度的升高,蛋清凝胶的pH值由加热前的11.18逐渐下降至95 ℃的10.78。色泽检测结果显示,蛋清凝胶发生较明显的褐变现象,在95 ℃时呈棕褐色。pH值的降低可能与蛋清受热过程中发生的蛋白质降解和美拉德反应相关[14-16]。在热和碱的共同作用下,OH-作为反应物参与蛋白质降解,导致OH-被消耗,pH值下降。另外,美拉德反应过程中,糖和Amadori化合物的降解产物含有有机酸[14],因此随着温度的升高,美拉德反应逐渐增强,有机酸产量逐渐升高,中和了环境中的OH-,导致蛋清pH值显著下降(P<0.05)。
由表1可知,蛋清凝胶随着加热温度的上升,L*值显著降低(P<0.05),表明蛋清凝胶的亮度降低,即凝胶颜色越接近黑色,样品发生褐变的程度越高;a*值由负值转向正值,表明样品颜色逐渐向红色加深;b*值始终为黄色,数值先增大后减少,表明蛋清在添加0.50% NaOH后,加热形成的凝胶带有黄色色泽,而这种色泽为黄色的一种或数种化学产物具有热不稳定性,可能在温度>85 ℃时发生分解或合成新的物质,颜色褪去,故而b*值在升高至19.14后逐渐下降至8.68。
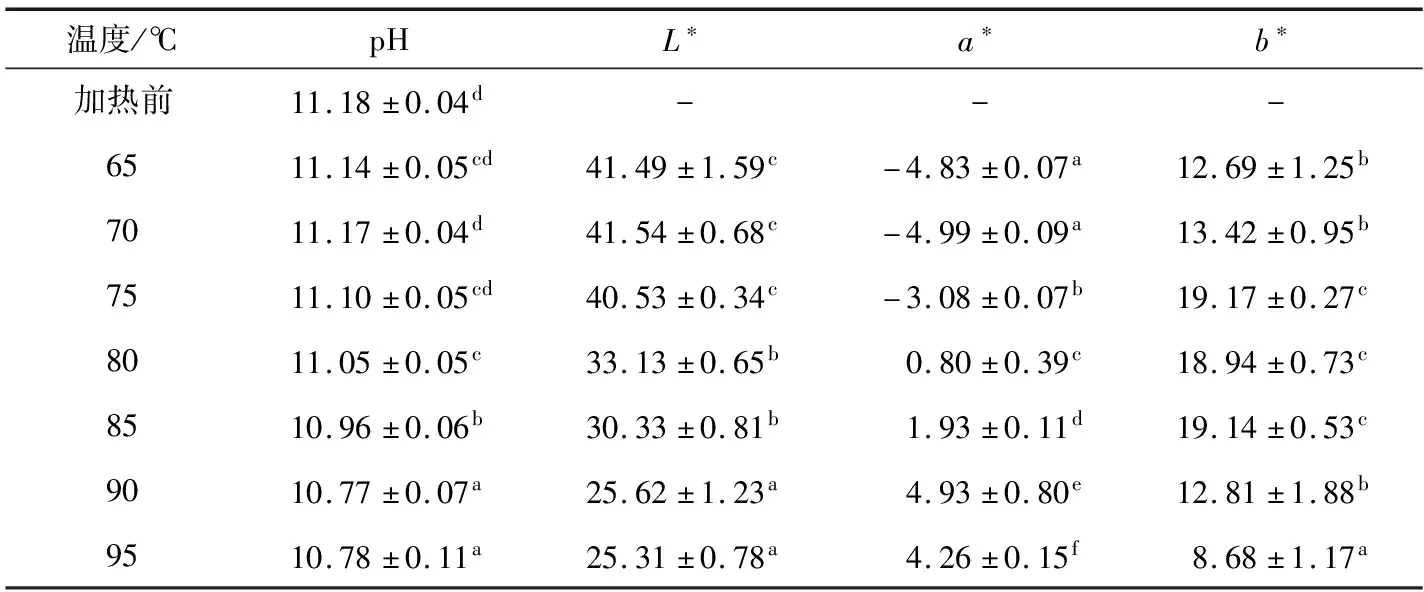
表1 不同加热温度下蛋清凝胶的pH和色泽的变化†
† 同列字母不同表示差异有统计学意义(P<0.05)。
2.2 温度对蛋清流变特性的影响
由图1可以看出:添加NaOH的蛋清加热前就形成了凝胶状态(G′>G”);在升温阶段,随着温度的升高,添加NaOH的蛋清G′约在54 ℃改变下降趋势并迅速增大,在74 ℃时到达最大值,而后逐渐下降;未添加NaOH的蛋清G′在71 ℃时迅速增大,93 ℃时达到最大值,最终G′值远大于添加NaOH的蛋清。说明添加0.50% NaOH明显改变了蛋清对温度的敏感性,添加NaOH的蛋清可以在较低的温度形成刚度更大的凝胶,但加热温度>80 ℃时其刚度低于未添加NaOH的蛋清;添加NaOH的蛋清在加热温度达到74 ℃时,G′开始下降,说明蛋清的凝胶结构容易在热及NaOH共同作用下被破坏。冷却阶段结果如图2所示,两种蛋清均形成了G′更高的凝胶,Mine[6]认为这是氢键重新生成并稳定凝胶结构导致的。在冷却后,添加NaOH的蛋清形成的凝胶G′值较未添加NaOH的蛋清G′值低,说明在加热阶段被破坏的凝胶结构不会恢复,最终添加NaOH的蛋清加热形成的凝胶较软。
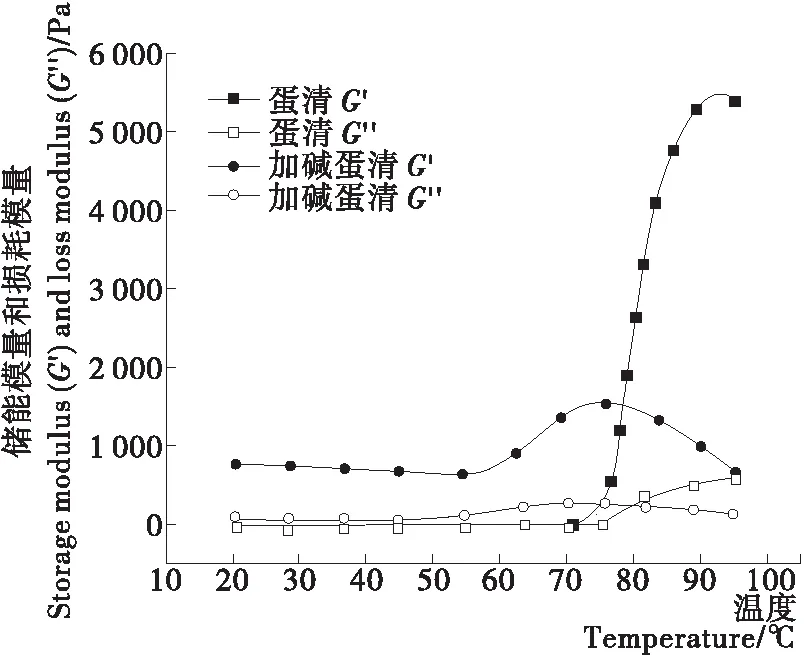
图1 升温阶段储能模量(G′)和损耗模量(G″)的变化
2.3 温度对蛋清凝胶网络蛋白、可溶性蛋白及持水性的影响
利用缓冲溶液长时间浸泡切成薄片的蛋清凝胶,溶出未形成网络蛋白的蛋白质,则可以通过测量凝胶片的蛋白质含量测得凝胶的网络蛋白含量[10]。如图3所示,当加热温度升高至90 ℃以上时,网络蛋白含量出现明显的下降(P<0.05),由75 ℃的8.15%下降至95 ℃的7.21%;而蛋清凝胶的可溶性蛋白含量75 ℃时开始出现显著的升高(P<0.05),由4.77 g/L上升至95 ℃的10.82 g/L;相关性分析结果显示,网络蛋白含量与可溶性蛋白的结果呈较好的相关性(r=-0.912,P<0.01)。说明蛋清凝胶的网络结构因过度受热和碱处理而受损[3,7,17],部分形成网络蛋白的蛋白质降解成可溶性蛋白或多肽并被缓冲溶液溶出。同时,根据Han等[18]的研究结果,凝胶的持水性与凝胶结构有较大的相关性,凝胶结构越细密持水性越好。由图4可知,蛋清凝胶的持水性随加热温度的升高呈先上升后下降趋势,在75 ℃时的持水性最好,为 89.02%。当加热温度>75 ℃时,持水性显著下降(P<0.05),95 ℃时持水性仅有79.03%。表明蛋清的凝胶结构会在高热、高碱环境被破坏,适度加热有利于蛋清形成细密的凝胶结构。

同项目字母不同表示差异有统计学意义(P<0.05)
Figure 3 Effects of heating temperature on netting proteins and soluble proteins in egg white gel
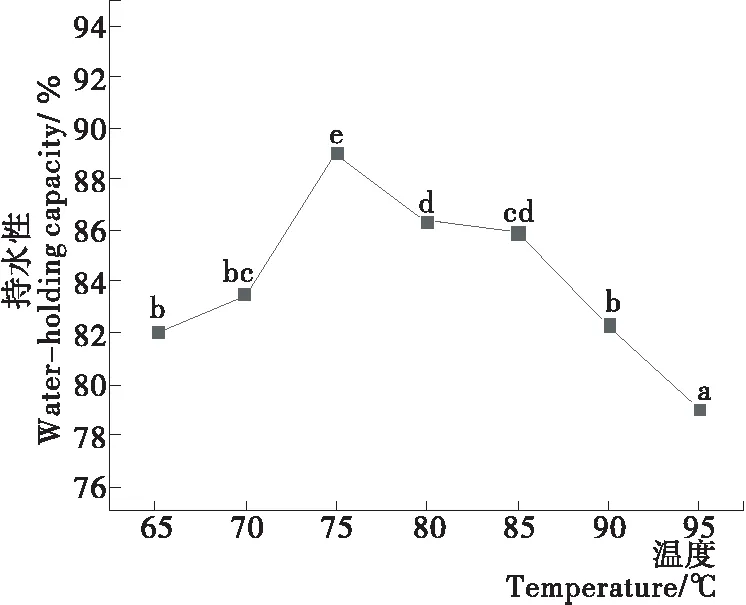
字母不同表示差异有统计学意义(P<0.05)
2.4 温度对蛋清凝胶蛋白质聚丙烯酰胺凝胶电泳(SDS-PAGE)的影响
根据新鲜鸭蛋蛋清蛋白质的组分在凝胶电泳中的情况,从上到下可观察到蛋清的可溶性蛋白主要分为卵黏蛋白(110 kDa)、卵转铁蛋白(76 kDa)、卵球蛋白(49 kDa)、卵白蛋白(44.5 kDa)和溶菌酶(14.4 kDa)[19-20]。对比新鲜蛋清和加碱后放置24 h的蛋清蛋白质组分,观察到加入0.50% NaOH后,蛋清中的各类蛋白质均在一定程度上受到OH-的影响,其中溶菌酶、卵黏蛋白、卵转铁蛋白、卵球蛋白条带完全消失,表明这几种蛋白对0.50% NaOH不耐受,在碱的作用下全部发生变性、聚合或降解[17,19,21];卵白蛋白仍有较清晰的条带,但条带明显变淡,可能由于卵白蛋白含量较多且具有一定的耐碱能力,因此卵白蛋白在碱的作用下并未全部变性,在电泳图谱上仍存在较明显的条带。根据Hagolle等[22]研究结果显示,卵白蛋白变性的起始温度约为68 ℃,峰值约在84 ℃。因此在85 ℃及以上的加热条件下,大部分卵白蛋白变性,在电泳图谱(图5)上显示为卵白蛋白条带变浅直至消失。施加65 ℃以上的温度处理鸭蛋蛋清,分离胶上部出现分子量>97.4 kDa的颜色较深的新条带,表明大部分蛋清蛋白质发生变性、相互聚集形成大分子蛋白[19,21,23];同时,加热温度达到90,95 ℃时,整个泳道均有拖尾现象,表明在高热和碱性环境下,大分子蛋白被降解,形成分子量不一的蛋白质片段,这种大分子蛋白被降解的现象对形成高强度的蛋清凝胶不利。

图5 不同加热温度条件下鸭蛋蛋清凝胶的SDS-PAGE图谱
2.5 温度对蛋清凝胶质构特性的影响
如图6所示,蛋清凝胶的坚实度由加热前的68.88 g上升至70 ℃的最大值652.35 g,而后持续下降至95 ℃的380.35 g;蛋清凝胶的弹性则逐渐由加热前的45.20%上升至95 ℃的77.50%。显然,通过对添加0.50% NaOH蛋清施加60 ℃以上的热处理,显著改善了蛋清凝胶的坚实度和弹性(P<0.05)。当加热温度由65 ℃上升至70 ℃时,蛋清蛋白质中占比较大的卵白蛋白开始发生热变性[22],参与形成网络凝胶结构,蛋清凝胶的坚实度出现显著增强(P<0.05)。随着加热温度逐渐升高和存在较多OH-的情况下,凝胶的网络结构局部分解越来越严重、蛋白质的热聚集效应降低[5,19-21,24],蛋白质二级结构遭受破坏、二硫键和疏水相互作用减少[24],导致蛋清凝胶的坚实度逐渐下降,说明加入NaOH后过高的加热温度不利于形成具有优良质构特性的蛋清凝胶。根据Zhao等[5]的研究,NaOH处理会导致蛋清蛋白分子的损伤,形成具有松散线性网状结构的高弹性凝胶[17,19],这一结果也可以用于解释蛋清蛋白凝胶的弹性随温度上升而逐渐升高的情况。

同项目字母不同表示差异有统计学意义(P<0.05)
2.6 蛋清理化性质与凝胶质构特性的相关性分析
为进一步阐明蛋清理化性质与凝胶质构特性的关系,进行了Pearson相关分析。如表2所示,温度与凝胶的pH、网络蛋白和可溶性蛋白均有较好的线性关系(P<0.05),表现为温度越高,pH和网络蛋白越低,可溶性蛋白含量越高。凝胶的坚实度与温度呈显著负相关(P<0.05),表明温度越高,凝胶坚实度越差。此外,凝胶的坚实度与网络蛋白呈极显著的正相关(P<0.01),与可溶性蛋白呈极显著的负相关(P<0.01),说明网络蛋白和可溶性蛋白均可用于描述蛋清凝胶的情况:形成网络蛋白的蛋白质越多,凝胶的坚实度越高。凝胶的弹性则仅与温度呈正相关(P<0.05),说明在高温破坏蛋清凝胶的结构后,凝胶松散线性网状结构反而具有更高的弹性。
表2 不同加热温度下蛋清凝胶的理化特性与质构特性的相关系数†
Table 2 Correlation coefficient between physicochemical properties and texture properties of egg white gel at different heating temperatures
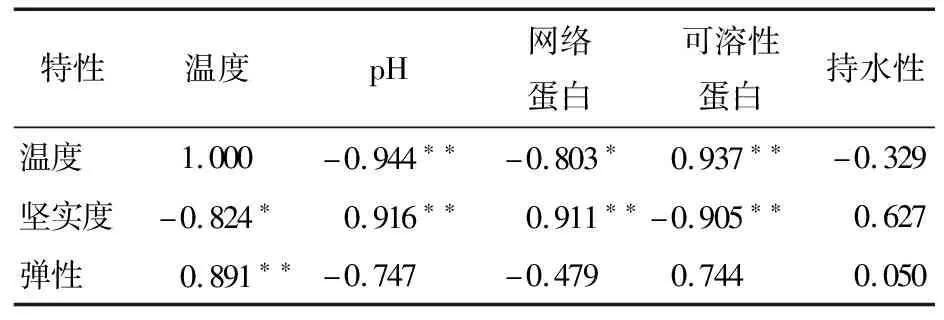
特性温度pH网络蛋白可溶性蛋白持水性温度1.000-0.944∗∗-0.803∗0.937∗∗-0.329坚实度-0.824∗0.916∗∗0.911∗∗-0.905∗∗0.627弹性0.891∗∗-0.747-0.4790.7440.050
† “*”表示相关系数在0.05水平上显著;“**”表示相关系数在0.01水平上显著。
3 结论
研究了65~95 ℃加热温度对添加0.50% NaOH的鸭蛋蛋清凝胶特性的影响,结果显示:随着加热温度的上升,蛋清的凝胶结构会被碱及高热环境破坏,坚实度和持水性呈先上升后下降的趋势,蛋清凝胶的非酶褐变程度加深。当加热温度为70 ℃时,蛋清凝胶的质构特性较为优良。试验仅探究了0.50% NaOH添加量条件下的蛋清凝胶变化,下一步可探究其他NaOH添加量的蛋清凝胶变化,并从化学作用力、透射电子显微镜等方面剖析其深层机理。

