维生素B族复合TRP肽和SOD对焦虑性抑郁症C57BL/6小鼠行为学改善的影响
朱西平 - 李文治 - 陶 倩 何文江 - 崔 春,3 ,3
(1.华南理工大学食品科学与工程学院,广东 广州 510640;2.无限极﹝中国﹞有限公司,广东 江门 529156;3.广东巍微生物科技有限公司,广东 广州 510641)
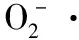
试验拟研究维生素B族复合TRP肽和SOD配方(VB3∶VB6∶TRP肽∶SOD=2∶10∶3∶4)潜在的改善和预防焦虑性抑郁症的作用,为维生素B族复合TRP肽和SOD配方在医药、保健品方面应用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验动物
C57BL/6小鼠:4周龄,(18±2)g,常州凯文斯动物实验有限公司。小鼠购入后先适应性饲养7 d,试验期间小鼠均在室温(24±2)℃、相对湿度(50±5)%、光/暗周期12 h/12 h的环境下喂养,并按试验动物使用的3R原则给予人道的关怀。
1.1.2 材料与试剂
皮质酮(CORT):北京索莱宝科技有限公司;
VB6、VB3和SOD:食品级,纯度≥95%,深圳中科欣扬生物科技有限公司;
TRP肽:食品级,纯度≥95%,无限极中国有限公司;
氟西汀分散片(百忧解):礼来苏州制药有限公司;
生化试剂盒购:江莱生物科技有限公司。
1.1.3 主要仪器
小鼠高架十字迷宫视频分析测试系统:XR-XG201型,上海软隆科技发展有限公司;
小鼠旷场视频分析测试系统:XR-XZ301型,上海软隆科技发展有限公司;
小鼠强迫游泳视频测试分析系统:SA2091型,上海软隆科技发展有限公司;
多功能酶标仪:FilterMax F3/F5型,美国Molecular Devices公司;
电子天平:FA2204B型,上海精密科学仪器有限公司。
1.2 试验方法
1.2.1 焦虑性抑郁症动物模型建立 84只雄性C57BL/6小鼠在湿度(60±10)%和温度(25±2)℃条件下饲养(每笼5只;320 mm×215 mm×170 mm),标准实验室条件下,昼夜交替12 h,随意获取正常食物和水,在华南农业大学实验动物中心进行试验。试验方案经华南农业大学动物实验中心委员会批准,并遵循中国试验动物护理和使用指南。小鼠适应性喂养7 d开始造模,造模方法根据Zhu等[2]报道的方法进行。将小鼠随机分配到7个试验组(n=12)并每周称重。5组受到慢性束缚应激(Chronic restraint stress,CRS)(6 h/d,9:00~15:00),然后皮下注射皮质酮(CORT)溶解于含有0.1%二甲基亚砜(DMSO)和0.1% Tween-80的生理盐水中[剂量30 mg/(kg·d)]。溶媒对照组(VG)给予CRS(6 h/d,9:00~15:00),并以0.02 mL/g体重的体积皮下给予生理盐水。将正常对照(NC)小鼠禁食(6 h/d,9:00~15:00),并以0.02 mL/g体重的体积皮下给予生理盐水。连续造模21 d后,5组受到慢性束缚应激,然后皮下注射皮质酮的小鼠均表现出不同程度的焦虑和抑郁样行为,然后将这5组焦虑和抑郁样行为的小鼠随机分配到不同的治疗组。NC为生理盐水治疗的正常对照组;VG为生理盐水治疗用溶媒对照组;PC为盐酸氟西汀治疗阳性对照组(98%),18 mg/(kg·d);MC为用生理盐水治疗的模型对照组;VBPSH、VBPSM、VBPSL分别为高、中、低剂量维生素B族复合TRP肽和SOD配方治疗组,260,195,130 mg/(g·d)。将所有治疗剂溶解在上述盐水中,每只小鼠体积为10 mL/(kg·d)。
1.2.2 强迫游泳试验 在建模后(第4周)和治疗4周后(第8周),在白天对所有小鼠进行动物强迫游泳行为试验。在整个测试过程中,为了获得准确的结果必须确保小鼠行为学试验在一个安静和平稳的环境下进行,且整个试验过程中保持温度为(25±1)℃。根据Poleszak等[18]报道的方法,该测试在2 d内进行两次。第一阶段测试:将每只小鼠单独轻轻放入装有水(水位高度15 cm)的玻璃圆筒(Φ10 cm×25 cm),使每只试验小鼠适应游泳6 min。第二阶段测试:适应游泳结束24 h后,开始第二阶段的试验,总共6 min。其中将动物放入圆筒中并使其适应游泳1 min;然后开始一个5 min的测试,测试过程中使用数码摄像系统跟踪和记录动物的运动和行为,测量不动的总持续时间(s)。游泳不动标准:当试验小鼠浮动时,仅用一只脚轻轻划动或稍微移动,以保持其头部高于水,而不挣扎。试验结束后,立即将小鼠从水中取出并放回饲养笼。
1.2.3 旷场试验 试验设备为方形盒(40 cm长×40 cm宽×40 cm高),材料为白色聚氯乙烯。试验根据朱明好等[19]的方法进行并有所改进,每次试验之前或者两次测试之间用70%乙醇水溶液彻底清洗实验设备并使其干燥,以消除前一次测试留下的尿液和粪便气味的影响。在整个测试过程中,为了获得准确的结果必须确保小鼠行为学试验在一个安静和平稳的环境下进行。该测试还包括两个阶段:预测试,其中将动物轻轻放置在盒子的最右上角并允许适应15 min;在预测试结束24 h后进行10 min 的测试,其中每只小鼠再次单独放置在盒子的最右上角并允许自由移动,其运动和行为也使用数字摄像系统记录。在试验结束后,立即将小鼠从盒子中取出并放回饲养笼。对视频进行分析,将箱底板分成16个相等尺寸(10 cm×10 cm)的小方块,记录每只小鼠在每个小方块中花费的时间。按式(1)计算中央停留时间百分比。
(1)
式中:
c——中央停留时间百分比,%;
m1——旷场试验中央区域停留时间,s;
m2——旷场试验总测试时间,s。
1.2.4 高架十字迷宫试验 根据Walf等[20]的方法略有修改,在旷场试验结束2 d后进行高架十字迷宫试验。迷宫由一个十字形平台组成,有两个开放式臂(长30 cm×宽5 cm)和两个闭合臂(30 cm长×5 cm宽×15 cm深),两个臂有一个共同的中心区(5 cm长× 5 cm宽),测试时整个迷宫被抬高到距离地面80 cm的高度。同样,在整个测试过程中,为了获得准确的结果必须确保小鼠行为学试验在一个安静和平稳的环境下进行。将每只小鼠单独放置在面向其中一个开臂的迷宫中心上,适应1 min后并用数码摄像系统记录其5 min运动和行为。对于视频分析,记录了开臂进入次数和开臂停留时间百分比。每次试验之前或者两次测试之间用70%乙醇水溶液彻底清洗试验设备并使其干燥,以消除前一次测试留下的尿液和粪便气味的影响
1.2.5 小鼠体重和生化指标测定 小鼠体重从适应性喂养1周开始,以后每周测定一次小鼠体重并记录数据,建模与灌胃期间共7周,收集3次体重数据进行分析,分别是初始体重、建模后体重和治疗后体重。初始体重为适应性喂养第1周体重;建模后体重为第4周体重;治疗后体重为第8周体重。计算小鼠不同处理时期体重变化指数。行为学试验测试24 h后,所有试验小鼠用4%水合氯醛(腹腔注射0.1 mL/10 g)深度麻醉,并通过眼球摘除取血和脊柱脱位处死。首先,将摘除眼球的小鼠的血液立即收集到含有EDTA的2.0 mL离心管中,在(25±1)℃ 下保持30 min,并在3 000×g和4 ℃下离心15 min 以收集上清液(血清)。根据试剂盒说明书,通过酶联免疫吸附试验(ELISA)和比色法测定血清TNF-α,IL-6,IL-1β和IFN-γ水平。眼球取血后,在冰上快速取下海马和下丘脑,用冰冷的生理盐水溶液冲洗,用吸水纸吸水后,再加入9倍体积的PBS(pH 7.4)后,用均质仪将样品匀浆,然后在4 ℃(3 000×g,20 min)下离心取上清。根据试剂盒说明书,通过酶联免疫吸附试验(ELISA)和比色法测定上清液中TRP、KYN、NAD+、KYNA和MDA的含量,以及SOD、CAT、NOS的活性。
1.2.6 数据处理 采用 SPSS 17.0(SPSS Inc.,Chicago,IL,USA)统计分析软件进行单因素方差分析(One-way ANOVA),所有试验均重复3次。采用Duncan’s post-hoc检测对各数据间的平均值进行差异显著性分析,并对各组数据平均值显著性差异进行评价(P<0.05)。数据表述采用(平均值±方差)的形式。
2 结果与讨论
2.1 VBPS配方对小鼠日常活动和体重的影响
在整个试验过程中,NC小鼠在行为方面表现正常,包括进食、饮水、运动、排便和排尿均表现正常状态,而MC小鼠则表现出无精打采,体重增加缓慢,运动缓慢,进食和饮水减少等症状。在造模期间(0~3周),受CRS和CORT诱导应激的小鼠均表现出无精打采,体重增加缓慢,运动缓慢,饮食和饮水减少。在给药期(4~7周)后,观察到治疗小鼠的焦虑性抑郁行为得到改善,包括体重增加,进食和饮水增加。在建模过程中,NC(5.64 g)和VG(3.46 g)小鼠的体重增加指数显著高于造模小鼠(MC、PC、VBPSH、VBPSM和VBPSL),且造模组之间的体重增加指数[(1.59±0.13)g]没有显著性(P>0.05)的差异(图1)。灌胃处理4周后,与正常组比较,MC组(焦虑性抑郁症未治疗组)体重增加指数显著减少(P<0.05);与模型组相比,各处理组小鼠体重增加指数均明显高于(P<0.05)MC处理组小鼠。阳性对照组(PC)和VBPSH处理组体重增加指数最为明显,其次为VBPSM和VBPSL处理组。综上所述,VBPS处理可改善焦虑性抑郁症小鼠体重增加缓慢的症状。
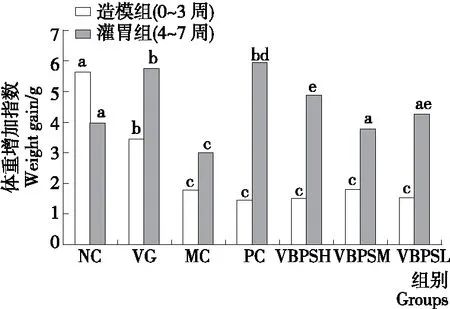
图1 VBPS处理对小鼠体重增加指数的影响
2.2 VBPS配方对焦虑性抑郁症小鼠抑郁样行为的影响
在造模21 d后,CRS和CORT注射处理组小鼠强迫游泳行为学试验的游泳不动时间和总游泳距离与NC(179.42 s;12.36 m)或VG(211.21 s;11.03 m)相比,分别显著增加和减少(P<0.05)(表1)。与NC组相比,VG小鼠的不动时间显著增加(P<0.05)和游泳总距离显著减少(P<0.05)。结果表明,21 d连续CRS可诱导游泳不动时间增加和游泳总距离减少,可造成小鼠明显的抑郁样行为。此外,连续CRS联合CORT背部皮下注射可引起小鼠明显出现抑郁样行为。给药处理4周后,PC组游泳不动时间(155.11 s)显著下降,游泳总距离显著增加(12.25 m)。而MC组小鼠游泳不动时间最长(260.08 s)和游泳总距离最短(4.06 m)。VG(193.56 s)和VBPSH(186.06 s)组小鼠游泳不动时间与NC(186.17 s)组小鼠相比没有(P>0.05)显著差异。PC和VBPS(H、M和L)组小鼠游泳不动时间显著低于(P<0.05)和游泳总距离显著高于(P<0.05)MC组小鼠。PC(157.29 s)组小鼠游泳不动时间显著(P<0.05)低于和游泳总距离显著高于(P<0.05)VBPS各处理组小鼠。综上所述,盐酸氟西汀和VBPS均可显著改善了焦虑性抑郁症小鼠的抑郁样行为,盐酸氟西汀的效果优于VBPS。
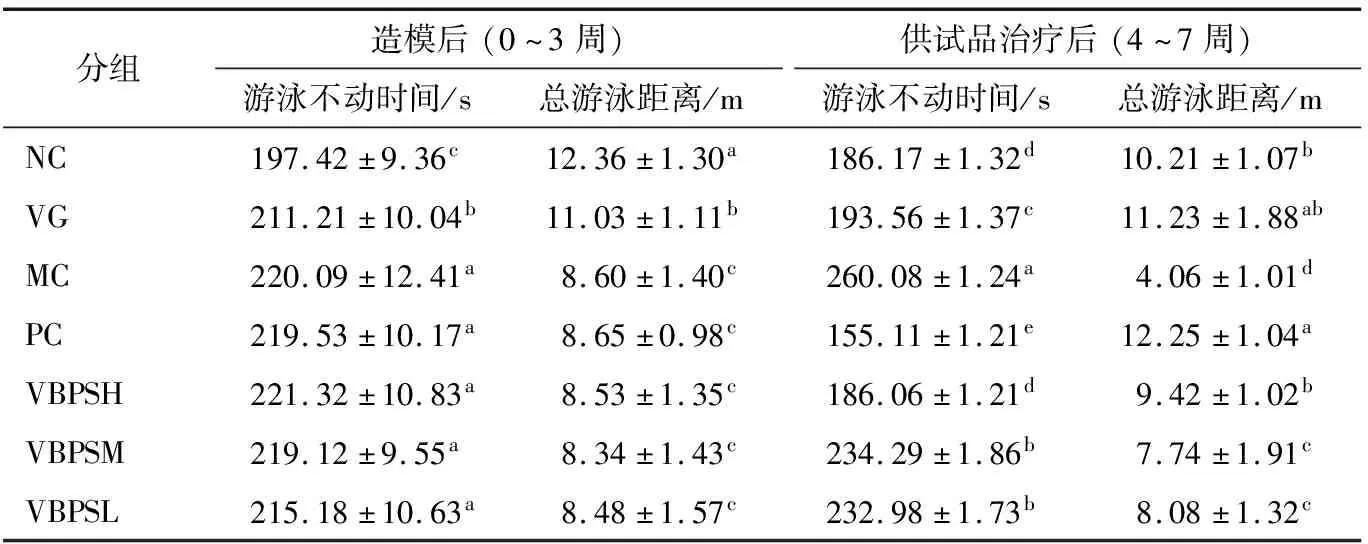
表1 VBPS对强迫游泳试验中小鼠行为的影响†
† 同列字母不同表示差异显著(P<0.05)。
2.3 VBPS配方对焦虑性抑郁症小鼠焦虑样行为的影响
在给药4周后,不同处理组小鼠在开臂停留时间百分比和开臂进入次数百分比之间存在显著差异(P<0.05),结果如图2所示。NC和VG组小鼠在高架十字迷宫试验中的开臂停留时间百分比均显著高于各供试品治疗组,MC组小鼠开臂停留时间百分比显著低于(P<0.05)其他组小鼠;PC和VBPSH处理组小鼠的开臂停留时间百分比显著(P<0.05)高于VBPSM和VBPSL处理组小鼠。NC和VG组小鼠再旷场试验中的中央停留时间百分比仍然明显高于(P<0.05)其他处理组小鼠。MC组小鼠试验结果表明,中央停留时间百分比明显低于(P<0.05)其他处理组小鼠。然而,在PC处理组小鼠和VBPS(H、M、L)处理组小鼠中央停留时间百分比与MC组小鼠相比显著增加(P<0.05)。
在高架十字迷宫测试中,运动轨迹和进入开臂的最大深度表明NC小鼠没有表现出类似焦虑的行为(图3)。在MC小鼠中,观察到在闭臂中的运动较少且在开臂中基本没有运动,并且观察到停留在闭臂的角落里,表现出明显的焦虑样行为。结果表明,PC和VBPS可在4周治疗后缓解焦虑性抑郁症小鼠的焦虑样行为。图4显示了在旷场试验中给药4周后每组的总运动轨迹(10 min 内)。MC小鼠大多远离中心(在边缘和角落周围),然而,PC和VBPS(H、M和L)运动轨迹显著(P<0.05)增加。因此,结果表明VBPS在减轻小鼠焦虑样行为方面更有效。
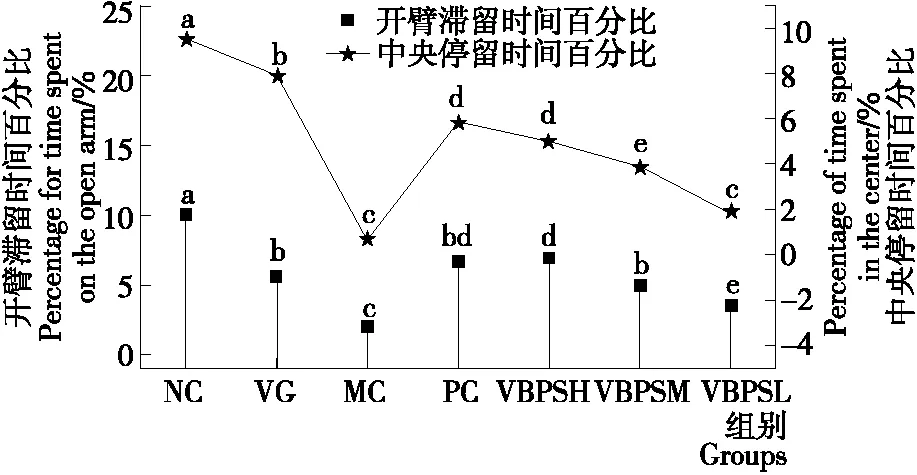
图2 VBPS对焦虑性抑郁症小鼠焦虑样行为的影响
Figure 2 The effects of VBPS on anxious-like behaviors in the anxious depression mice
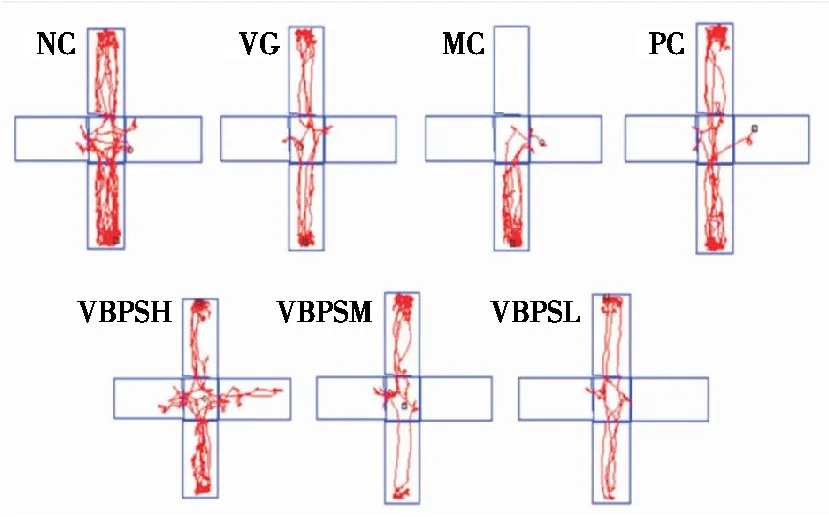
图3 VBPS对焦虑性抑郁症小鼠高架十字迷宫试验运动轨迹的影响
2.4 VBPS配方对焦虑性抑郁症小鼠血清炎症因子水平的影响
VBPS对焦虑性抑郁症小鼠炎症因子的影响如表2所示。与其他组相比,MC小鼠血清炎症因子(TNF-α、IL-6、IL-1β和IFN-γ)水平显著(P<0.05)高于其他各组。各组小鼠TNF-α水平按照依次降低的顺序为MC>VBPSM>VBPSL>VBPSH>PC>NC>VG。检测到各组小鼠IL-6的水平按照依次降低的顺序为MC>VBPSL>VBPSM>VBPSH>PC>VG>NC。各组小鼠IL-1β的水平依次递减顺序为MC>VBPSM>VBPSL>VBPSH>PC>VG>NC。各组小鼠IFN-γ水平水平按照依次降低的顺序为MC>VBPSL>VBPSM>VBPSL>VG>PC>NC。血清IL-6和TNF-α升高被认为是焦虑性抑郁症的标志物,IL-6的增加也被提出可以作为焦虑、抑郁症加强的预测,IL-6水平正常化被认为是焦虑和抑郁的缓解症状[21-23]。PC和VBPS(H、M和L)组小鼠血清TNF-α、IL-6、IL-1β和IFN-γ水平均显著高于(P<0.05)NC组小鼠,PC和VBPS(H、M和L)组小鼠血清TNF-α、IL-6、IL-1β和IFN-γ的水平显著低于(P<0.05)MC组小鼠。血清TNF-α、IL-6、IL-1β和IFN-γ水平越高说明炎症反应越强。以上结果表明,MC组小鼠血清炎症水平较高,通过VBPS灌胃4周后,焦虑性抑郁症小鼠血清炎症水平与模型组相比均有显著下降(P<0.05),证明其体内炎症反应减轻,焦虑性抑郁症得到改善。因此,VBPS可能是焦虑性抑郁症小鼠的有效抗焦虑、抑郁膳食补充剂,并且其作用机理可能部分通过抗炎作用介导。

图4 VBPS对焦虑性抑郁症小鼠旷场试验运动轨迹的影响
2.5 VBPS配方对焦虑性抑郁症小鼠海马和下丘脑抗氧化能力的影响
研究[24]表明,大脑更容易受到氧化应激的不利影响。焦虑性抑郁症与ROS和RNS升高有关;此外,ROS和RNS的升高导致MDA增加(由氧化应激诱导的细胞膜损伤引起的体内脂质过氧化的决定性标志)和抗氧化酶活性增加[25-26]。如表3所示,慢性束缚应激联合皮质酮背部皮下注射诱导的焦虑性抑郁症小鼠的海马和下丘脑中的MDA水平升高,SOD、CAT、NOS活性增加。NC、VG、PC和VBPS处理组小鼠海马和下丘脑的MDA浓度显著降低(P<0.05)于MC组小鼠。NC、VG、PC和VBPS处理组小鼠的SOD、CAT、NOS活性也显著降低,与MC组相比有显著差异(P<0.05)。与NC组小鼠相比,PC和VBPS处理组小鼠海马和下丘脑中的MDA水平和SOD、CAT、NOS活性显示出显著增加(P<0.05)。综上所述,VBPS改善海马和下丘脑组织MDA水平和SOD、CAT、NOS活性与PC具有相同趋势。MDA、SOD、CAT、NOS在参与神经变性的脑神经元中表达增加,其活性增加可能反映了焦虑性抑郁症的症状增加,系统上调以抵抗焦虑性抑郁中ROS和RNS的增加[25]。试验结果表明VBPS能够有效地降低焦虑性抑郁症小鼠海马和下丘脑组织中MDA水平和SOD、CAT、NOS活性,缓解焦虑性抑郁症小鼠的氧化应激损伤。
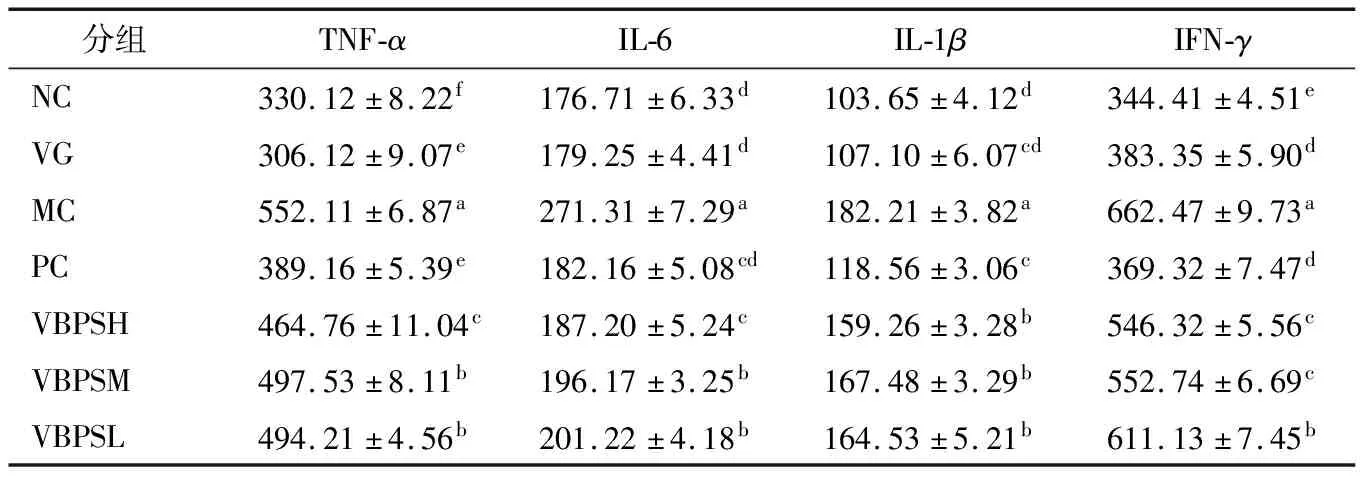
表2 VBPS对焦虑性抑郁症小鼠炎症因子水平的影响†
† 同列字母不同表示差异显著(P<0.05)。
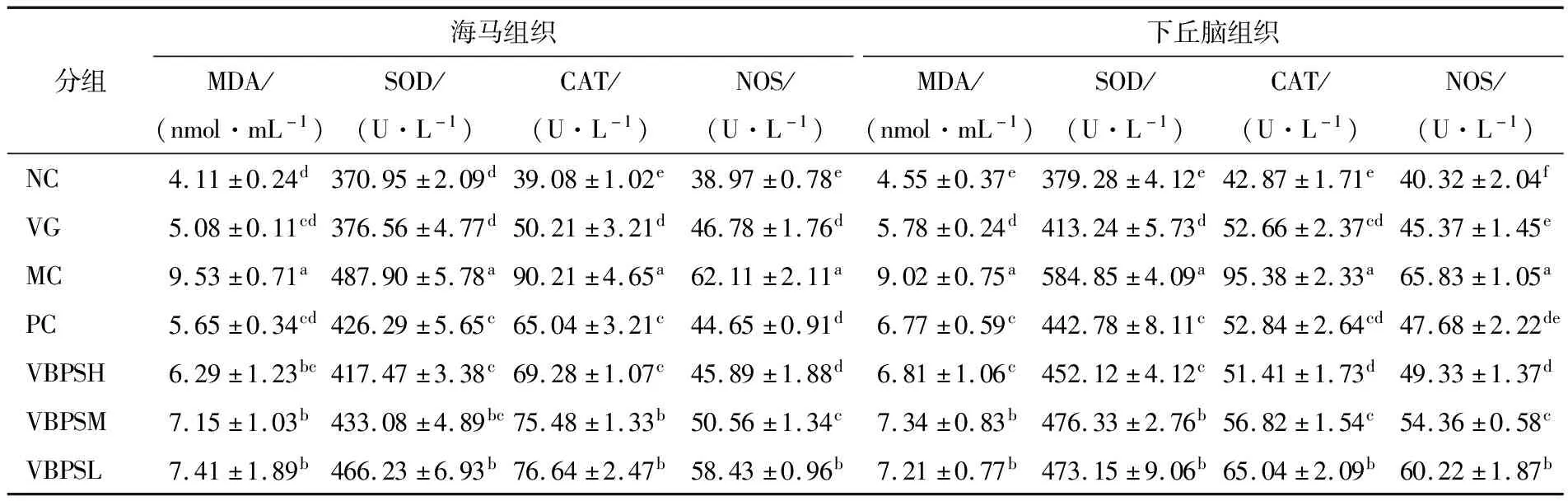
表3 VBPS对MDA含量和抗氧化酶活性的影响†
† 同列字母不同表示差异显著(P<0.05)。
2.6 VBPS配方对焦虑性抑郁症小鼠海马组织TRP代谢的影响
如图5所示,MC组小鼠的5-HT/Trp和NAD+/KYN比值在海马组织中均显著(P<0.05)低于其余各组,而KYN/TRP比值显著高于(P<0.05)其余各组。5-HT/Trp比值分析可知,PC组与NC组小鼠之间没有显著差异,但是VBPS灌胃治疗组显著低于(P<0.05)PC和NC组小鼠。PC、VBPSH和VBPSM组小鼠KYN/TRP比值之间没有显著差异,PC和VBPSH组小鼠之间NAD+/KYN比值没有显著差异。综上所述,VBPS能够提高5-HT/Trp和NAD+/KYN值,降低KYN/TRP的比值,且具有剂量依赖性增加的趋势。VBPS可能通过降低炎症因子水平或增加氧化应激降低犬尿氨酸代谢途径的关键限速酶IDO和TDO酶活性,上调5-HT-TRP代谢,下调TRP-KYN代谢。通过膳食补充KYN-NAD+途径辅酶因子维生素B6和NAD+合成的前体物质维生素B3,增加NAD+的合成。
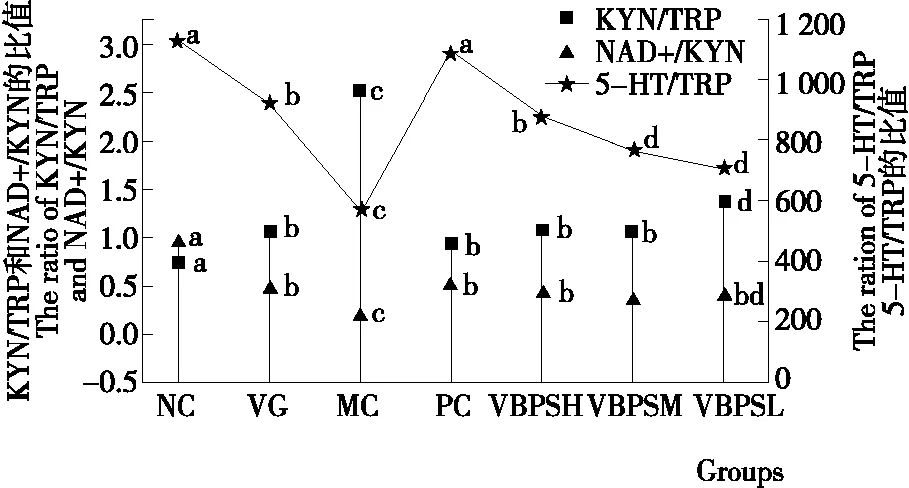
图5 VBPS对焦虑性抑郁症小鼠TRP代谢的影响
3 结论
试验以维生素B族复合TRP肽和SOD配方(VBPS)作为膳食补充剂,研究VBPS对焦虑性抑郁症小鼠改善作用。结果表明VBPS能够逆转焦虑性抑郁症小鼠的焦虑样和抑郁样行为、改善其体重增加缓慢的症状,具有剂量依赖性增加的趋势。VBPS能够降低血清NF-κB、TNF-α、IL-6、IL-1β和IFN-γ水平和MDA的含量,增加SOD、CAT和NOS的活性。此外,VBPS可诱导TRP-KYN代谢下调和5-HT/TRP、KYN-NAD+代谢上调。其作用的可能机制为VBPS通过降低炎症因子水平和增加抗氧化作用降低KYN代谢途径的关键限速酶IDO和TDO活性,上调5-HT-TRP代谢,下调TRP-KYN代谢。通过膳食补充KYN-NAD+途径辅酶因子维生素B6和NAD+合成的前体物质维生素B3,增加NAD+的合成。综上所述,与焦虑性抑郁症对照组小鼠相比,VBPS治疗的小鼠具有抗炎、抗氧化、逆转焦虑性抑郁症小鼠行为障碍和体重增加缓慢的作用,从而证明膳食补充VBPS具有显著的改善焦虑性抑郁症的作用。

