沸石改性去除有机污染物吸附动力学教学实验探究*
杨丽霞,贾晓萌,肖远强,陈 森,曹雪丽,周 森
(中国地质大学(武汉)材料与化学学院化学学科,湖北 武汉 430074)
随着我国高等教学模式的不断改革,实验教学目的开始逐渐变为培养学生的创新意识以及独立思考问题的能力。要求学生从单纯地掌握书本知识逐渐转变为对综合素质及动手能力的考查成为教学过程的重点[1]。
“化学动力学基础”和“固体表面的吸附”是物理化学基础理论课中的重点内容,其中的化学动力学是认知反应机理的基础,固体表面的吸附更是广泛应用于现代化学中的分离、检测、催化等重要的前沿领域。在实际教学过程中,我们发现学生主动学习的兴趣和积极性不够高,创造性得不到充分发挥。为了充分发挥学生的主观能动性,引导学生思考问题、分析问题并有效解决问题,我们充分利用现有教学实验设备和教学资源,在学生认识Freundlich经验公式和Langmuir吸附等温式的基础上,改进了物理化学中有关固体-溶液界面上的吸附基础教学实验,以天然沸石为研究对象,对其中的沸石吸附动力学实验进行重新设计,让学生从微观角度认识物质性能与结构的关系,进一步加深对吸附动力学的认知;在此基础上启迪学生科学的思维方法与创新意识,培养科研协作精神与创新能力,并进一步提高物理化学实验课教学质量[2]。
1 实验目的
(1)了解沸石结构及其性质,认识天然沸石改性常用方法。(2)采用分光光度法比较研究天然沸石及改性沸石对有机染料的吸附性能。(3)掌握吸附准一级反应、准二级反应动力学方程模型的建立和验证方法。(4)了解材料表面形貌的表征方法。
2 实验原理
沸石作为一种廉价并且吸附性能优越的吸附材料,被广泛地应用于物理化学教学实验中。沸石种类多样且结构复杂,是一种含有水和碱(或碱土金属)的铝硅酸盐矿物[3],具有多孔道的架状结构。为实现理论教学与实践的紧密结合,我们选择了处理广泛,对人体伤害较小的染料废水作为处理对象。目前染料废水随着工业的发展逐渐成为最难处理的废水之一[4],一些常见的有机污染物如酚类、苯胺等均可被沸石吸附[5-6]。沸石特殊的硅氧结构导致了对有机物有较好的吸附性能[7],研究发现对沸石进行一定的改性,能使其更广泛地应用于水处理范畴,进一步提高对有机物的吸附效能[8-9]。本实验引导学生从沸石改性的角度出发,在新材料合成的基础上进行相应的吸附动力学研究。该过程包含了改性合成-对比测试-模型建立与验证-结构表征等4个化学科研试验重要步骤,充分考虑到了理论知识与实际应用的有机联系,实现激发学生科研兴趣与提高理论与实践能力的目的。
本实验涉及“物理化学”课程中的“固体表面的吸附”、“化学动力学基础”两部分内容。沸石作为一种较好的吸附材料,其主要的原理是沸石空间网架结构中充满了大小不一的空腔与孔道,这种特殊的结构使沸石拥有离子交换、选择吸附等优异性能[10-13]。沸石对氨氮的吸附能力通常用吸附量来表述,吸附平衡时的平衡吸附量qe、吸附一定时间t时的吸附量qt,可分别按下述公式计算
(1)
(2)
式中,qt为时间t时的吸附量,mg·g-1;qe为平衡吸附量,mg·g-1;C0为溶液中染料的初始浓度,mg·L-1;Ce为吸附平衡后溶液的染料浓度,mg·L-1;Ct为吸附t时刻的溶液中染料浓度,mg·L-1;V是吸附液体积,L;m是吸附材料质量,g。
根据物理化学“化学动力学基础”中的定义:反应速率只与某一物质浓度的一次方成正比的反应称为准一级反应;这里如果假设吸附过程符合准一级动力学模型,即吸附速率(吸附速率不同于吸附反应速率)只与被吸附物质(有机染料)浓度的一次方有关,那么可以假设吸附过程的反应如下:
拟一级动力学模型:
(3)
对该式进行不定积分得:
(4)
将边界条件:
t=0,q=0;t=t,q=qt代入上式可得:
ln(qe-qt)=lnqe-k1t
(5)
若以ln(qe-qt)对t作图可以得到一条近似直线,则说明沸石的吸附符合准一级动力学过程,其中的k1为一级反应速率常数,单位是s-1。
同理,反应速率与物质浓度的二次方成正比的反应为准二级反应。假设沸石的吸附速率与有机染料浓度的二次方成正比,则吸附反应如下:
拟二级动力学模型:
(6)
对该式进行不定积分得
(7)
将边界条件t=0,q=0;t=t,q=qt代入可得:
(8)
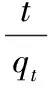
本教学设计实验以研究沸石改性前后的吸附性能为基础,通过吸附动力学模型法对不同吸附时间有机染料的吸附量进行研究。吸附动力学模型主要表达了吸附过程中吸附材料的吸附量随时间的变化情况,反映了吸附材料对吸附质的吸附速率快慢,从而揭示吸附材料结构与其吸附性能的关系。通过吸附时间对吸附的影响实验可为动力学模型拟合提供必要数据,本实验所采用的动力学模型主要为:准一级动力学方程(Pseudo-first-order)、准二级动力学方程(Pseudo-second-order)。吸附等温线表示的是在一定吸附温度下,吸附达到平衡时,吸附液中残留的吸附质浓度(Ce)与吸附材料的平衡吸附容量(qe)之间的关系曲线。
本实验采用分光光度法测有机染料物质罗丹明B的浓度,通过吸附量qt表征处理效果,以罗丹明B模拟废水的主要成分,对天然沸石进行0.5 mol/L NaCl活化,分别研究了活化改性前后沸石对染料有机废水的吸附行为;通过建立动力学模型,绘制了改性前后沸石任意时刻的染料吸附浓度曲线,并采用扫描电镜对沸石的表面形貌进行分析,探究改性后沸石对有机废水的处理效果及其与材料结构的关系。
3 实验教学设计
3.1 主要仪器与试剂
仪器:扫描电子显微镜、恒温水浴锅、磁力搅拌器、电子天平、振荡器、烘箱、分光光度计、具塞三角瓶、漏斗、铁架台、烧杯、容量瓶、锥形瓶、移液管、称量瓶等。
试剂:天然沸石、氯化钠、硝酸银、罗丹明B。
3.2 有机废水水样的配制
准确称取500 mg罗丹明B固体,用去离子水定容到1000 mL的容量瓶中,制备浓度为500 mg/L的罗丹明B储备液。用移液管移取1 mL的储备液,再用9 mL的去离子水定容。稀释制得50 mg/L的罗丹明B使用液。
3.3 改性沸石的制备
配制浓度为0.5 mol/L的氯化钠溶液, 向具塞三角瓶中加入10 g天然沸石和250 mL 0.5 mol/L氯化钠溶液,将其置于恒温水浴锅中控制在70~80 ℃,浸泡2 h。将改性液倒出,用去离子水多次洗涤改性沸石,并用硝酸银溶液检验,尽可能将残留的Cl-洗去。将改性沸石置于表面皿上于105 ℃下烘干1 h备用。
3.4 最大吸收波长的测定以及标准曲线的绘制
将罗丹明B使用液分别稀释为1 mg/L、2 mg/L、3 mg/L、4 mg/L、5 mg/L和10 mg/L,以去离子水做参比;在520~580 nm范围内测定最大吸收波长(每隔5 nm测定一个吸收波长),在最大吸收波长处测定浓度C和吸光度A的标准曲线A-C。
3.5 天然沸石和改性沸石吸附染料的吸附动力学实验研究
向盛有100 mL含染料100 mg/L溶液的具塞三口瓶中分别加入1.0583 g天然沸石和0.4880 g改性沸石,在室温下,在振荡器中以一定的振荡速度振荡,分别在5、10、15、20、30、40、50、60、80、100、120 min时从锥形瓶中准确移取沸石沉淀后的上清液1.00 mL溶液置于一个洁净干燥的小烧杯中,再向烧杯中准确移取9.00 mL去离子水,混合均匀后,在分光光度计中,以去离子水为参比,在最大吸收波长处测量溶液吸光度值At,根据标准曲线计算t时刻,溶液中染料的浓度Ct,根据公式计算t时刻的吸附量qt和平衡吸附量qe。
采用准一级和准二级动力学模型或其他动力学模型对吸附数据进行拟合,确定样品对染料吸附过程中合适的动力学模型,并分析相应动力学特征。
3.6 改性沸石表面形貌分析
采用日立高新SU8010冷场扫描电子显微镜对改性前及改性后沸石的表面形貌进行分析。
4 结果与讨论
4.1 最大波长与标准曲线的绘制
对10 mg/L的罗丹明B标准溶液进行不同波长的吸光度测试,以确定最大吸收波长。绘制的吸光度-波长曲线如图1所示。
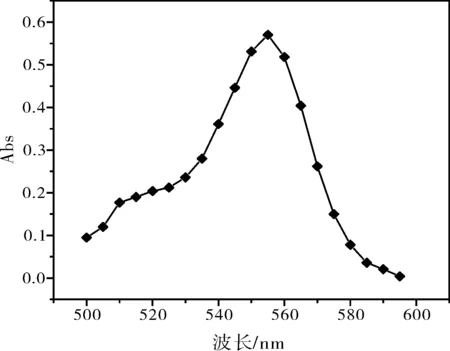
图1 10 mg/L罗丹明B溶液的吸光度-波长曲线
由图1可知最大吸光度对应的波长为555 nm,以下实验中标准曲线的绘制以及任意时刻吸附浓度的测量均采用这一波长。分别以1 mg/L、2 mg/L、3 mg/L、4 mg/L、5 mg/L和10 mg/L罗丹明B作标准溶液,以去离子水做参比在最大吸收波长处测定浓度C和吸光度A的标准曲线A-C,实验结果如图2所示。
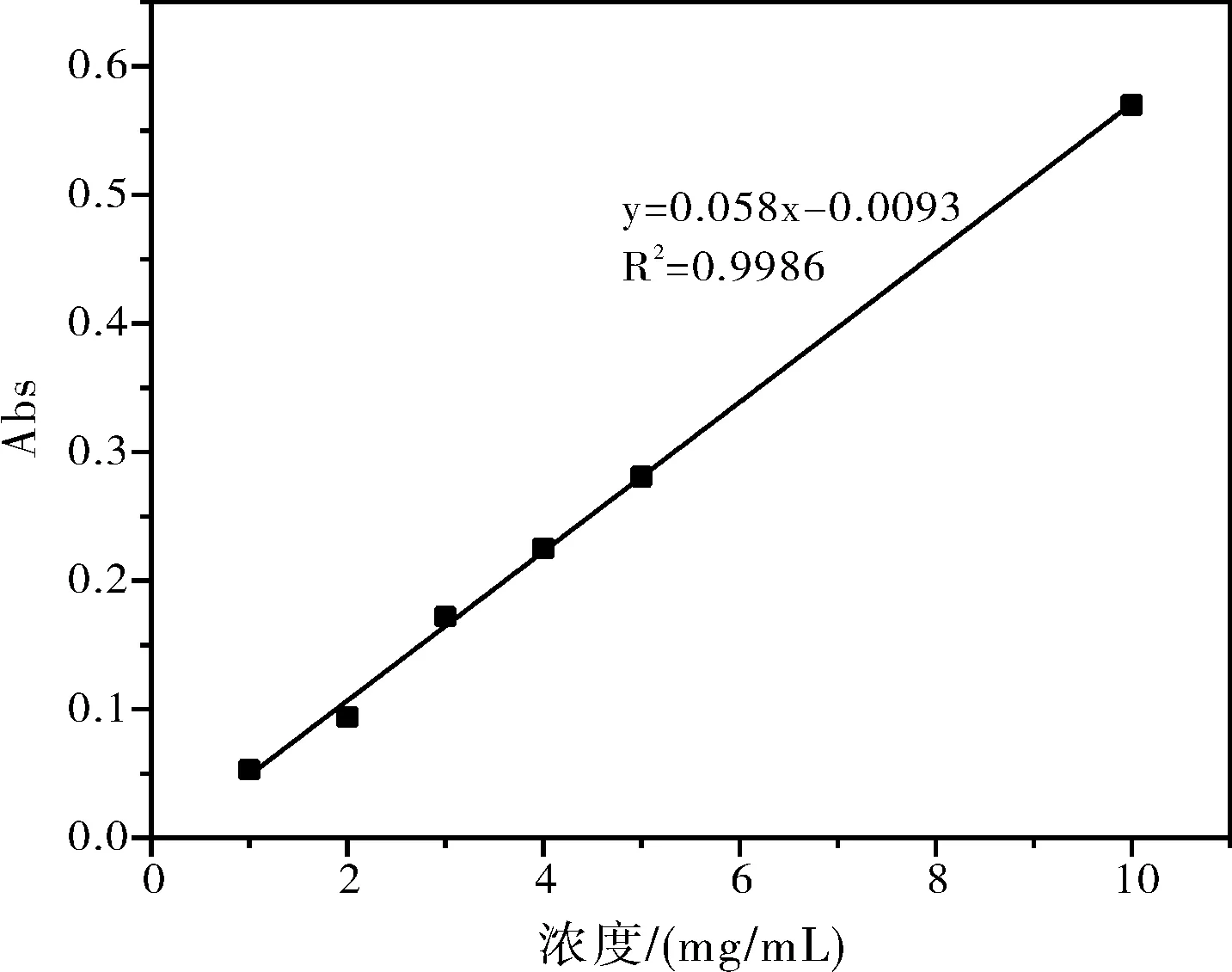
图2 罗丹明B溶液的吸光度-浓度曲线
4.2 沸石改性前后的吸附能力(吸附量)的计算
改性前最大吸收波长处的吸光度、染料浓度及吸附量随时间动态变化结果如表1所示。
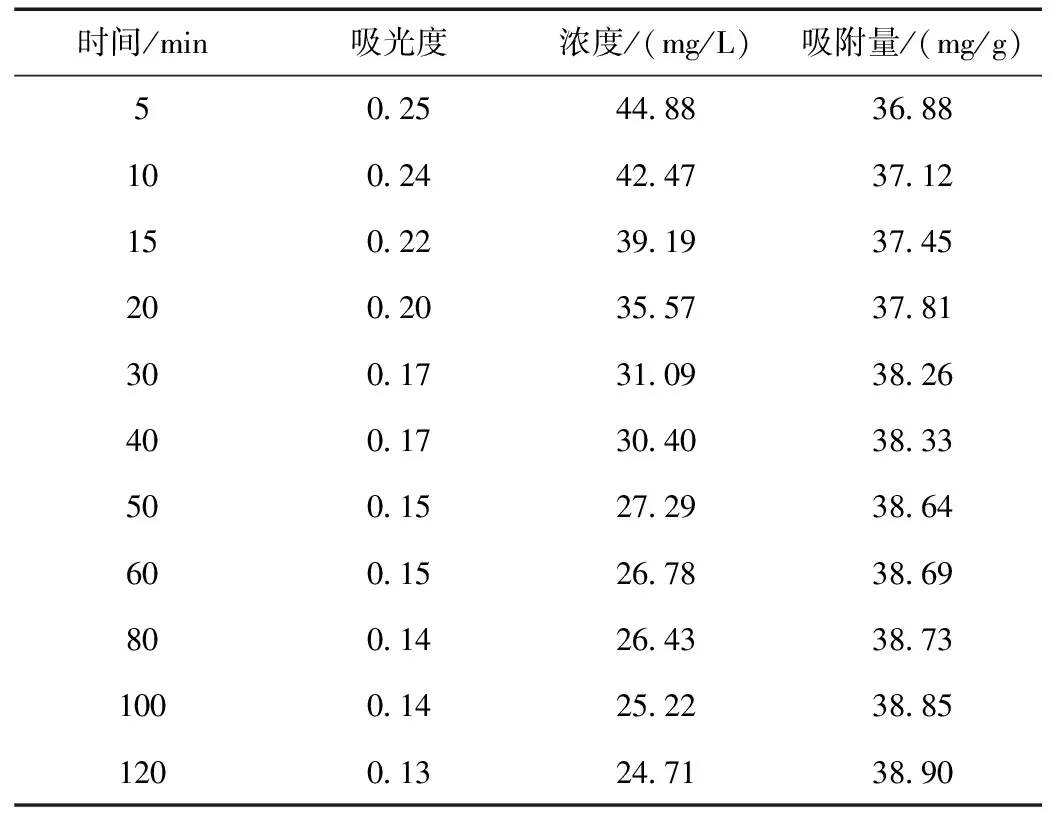
表1 沸石改性前最大吸收波长处的吸光度、染料浓度及吸附量随时间的动态变化结果
沸石改性后最大吸收波长处的吸光度、染料浓度及吸附量随时间的动态变化结果如表2所示。
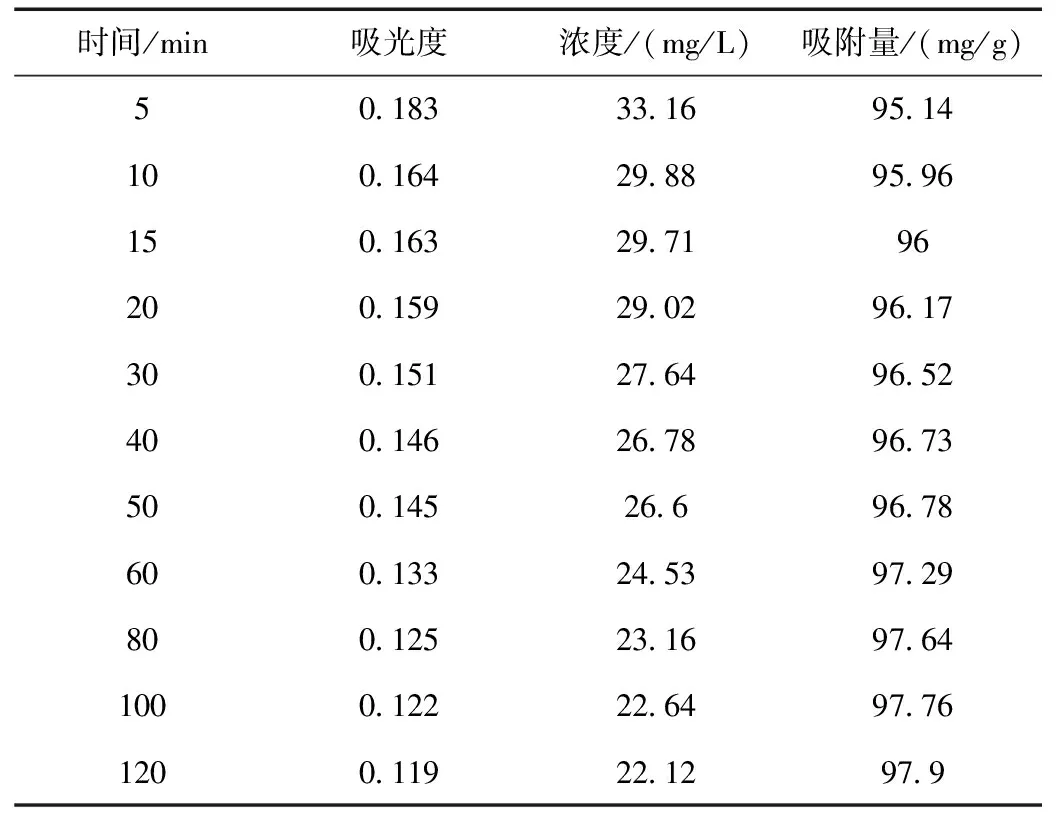
表2 沸石改性后最大吸收波长处的吸光度、染料浓度及吸附量随时间的动态变化结果
对吸附前染料溶液进行吸光度的测定(Abs=2.390),代入标准曲线得到初始的浓度C0为413.7 mg/L。以天然沸石的第一组数据为例,对吸附5 min后染料的浓度和吸附量qt进行计算:
C0=(Abs0+0.093)/0.058=(2.390+0.093)/0.058×10
=413.7 mg/L
C(5 min)=(Abs(5 min)+0.093)/0.058×10=(0.251+0.093)/0.058×10=44.88 mg/L
分别计算天然沸石和改性沸石的平衡吸附量qe:
4.3 沸石吸附动力学模型的拟合以及沸石改性前后吸附能力的比较
根据准一级动力学模型和准二级动力学模型分别对沸石改性前后的吸附结果进行拟合如图3和图4所示。由图3和图4可知,天然沸石和改性沸石的吸附动力学对准二级吸附曲线的线性更好,由此基本可以推断沸石的吸附符合准二级动力学方程。
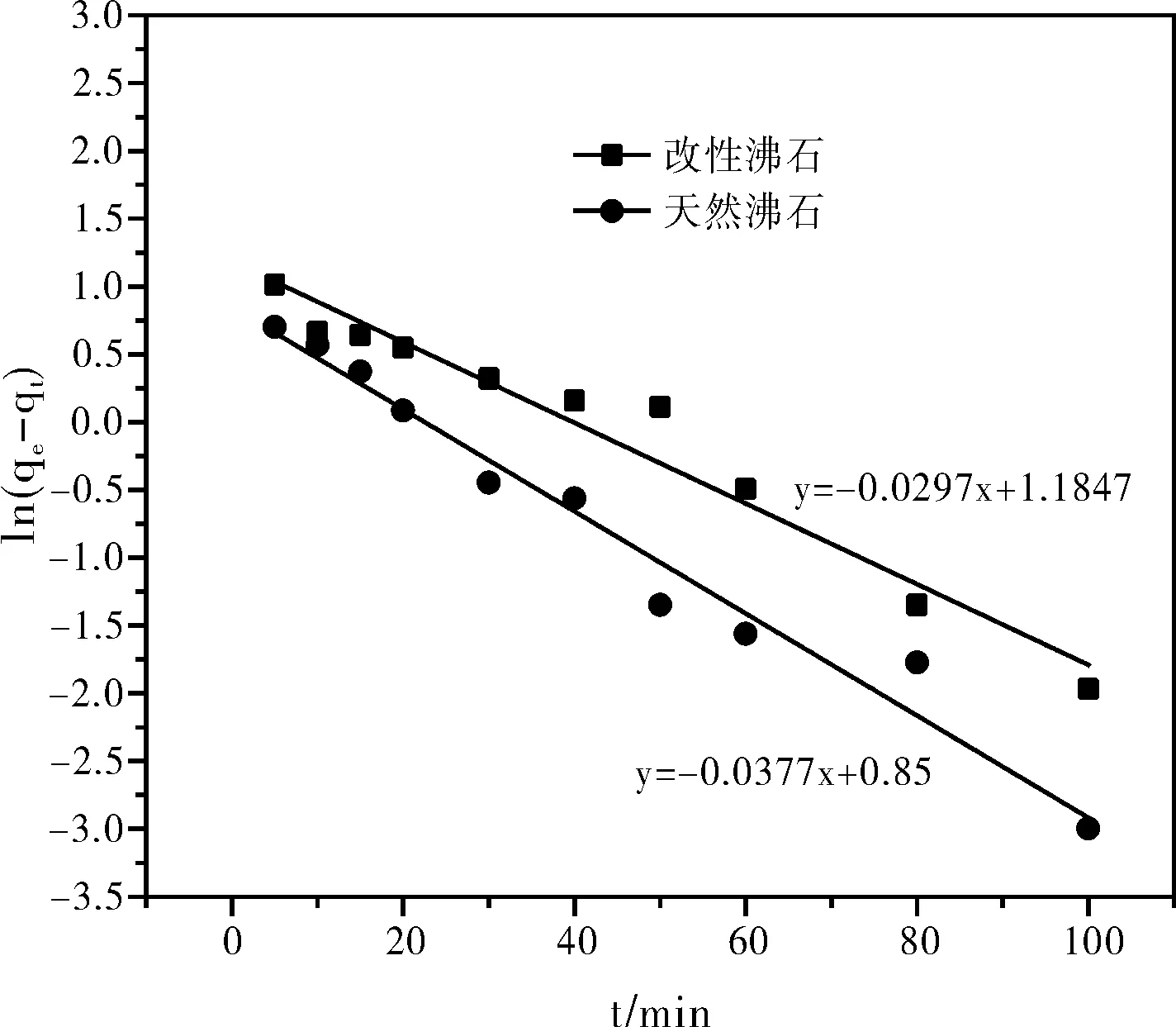
图3 准一级动力学拟合曲线
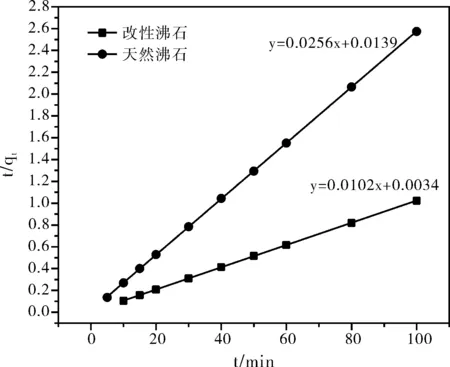
图4 准二级动力学拟合曲线
天然沸石和改性沸石的准二级吸附速率常数k2和理论平衡吸附量qe,cal,如表3所示。
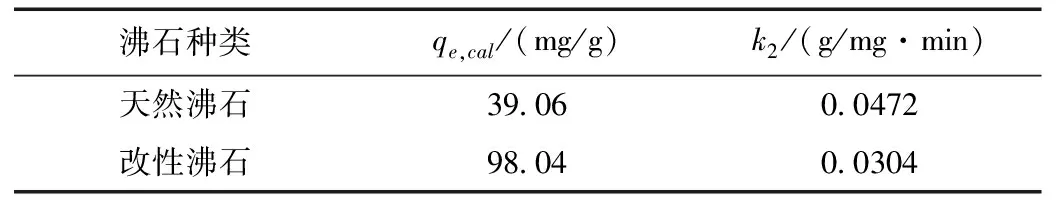
表3 天然沸石和改性沸石的准二级吸附速率常数K2和理论平衡吸附量qe,cal
为了进一步探究沸石的吸附性能与其表面结构的关系,采用扫描电子显微镜对样品的表面形貌进行了分析。改性前和改性后沸石的表面形貌如图5和图6所示。

图5 沸石改性前的扫描电镜形貌

图6 沸石改性后的扫描电镜形貌
由图5可知,天然沸石表面明显可见片状区和粒状区,两者区分度较大,且片状区表面相对光滑平整。由图6可知,经NaCl改性后沸石表面形貌发生变化,裂纹形状改变,数量明显增多,表面粗糙度增大,这或许是其表现出更加优良吸附性能的可能原因之一[14]。同时该扫描电镜图向学生真实地呈现了氯化钠改性前后沸石分子筛材料表面的缺陷情况(凹凸的形貌),更加形象的还原出了沸石分子筛材料真实的形貌,同时有助于提高学生对沸石分子的直观认识。
天然沸石和改性沸石的理论平衡吸附量和实际平衡吸附量非常接近,说明利用准二级吸附动力学过程来描述沸石吸附过程的可靠性。同时根据图3和图4绘制的吸附曲线以及理论计算的结果可以发现:从吸附速率常数来看,改性后的沸石吸附速率常数(k2=0.0304 g/(mg·min))略低于天然沸石的吸附速率常数(k2=0.0472 g/(mg·min)),说明了沸石改性后的吸附量维持在相对较高的水平,但是随时间的增长,其吸附量的增加速率并没有出现显著升高;但是改性沸石的平衡吸附量(qe,cal=98.04 mg/g)大于天然沸石的平衡吸附量(qe,cal=39.06 mg/g),改性后沸石平衡吸附量的增加与其表面形貌的变化密切相关,结合扫描电镜测试结果,进一步说明经NaCl活化改性后沸石的吸附能力较天然沸石的吸附能力显著增加。
设计的教学实验根据沸石改性前后的吸附量随时间的动态变化结果,说明了吸附量与时间的关系更符合准二级动力学方程(式8):
据此确定沸石的吸附行为符合准二级的动力学特征。
5 实验要求及学时安排
5.1 预习要求
为使学生对实验教学有初步的了解及准备,要求在实验开展前,学生自主进行以下项目的预习:
(1)复习“化学动力学基础”、“固体表面吸附”等物理化学相关内容。(2)查阅相关文献及书籍,认识沸石改性常用方法及相关应用。(3)了解材料表面结构及特性的表征方法。
5.2 学时安排及开设对象
作为一门应用性较强的综合实验,可面向环境、化学、化工等相关专业的本科三年级学生开设,开设学时为16学时,具体安排如下:
(1)1~4学时:分组查阅文献,确定实验方案;
(2)5~8学时:进行天然沸石改性和吸附性能实验;
(3)9~12学时:沸石表面形貌及特性表征;
(4)13~16学时:数据处理,撰写研究报告,并制作PPT分组讨论交流。
6 结 语
沸石改性后洗涤过程中要避免剧烈振荡,否则沸石易分解为渣屑状,影响其吸附效果。本教学实验设计按照最大吸收波长的测定-标准曲线的绘制-吸附量的确定为总体思路,采用NaCl对沸石进行活化改性,研究其吸附性能与其表面结构的关系;并对动力学模型进行了验证。通过本教学实验的开展,引导学生复习并掌握吸附准一级反应、准二级反应动力学方程以及固体物质吸附性能与其结构联系的相关知识,并熟悉材料表面形貌及特性表征如扫描电镜的基本原理及方法,从而培养创新型、复合型人才[15]。

