结肠癌组织中的KLF8表达及下调KLF8对肠癌细胞的影响
严清青 王 龙 黄耀星 余丹纯 刘 静
1 广州市第一人民医院消化内科(广州 510180)2 广州市第一人民医院介入放射科(广州 510180)
结直肠癌(colorectal cancer,CRC)是目前最常见的消化道恶性肿瘤之一,在全球范围内具有较高的发病率和死亡率,每年全球有120万新发病例,虽然结肠癌的治疗手段逐渐多样化,但其预后不容乐观。尽管我国的结直肠癌发病率较发达国家略低,但是近年来随着人们饮食习惯改变、高强度的工作、精神紧张及空气环境污染等多种因素的作用,结直肠癌发病率逐年上升[1]。一项回顾性队列研究表明年龄低于50岁的结直肠癌患病率明显升高[2]。目前判断结肠癌患者预后主要依据为TNM分期和Dukes分期,然而由于肿瘤患者的异质性,同一患者的预后仍有差异,因此积极探索结直肠癌肿瘤细胞增殖、侵袭及转移机制的相关因子,有利于提高结直肠癌的早期诊断,为提高结直肠癌术后5年生存率,具有重要意义。
KLFs(Kruppel-like factor)是一类参与调节细胞增殖、分化、侵袭、转移等生物学调控过程的转录因子家族,包含KLF1-KLF17等17个家族成员。研究表明KLF8可以抑制或激活目标基因的双向转录调节因子,其主要参与肿瘤细胞侵袭转移、干细胞特征及肿瘤细胞的耐药性[3- 7]。本研究中通过沉默KLF8的表达,研究其在结肠癌组织细胞中的表达及其对结肠癌细胞侵袭、转移及上皮-间质化的影响,希望能为结肠癌的早期诊断及靶向治疗提供理论基础。
1 材料与方法
1.1 材料
结肠癌Lovo细胞株由本院消化内科实验室提供,RMPI 1640培养基为美国Gibco公司,KLF8抗体购于美国AVIVA SYSTEM BIOLOGY公司,E-cadherin、Vimentin、N-cadherin、GAPDH购于美国CST公司, 辣根过氧化物酶标记山羊抗鼠IgG为加拿大Dako公司,siRNA片段由吉玛公司合成,转染试剂为Invitrogen公司,Transwell培养板为Corning公司,Matrigel为美国BD公司,DAB染色试剂盒为美国Sigma公司,免疫印迹电泳仪为美国Bio-Rad公司,预染蛋白Marker为广州威佳科技有限公司。
1.2 组织标本
选择2018年1月—2018年9月期间在本院接受结直肠癌手术的20例患者,此课题经得医院伦理委员会讨论通过,术前经得患者及家属同意,病理医师证实为大肠癌,术中收集结肠癌组织和癌旁正常肠组织,将取下的组织标本分为两部分,一部分迅速置于冷冻液氮中,然后储存于- 70℃冰箱用于蛋白免疫印迹检测;另一部分置于甲醛溶液固定、包埋、切片,进行免疫组织化学染色。
1.3 细胞系
取出保存于液氮罐中的人结直肠癌细胞Lovo,用含有10%FBS及1%青链霉素的RMPI-1640完全培养液于5%CO2、37℃、湿度充分条件下常规培养。
1.4 免疫组织化学染色法
应用免疫组织化学染色二步法,取结肠癌和癌旁正常组织切片脱蜡水化后修复抗原,再进行免疫组织化学SP法进行染色。应用3%过氧化氢室温封闭30 min,滴加一抗1:100多克隆抗体(KLF8兔抗或IgG鼠抗),4℃ 过夜,PBS冲洗,室温孵育二抗30 min,PBS漂洗后DAB染色,冲洗后HE染色。切片在双盲情况下由病理科医师观察并最终进行结果分析,在200倍视野中计数肿瘤细胞,根据细胞染色强度和阳性百分比之积进行判定,细胞染色强度为:0分为无染色,1分为浅黄色,2分为棕黄色,3分为黄褐色。其乘积≤50%为弱阳性(+-),50%~100%为中等阳性(++),100%~300%为强阳性(+++)。
1.5 Western 检测结肠癌组织中klf8的表达
取冻存冰箱中的结肠癌组织和癌旁正常组织,加入组织裂解液,置于冰山裂解30 min,4℃,12 000 rpm离心15 min,吸取蛋白上清液,检测提取的蛋白浓度,煮沸蛋白样品与上样缓冲液10 min,加入聚丙烯酰胺凝胶电泳上样孔中,每孔中加入30 μL变性蛋白样品,初始电压为80 V,30 mim,待溴酚蓝进入分离胶和浓缩胶交界处时,调整电压为120 V直到溴酚蓝进入浓缩胶底部,结束电泳,取出蛋白凝胶转印至纤维素膜上,经脱脂奶粉孵育封闭1 h后,分别孵育一抗(KLF8,4℃过夜),二抗(室温,1 h),转移至暗室显影。
1.6 细胞转染
将处于对数生长期的结肠癌Lovo细胞株胰酶消化后完全培养基重悬成细胞悬液,用细胞计数板计数,种1×105/孔的细胞于24孔板中,常规培养,待细胞融合度达30%~40%时开始转染。分别将KLF8的siRNA和阴性对照的siRNA转染进入Lovo细胞株,持续作用24 h后测定细胞中的KLF8的蛋白含量。
1.7 Western 检测细胞中相关蛋白的表达
将转染KLF8-siRNA、control-siRNA后的细胞培养24 h后,提取细胞总蛋白,采用western blotting法检测细胞中E-cadherin、Vimentin、N-cadherin及内参GAPDH的表达。
1.8 划痕实验
提前将转染KLF8-siRNA和control-siRNA后24 h的细胞按4×105/孔浓度种于6孔板中,常规培养,待细胞融合度达100%时,用10 μL的移液器划痕,再用预温的PBS洗2~3次,洗去悬浮的细胞,拍照后常规培养,待24 h时再洗拍照。
1.9 细胞侵袭实验
将预冷的Matrigel Matrix放置于4℃冰浴过夜融化,将融化的Matrigel与预冷的无血清RPMI培养液按1:7的比例配置transwell chamber上室凝胶液,以每孔50 μL包被transwell上室,37℃放置2 h。胰酶消化提前24 h转染KLF8-siRNA和control-siRNA后的细胞,并用含0.1%血清的RPMI培养基稀释细胞,计数成4×105个细胞/100 μL细胞悬液,加入transwell上室,下室加入20%血清,置于培养箱培养24 h,取出transwell小室,漂洗,结晶紫染色,镜下观察、计数并拍照。
1.10 统计学处理
应用SPSS 19.0统计软件将检测数据录入电脑,而后采用两组间计量资料的差异进行分析采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 结肠癌组织中KLF8的表达
Western blotting及免疫组织化学染色法检测KLF8在结肠癌手术切除标本中的表达。Western blotting证实结肠癌组织中KLF8的表达条带强于癌旁正常组织。经过免疫组织化学染色(DAB染色法)后,KLF8阳性的染色颗粒呈棕褐色,癌旁正常结肠组织未见明显的棕褐色颗粒及阳性细胞,二者评分比较差异有统计学意义(P=0.008,t=5.867),提示KLF8高表达与结肠癌发生发展相关。见图1。
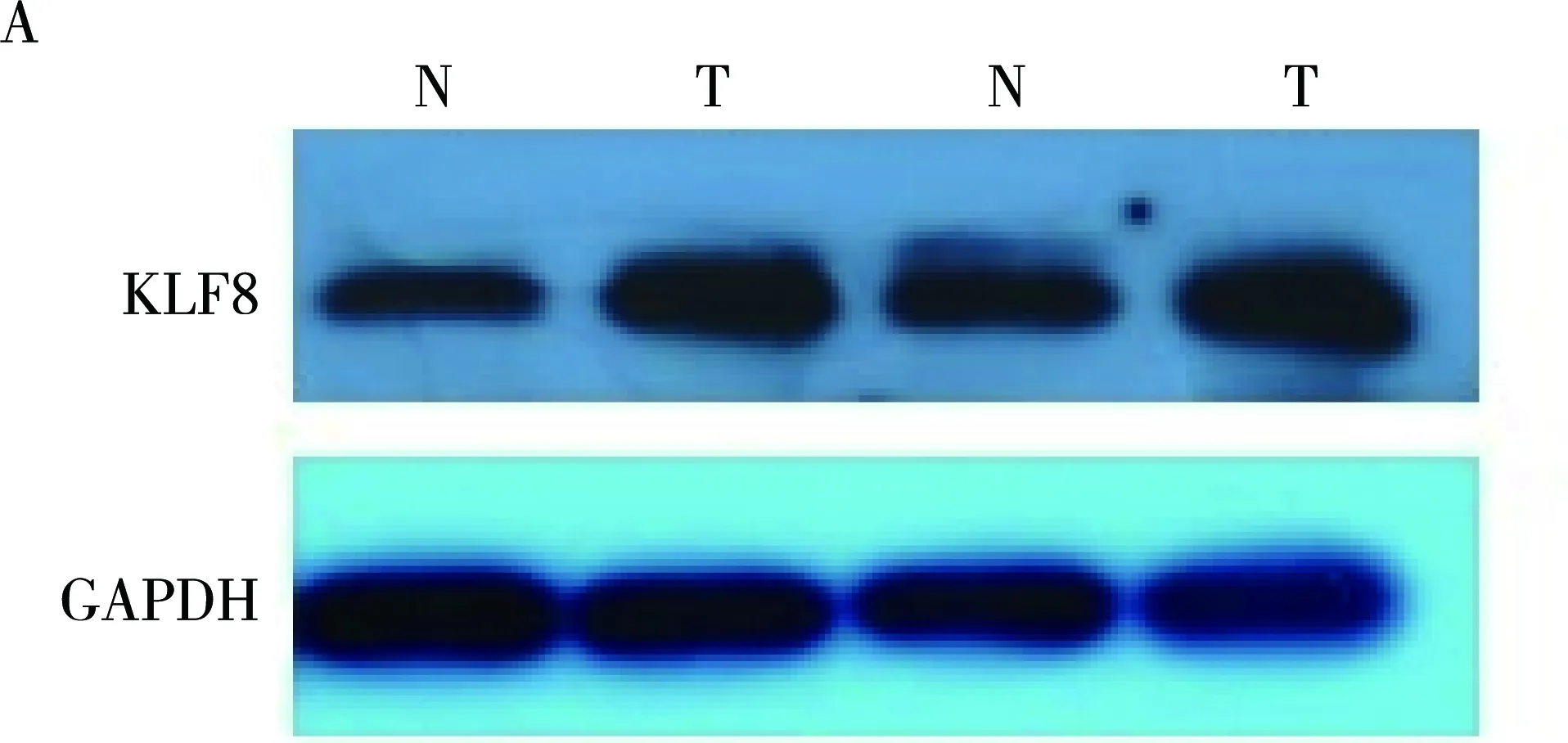
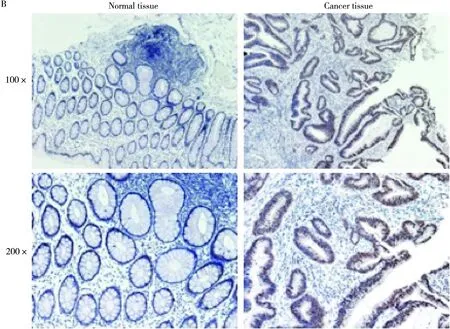
图1 KLF8在结肠癌及癌旁组织中的表达(SP,100×200×)A: western验证KLF8在肿瘤组织中的表达水平;B: IHC证实KLF8在肿瘤组织中的表达(P=0.008,t=5.867)
2.2 转染KLF8 siRNA下调结肠癌细胞中KLF8的表达
分别将KLF siRNA和阴性对照的siRNA转染进入结肠癌Lovo细胞株,常规培养24 h后提取细胞蛋白,western blotting 证实KLF8 siRNA可降低结肠癌细胞中KLF8蛋白表达水平,差异有统计学意义(P=0.001,t=4.907),同时western blotting检测结果也表明KLF8 siRNA可用于后续实验。见图2。
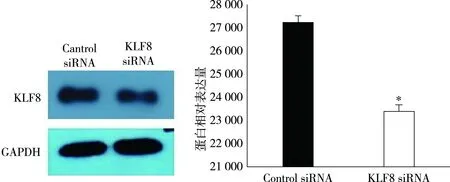
图2 转染后肠癌细胞中KLF8的蛋白表达注:图A:western blot检测效果图;图B:蛋白相对表达量,与control组比较,P<0.05
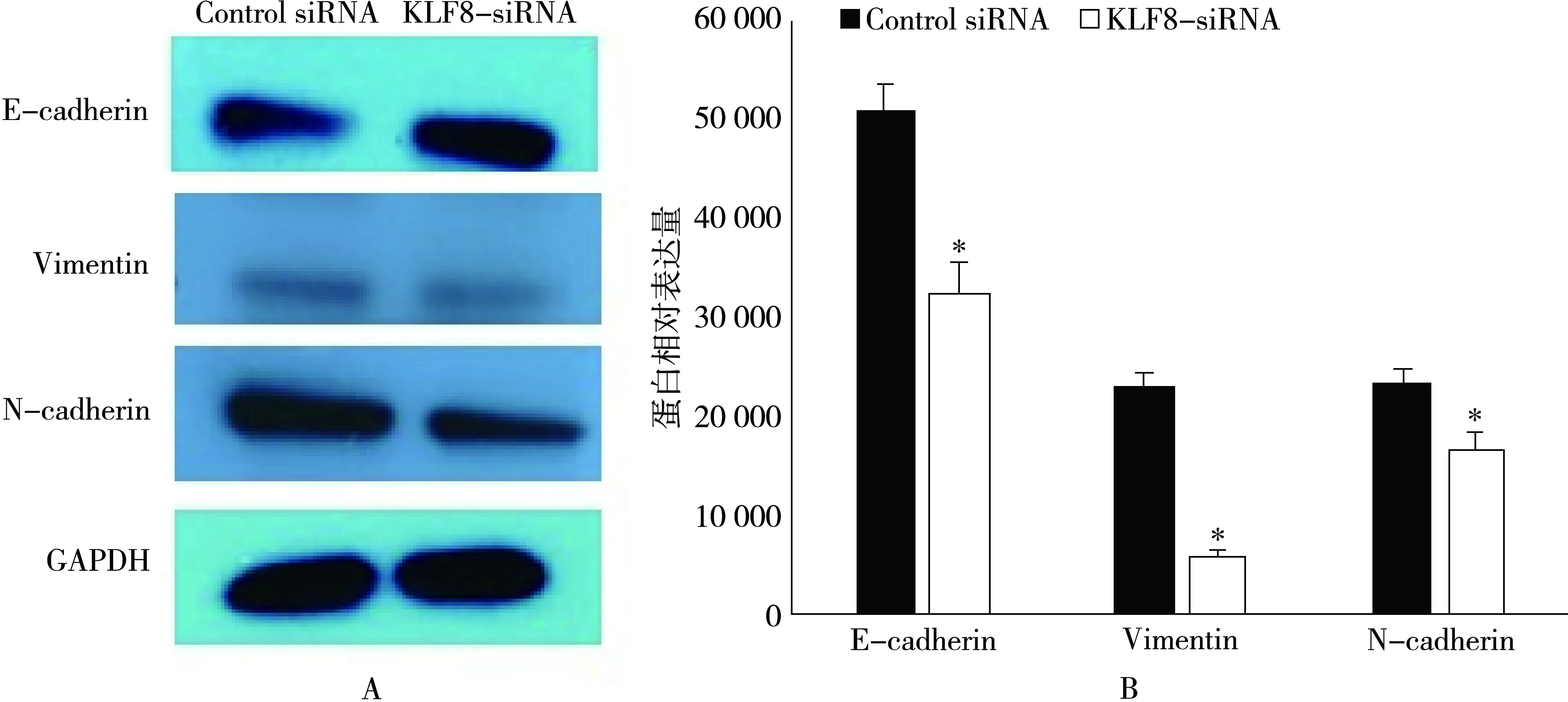
图3 KLF8对结肠癌细胞EMT的影响注:图A:western blot检测;图B:蛋白相对表达量,与control组比较,P<0.05
2.3 KLF8干扰对结肠癌细胞EMT的影响
转染KLF8 siRNA及阴性对照siRNA后培养 48 h,提取细胞蛋白,western验证e-cadherin、vimentin、N-cadherin的表达,沉默KLF8后e-cadherin的表达升高(P=0.015,t=8.19),然而 vimentin 的表达下降(P=0.009,t=3.62),N-cadherin 的表达下降(P=0.031,t=6.39),差异有统计学意义,表明KLF8参与调节EMT。见图3。
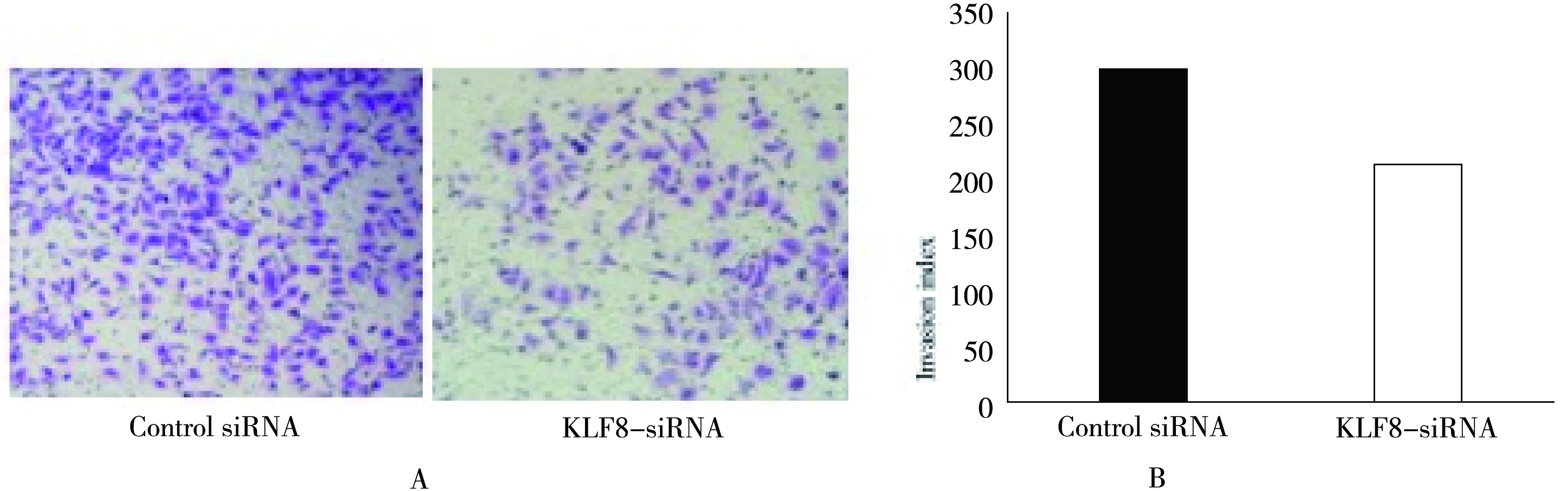
图4 转染KLF8 siRNA对肠癌细胞侵袭能力的影响(结晶紫染色法,200×)注:图A:transwell;图B:transwell细胞滤过数,与control组比较,P<0.05
2.4 下调KLF8对肠癌细胞侵袭的影响
显微镜下观察转染KLF8 siRNA对肠癌细胞侵袭转移能力的影响,KLF8 siRNA干扰组穿膜细胞数低于阴性对照组,差异有统计学意义(P=0.009,t=9.13),提示KLF8可抑制结肠癌细胞的体外侵袭能力。见图4。
2.5 KLF8 siRNA对结肠癌细胞迁移能力的影响
对比转染了KLF8 siRNA和阴性对照siRNA的细胞划痕宽度,发现KLF8 siRNA组较对照组增宽,差异有统计学意义,表明KLF8低表达能抑制结肠癌细胞的迁移能力。见图5。
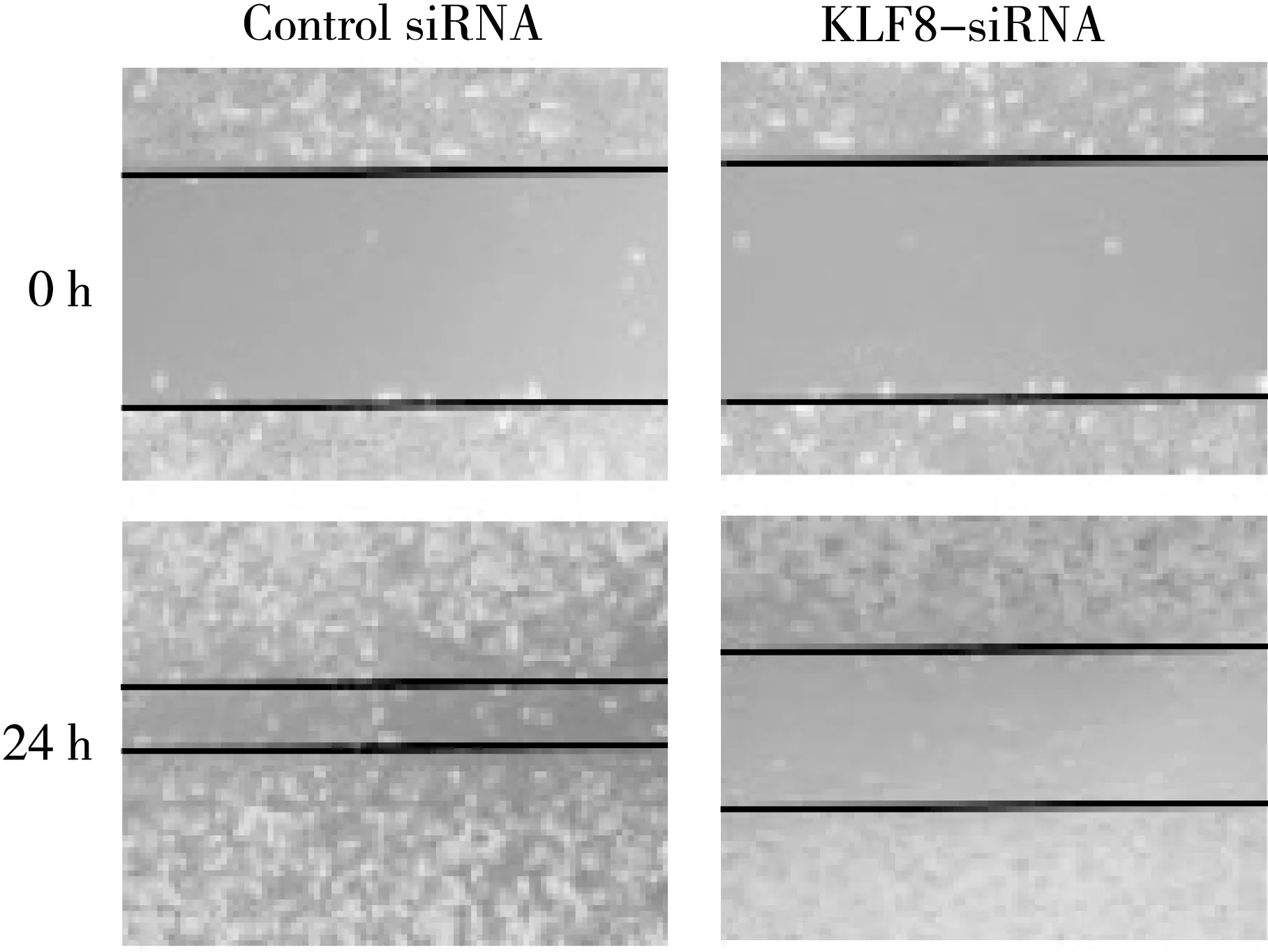
图5 转染kLF8 siRNA对肠癌细胞转移能力的影响
3 讨 论
结直肠癌是全球范围内男性和女性死亡原因中的第三大肿瘤疾病[8]。研究发现,结直肠癌的发生与家族遗传、不良的饮食结构和生活习惯均具有密切关系[9]。恶性肿瘤的两大特征在于无限增殖和侵袭转移,肿瘤的转移扩散是导致患者死亡的主要原因之一[10]。结肠癌细胞生长比较活跃,其主要以肝转移为主,其次为淋巴结转移,远处易侵犯肺、脑、骨[11]。此外,在结直肠癌发生发展过程中伴随着复杂的分子生物学的变化,然而截止目前尚缺乏结直肠癌早期诊断及预后判断的特定肿瘤标志物[12]。因此探索结直肠癌发生发展过程中的分子改变及机制,对结直肠癌的临床诊断及治疗具有重要意义。
Kruppel样锌指转录因子是Sp/KLFs样因子家族中的一个亚家族,KLFs是一类结合DNA的锌指转录因子,存在于包括人在内的大量哺乳动物的组织和细胞中[13]。人类基因组包含17个KLF编码基因,根据功能差异可分为三组:第一组为转录抑制因子,KLF3、- 8和-12;第2组为转录激活因子,KLF1、- 2、- 4、- 5、- 6和- 7;第3组的KLF能结合并增强共抑制蛋白活性,KLF9、-10、-11、-13、-14和-16,而KLF15和KLF17因功能尚未明确,暂未被归类[14]。KLF8作为KLFs家族的成员,通过其羧基端存在的三个C2 H2锌指样结构结合细胞核内的DNA,并通过氨基端含有的特定PVALS/T序列与辅助抑制因子C末端结合蛋白相互结合,调控在启动子区域内的基因表达,另外KLF8还可调控在细胞内核转运的核定位信号的结构[15]。KLF8的结构特征决定其在调控细胞周期、转化、上皮向间质转化以及侵袭的重要作用。近年来,研究现实 KLF8在多种恶性肿瘤中呈现过度表达,如:胃癌[16]、肝癌[17]、膀胱癌[18]、胰腺癌[19]等,并且KLF8参与细胞周期调控、EMT、细胞的迁移和侵袭。
上皮-间质转化(EMT)是上皮细胞受内源或外源性因素刺激后向间充质细胞转化的过程,其主要表现为上皮标记基因的表达减少、间质标记基因的表达增多,从而造成肿瘤细胞间黏附性降低,细胞获得较强的迁移能力和运动能力,同时伴有细胞形态的改变及抗凋亡能力的增加[20]。E-cadherin是EMT的一个重要上皮标志,近年来研究表明E-cadherin在肿瘤组织中的表达均低于正常组织,其表达强度随着肿瘤分化程度下降而下降。Vimentin、N-cadherin是EMT的间质标志性蛋白,其在癌组织细胞内的表达异常增加。
在本研究中,为了明确KLF8与结肠癌的关系,我们首先通过免疫组织化学染色法阐述结肠癌组织标本中KLF8的蛋白表达高于癌旁正常组织,并采用western blotting证实结肠癌组织标本中KLF8的表达高于癌旁正常组织,本结果提示KLF8的高表达可能与结肠癌的发生发展密切相关。为进一步阐述KLF8参与结肠癌的发生发展,我们以结肠癌细胞Lovo为研究对象,转染siRNA下调KLF8的表达,观察肠癌细胞的生物学效应。
首先我们对转染KLF8的siRNA结肠癌细胞进行western分析,发现转染KLF8 siRNA后的Lovo细胞中KLF8的表达量低于对照组,即KLF8 siRNA可抑制结肠癌细胞中KLF8的表达。随后我们通过transwell及划痕实验发现KLF8 siRNA干扰后的结肠癌细胞的迁移侵袭能力下降,而且KLF8 siRNA干预后,结肠癌细胞中间质标志蛋白水平增加,而其上皮标志蛋白的表达水平下降,进而表明KLF8参与结肠癌细胞EMT的发生。
综上所述,结肠癌组织中KLF8的表达量高于癌旁正常组织,且下调结肠癌细胞中KLF8的表达可抑制结肠癌细胞侵袭、迁移和上皮-间质转化过程。

