嗜水气单胞菌非核糖体肽合成酶基因功能研究
张丽珊 孙莉娜 林镇平 林向民
(福建农林大学生命科学学院 福建省农业生态过程与安全监控重点实验室,福州 350002)
随着全球人口的增加,水产养殖正成为人类饮食中鱼蛋白的主要来源。然而,伴随着水产养殖业的发展,鱼类的各种传染性疾病也日益严重[1-2]。常见的水产致病菌有嗜水气单胞菌、副溶血性弧菌、溶藻弧菌等,可引起出血性败血症[3]。这些疾病的爆发与传播给水产养殖业造成的损失也越来越严重。为了防治水产养殖业的感染性疾病,大量的抗生素(庆大霉素、利福平、四环素等)被投入使用,而抗生素滥用使得细菌的耐药性日益严峻,耐药菌株层出不断,同时也伴随着环境中药物残留污染的现象越发严重[4-5]。因此,探究其致病机制被认为是控制水生病原体感染最有效的途径之一。
嗜水气单胞菌(Aeromonas hydrophila)作为水体中一种常见的致病菌,能产生肠细胞毒素、溶血素、蛋白酶和血凝素等毒力因子,引发鱼类患出血性败血症[6]。在体内,铁通常由于其特殊的物理化学性质而被氧化成不溶形式,并与细胞内的血红素、铁蛋白、血红蛋白和转铁蛋白结合,因此细菌不易获得[7]。为了应对这种铁缺乏症,微生物已经进化出一系列复杂的机制来与宿主竞争,例如铁载体的分泌,以从转铁蛋白、血红蛋白和铁蛋白中捕获铁并维持铁动态平衡以促进细菌生长、增殖和毒素分泌[8]。非核糖体肽是一类次级代谢产物,通常在细菌和真菌等微生物中产生。与在核糖体上合成的多肽不同,非核糖体肽合成酶(Non-ribosomal peptide synthetase,NRPS)由相互独立的多个模块组成,模块具有的特异结构域及酶活,催化相邻两模块上供体多肽和受体氨基酸的肽键形成[9-10]。作为次生代谢产物,NRP 可以产生比核糖体更广泛的多肽。它们在结构上是一个非常多样化的天然产物家族,具有极其广泛的生物活性和药理学特性,可被用作激素、抗生素、铁载体、抗真菌、抗癌等丰富多样的生物活性[11]。微生物铁载体在人类,动物和植物的可持续性方面的应用范围很广。基于非核糖体肽作为铁载体时在各个方面的有益应用,如细菌利用合成的铁载体攫取外界游离Fe3+来维持正常的生理活动。在嗜水气单胞菌ATCC7966 基因组中AHA_2473-AHA_2479是一个反映铁载体的生物合成和调节的基因簇,在这个基因簇中AHA_2474、AHA_2476是两个编码非核糖体肽合成酶的基因,目前对于这两个基因功能的研究比较少。本研究通过同源重组方法构建嗜水气单胞菌AHA_2474(nonribosomal peptide synthetase)、AHA_2476(nonribosomal peptide synthetase)基因缺失菌株(ΔAHA_2474、ΔAHA_2476),利用Chrome azurol sulfonate(CAS)检测法对缺失菌产铁情况进行测定,并利用M9 限制性培养基观察及补充铁的条件下野生菌和缺失菌的生长情况,最后通过DIP 条件下测生长曲线及测定溶血性、胞外蛋白酶活性、过氧化氢耐受性比较AHA_2474、AHA_2476基因的缺失对细菌生长的影响,分析AHA_2474、AHA_2476的功能与调节机制,为更好地认识细菌生理功能调控机制提供理论基础[6,12]。
1 材料与方法
1.1 材料
本研究使用的嗜水气单胞菌ATCC7966、大肠杆菌(MC1061、S17)及质粒(pRE112)均保存在本实验室中,除嗜水气单胞菌培养在30℃,其余都培养在37℃的LB 培养基中;LB 培养基成分:胰蛋白酶胨、酵母粉、氯化钠均购于生工生物工程(上海)股份有限公司;限制性内切酶购于TaKaRa 公司,连接酶购于诺唯赞生物公司,Taq 酶购于翊圣生物科技有限公司,无菌脱纤维绵羊血、脱脂牛奶购买于北京索莱宝科技有限公司
1.2 方法
1.2.1 构建缺失菌株 利用与自杀载体pRE112 同源重组原理,以嗜水气单胞菌ATCC7966 的基因组DNA 为模板构建两侧为AHA_2474、AHA_2476基因上、下游同源序列片段的基因敲除质粒,将构建好的质粒转入大肠杆菌MC1061 感受态细胞,经菌液PCR 验证正确后提取质粒再转入大肠杆菌S17感受态细胞,再经菌液PCR 验证正确后利用接合法与野生株(wild type,WT)同源重组,通过100 μg/mL 氨苄青霉素、30 μg/mL 氯霉素抗性筛选,获得第一次同源重组菌株之后在含有20%蔗糖的LB培养基中进行第二次同源重组,经氯霉素抗性平板筛选、菌液PCR 和DNA 测序确认嗜水气单胞菌AHA_2474、AHA_2476基因缺失突变株。最后通过稳定遗传20 代后,测序正确后保菌在-80℃冰箱中。
1.2.2 菌株培养 表型验证的菌株均从LB 平板上分别挑取野生株、ΔAHA_2474和ΔAHA_2476单一菌落接种于5 mL LB 培养基中,30℃,200 r/min 过夜培养16h至稳定状态。取过夜菌按1∶100 比例转接至5 mL 新鲜 LB 中,30℃,200 r/min,摇至OD=1.0后使用。
1.2.3 溶血性和胞外蛋白酶活性 将OD=1.0 的野生株、ΔAHA_2474和ΔAHA_2476各取5 μL 接种于已打孔的绵羊血平板(绵羊血含7%)和脱脂牛奶平板(脱脂牛奶含1%)上,置于30℃培养箱培养12-18 h,观察溶血圈和水解圈的大小,测量圈的大小以及拍照保存,实验均重复3 次。
1.2.4 ΔAHA_2474、ΔAHA_2476突变株在DIP条件下生长曲线的测定 将OD=1.0 的野生株、ΔAHA_2474和ΔAHA_2476按1∶100加入1 mL LB培养基中并加入终浓度为200 μmol/L 铁离子螯合剂2,2'-联吡啶(DIP),最后以每孔300 μL 加入微孔板中,对照组、实验组均做3 个生物学重复,放入30℃、波长600 nm 全自动生长曲线分析仪中,测定16 h,每小时测定一次吸光值。
1.2.5 CAS 检测液测定 配制CAS 检测液:(1)配制CAS 染色液,溶液A:将0.079g的铬天青(CAS,上海试剂公司)溶于50 mL 去离子水中,再加入10 mL 1mmol/L 的FeCl3溶液(含有10 mmol/L 的HCl);溶液B:将0.069g的十六烷基三甲基溴化铵(HDTMA)溶于40 mL 的去离子水中;溶液C:将A 溶液沿着烧杯的壁缓缓加入到B 溶液中,轻轻晃动,使溶液AB 混匀,得到溶液C:CAS 染色液,121℃灭菌15 min。(2)配制0.1 mol/L 磷酸盐缓冲液(pH6.8),121℃灭菌15 min,使用时稀释10 倍。(3)配制CAS 培养基:先配制好1 mmol/L 的CaCl2溶 液、1 mmol/L 的MgSO4·7H2O溶液、10%的酸水解酪蛋白溶液、20%蔗糖;再分别取0.1 mL 的CaCl2溶液、2 mL 的MgSO4·7H2O溶液、3 mL 的10%的酸水解酪蛋白溶液,20%蔗糖1 mL,去离子水定容到100 mL,115℃灭菌15 min。当以上的培养基灭完菌后,温度降低到60℃时,加入稀释好的0.1 mol/L 磷酸盐缓冲液5 mL 及8 mL CAS 染色液,每100 mL CAS 培养基的量沿着三角瓶壁加入,混合均匀后取5 mL 分装至已灭菌的试管中。将OD=1.0 的野生株、ΔAHA_2474和ΔAHA_2476菌株按1∶100 转接至分装好CAS 试管中,30℃,200 r/min 摇床中培养16h后观察生长状况并拍照保存。
1.2.6 M9 限制性培养基测定 配制M9 限制性培养基:5×M9 盐溶液(Na2HPO4·7H2O 0.678 g,KH2PO40.3 g,NaCl 0.05 g,NH4Cl 0.1 g)20 mL、20%葡萄糖2 mL、1 mol/L MgSO4200 μL、1 mol/L CaCl210 μL,加入蒸馏水补足100 mL,并且每100 mL 加入1.8g琼脂粉,121℃,灭菌15 min 后,倒在培养皿中。分别制备LB 平板,M9 平板及加有终浓度为50 μg/mL FeCl3的M9 平板,将OD=1.0 的野生株、ΔAHA_2474、ΔAHA_2476分别取2 μL 划在平板中,置于30℃恒温培养箱中培养16h后观察其生长状况并拍照保存,并重复3 次。
1.2.7 对过氧化物的耐受性测定 将OD=1.0 的野生株、ΔAHA_2474、ΔAHA_2476按1%的比例将菌体加入到1 mL 液体LB 中,实验组加入稀释5 倍的H2O2,使其作用浓度为2.5 mmol/L,对照组不作处理,室温应激10 min 后对样品进行梯度稀释(10-2-10-7),对每个稀释梯度的样品各取2 μL 点板接种于LB 琼脂平板上;30℃培养12-16h后观察结果并拍照保存实验记录,实验需重复3 次。
2 结果
2.1 非核糖体肽合成酶基因敲除
利用软件CE、Design.V1.03 及NCBI 数据库在目的基因上下游各500 bp 设计引物分别为P1P2、P3P4(表1),之后进行PCR 扩增,通过多片段连接酶无缝连接到pRE112 载体上再分别转入MC1061、S17 感受态中,再经同源重组和含20%蔗糖的LB 平板筛选及氯霉素抗性筛选,获得AHA_2474、AHA_2476敲除菌株,通过目的基因两端引物P5P6,P1 上游和P4 下游100 bp 左右设计引物P7P8 进行菌液PCR 验证,并以野生株为对照获得敲除菌ΔAHA_2474、ΔAHA_2476(图1)。
2.2 ΔAHA_2474、ΔAHA_2476对胞外蛋白酶活性与溶血性的影响
胞外蛋白酶和外毒素是嗜水气单胞菌产生的两大毒力因子,毒力因子的存在导致了嗜水气单胞菌的致病性,严重影响鱼类的健康生存甚至威胁到人类的身体健康,因此研究嗜水气单胞菌的毒力因子具有重要的意义。本研究通过脱脂牛奶平板和绵羊血平板检测胞外蛋白酶活性和溶血性,发现野生菌和ΔAHA_2474和ΔAHA_2476突变株在其菌落外围均能形成水解圈,即均具有胞外蛋白酶活性,但ΔAHA_2474突变株的水解圈略微大于野生菌的水解圈,ΔAHA_2476突变株的水解圈显著大于野生菌的水解圈(图2-A),表明AHA_2474和AHA_2476基因缺失后细菌胞外蛋白酶活性增强,说明AHA_2474和AHA_2476基因参与了蛋白酶的产生,使该菌毒性增强;而溶血性实验的结果表明野生株和AHA_2474、AHA_2476突变株在其菌落外围都能形成溶血圈,但ΔAHA_2474和ΔAHA_2476突变株的溶血圈明显大于野生菌的溶血圈(图2-B),表明AHA_2474和AHA_2476基因缺失后细菌溶血性的形成能力增强,说明AHA_2474和AHA_2476基因参与了溶血素的产生,使该菌毒性增强。

表1 基因敲除引物

图1 基因缺失突变株的构建
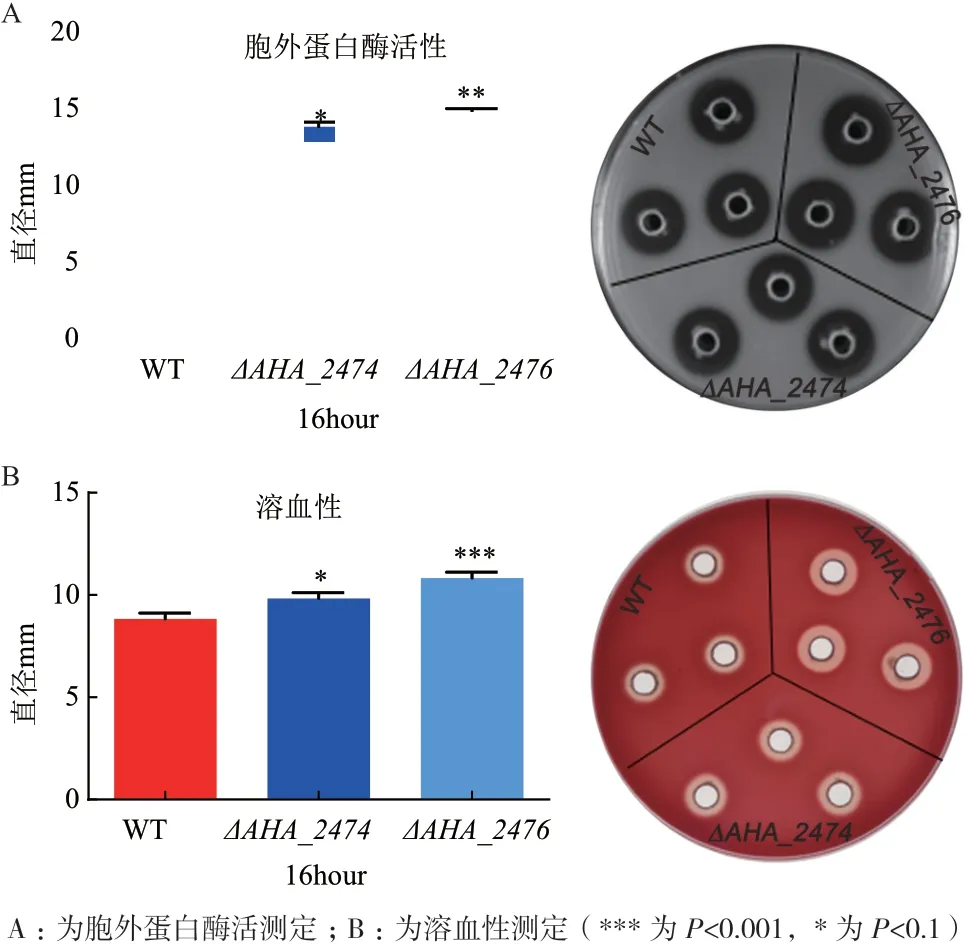
图2 野生菌与ΔAHA_2474、ΔAHA_2476 敲除菌在体外胞外蛋白酶和溶血性的比较
2.3 DIP对ΔAHA_2474、ΔAHA_2476生长情况的 影响
因ΔAHA_2474、ΔAHA_2476与铁离子相关,为了探索在铁离子限制条件下是否对缺失菌的生长产生影响,本研究比较了野生型菌株与ΔAHA_2474、ΔAHA_2476敲除菌株在缺铁条件下的生长能力。当加入铁离子螯合剂DIP 后,野生株生长显著高于ΔAHA_2474、ΔAHA_2476(图3),说明ΔAHA_2474、ΔAHA_2476可能通过影响铁离子的动态平衡来影响突变株的生长。
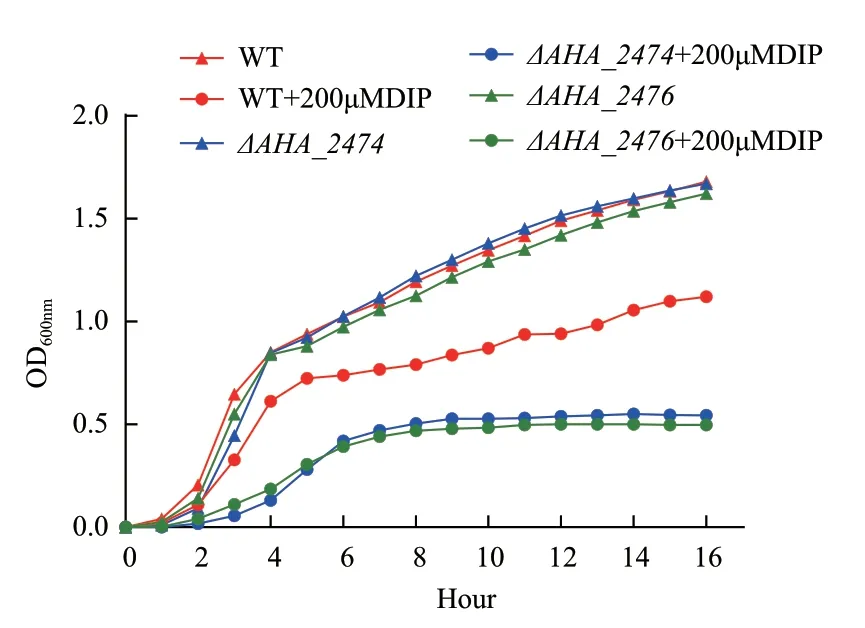
图3 DIP 条件下野生型菌株和DAHA_2474、DAHA_2476生长能力的比较
2.4 CAS培养基测定
细菌分泌的铁载体能鳌合CAS 染液中Fe3+而导致颜色由蓝变橙,从而测定微生物合成嗜铁素的能力。利用CAS 液体培养基观察细菌铁载体的产生,菌株在 CAS 液体培养基中的颜色的变化。与野生株相比,缺失菌ΔAHA_2474、ΔAHA_2476在检测培养基上的生长和颜色变化慢,培养12h就可见试管中野生型菌株出现明亮醒目的橙黄色液体(图4),而缺失菌ΔAHA_2474仅出现微弱的铁载体,使得试管中仅出现微弱的橙黄色,但ΔAHA_2476在同一时间是颜色还处于蓝色,说明缺失菌ΔAHA_2474、ΔAHA_2476影响铁载体的产生。

图4 CAS 培养基检测野生株和ΔAHA_2474、ΔAHA_2476铁载体产生情况
2.5 M9限制性培养基测定结果
M9 限制性培养基通过对铁离子的限定来测定。 通过补充50 μg/mL 的FeCl3测定野生株与ΔAHA_2474、 ΔAHA_2476突变菌株的生长情况,发现当在缺铁的M9 培养基下,缺失菌ΔAHA_2474、ΔAHA_2476的生长要比野生型弱,而在M9 培养基中补充终浓度为50 μg/mL FeCl3时发现野生株与缺失菌ΔAHA_2474、ΔAHA_2476的生长能力相当(图5)。
2.6 对过氧化物的耐受性测定
为了解ΔAHA_2474、ΔAHA_2476是否参与调节对氧化压力的应激过程,从而有助于嗜水气单胞菌适应外界环境的突变情况,本研究测定了ΔAHA_2474、ΔAHA_2476对过氧化物的应激能力。实验结果表明(图6),ΔAHA_2474突变株对H2O2(2.5 mmol/L)敏感;而ΔAHA_2476不敏感,与野生菌株相比,ΔAHA_2474菌株具有更大的耐受性,以上结果说明,AHA_2474基因可能参与嗜水气单胞菌的氧化应激生理过程。
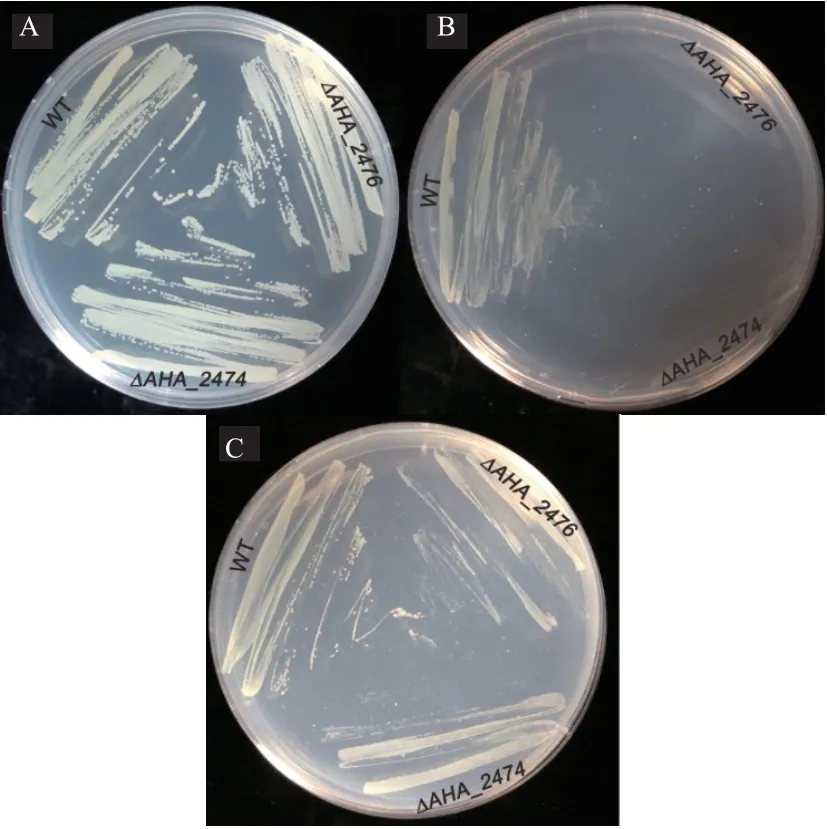
图5 测定铁离子限制条件下野生株和ΔAHA_2474、ΔAHA_2476 生长能力的比较
3 讨论

图6 在2.5 mmol/L H2O2 处理下,不同稀释倍数下野生株、ΔAHA_2474 和ΔAHA_2476 菌株耐受性测定
通常,细菌必须从宿主或复杂的自然环境中捕获有限的铁资源,以满足生物体对铁的正常需求。因此,细菌已经进化出多种获取铁的方法,包括通过特定受体和转运系统的铁载体介导铁的获取。铁载体是一种低分子量小于10 kD 的高亲和力铁离子特异性螯合剂,在铁饥饿时会被细菌分泌出胞外,以螯合剂的形式与宿主或者环境竞争可利用的铁离子,从而维持细菌的正常生长[13]。铁在病原体的代谢过程中起重要作用,例如病原体中的毒力,氧化应激耐受性等[14]。已有研究表明,铁载体在不同的细菌中的功能具有多样性,如有研究发现,当铁离子相关基因(tonB)缺失后,爱德华氏菌的产铁能力下降,毒力、溶血能力以及形成铁载体的能力都会产生显著变化[15-17];研究表明,大肠杆菌储铁蛋白Dps 可以通过铁氧化酶活性的变化对过氧化氢的耐受性产生影响,从而进一步影响细菌的存活[18-19]。嗜水气单胞菌的致病性与溶血素、胞外蛋白酶、粘附因子等多种毒力因子的分泌密切相关[20]。有研究表明,铁限制条件下能够诱导细菌的胞外蛋白酶活性[21]。因此,当敲除掉嗜水气单胞菌的非核糖体肽合成酶基因AHA_2474,AHA_2476基因后,可能影响非核糖体肽整个基因簇的功能,造成该菌对非核糖体肽的合成能力减弱,从而导致铁载体的量减少,使该菌处于低铁状态,进而诱导AHA_2474,AHA_2476敲除株的胞外蛋白酶活性增强。而非核糖体肽是细菌的次生代谢产物,可以以铁载体的形式与铁离子高亲和性螯合,参与病原菌的毒性、抗逆性等多种重要的生理功能。Qassim 等[22]研究发现,伯克霍尔德菌的非核糖体肽合成酶在铁载体的合成过程中起着非常重要的作用,当菌株在铁受限的条件下生长时,非核糖体肽合成酶的基因簇会指导合成铁载体,进而维持细菌对铁的正常需求。本研究发现敲除掉嗜水气单胞菌非核糖体肽合成酶的基因后,该菌的生理功能也有着显著变化,如胞外蛋白酶活性及溶血性均增强,产铁能力下降,对过氧化氢的耐受性增强,表明非核糖体肽在嗜水气单胞菌的生理功能中起着非常重要的作用。综上所述,本研究通过基因敲除的方法,获得敲除株ΔAHA_2474、ΔAHA_2476,对其基因功能进行研究,为探究该菌的致病机制及防治策略提供理论依据。
4 结论
本研究通过同源重组方法成功构建了嗜水气单胞菌ATCC7966 中AHA_2474与AHA_2476的突变株。通过比较缺失株与野生株之间的胞外蛋白酶活性,溶血性存在显著性的差异,表明这两个基因的缺失可能使该菌毒性增强。又发现AHA_2474、AHA_2476的缺失导致细菌在铁离子限制条件下,菌株的生长能力显著下降,而补充铁离子后又能恢复生长。一系列的生物学实验表明AHA_2474、AHA_2476基因的缺失可能是导致嗜水气单胞菌产铁能力下降的重要原因之一。

