硫辛酸衍生物的制备与活性研究进展
孙腾 徐刘佳 郑明明
(中国农业科学院油料作物研究所 油料脂质化学与营养湖北省重点实验室 油料油脂加工技术国家地方联合工程实验室 农业部油料作物 生物学与遗传育种重点实验室,武汉 430062)
α-硫辛酸(Lipoic acid,LA),一种具有生物活性的天然产物,属于B 族维生素。在动物肾脏和肝脏中含量较高[1]。α-硫辛酸为封闭的二硫五元环结构,电子云密度较大,使其具有很强的抗氧化性。此外,硫辛酸还具有抗糖化,强化肝,抗衰老等功能[2-4],具有较高的医用价值和保健功能[5-6]。硫辛酸具有光热不稳定性,常温下易分解,且在油、水中溶解度不高的特点[7],导致其生物利用度低,限制了其在食品等行业的应用。通过大量的研究发现,硫辛酸经过分子改造可以解决溶解性和生物利用率低的问题,且获得的硫辛酸衍生物有着比硫辛酸更强的生理活性,因此利用一些具有生物活性的化合物对硫辛酸进行结构修饰成为一种趋势(图1)[8]。
目前有关硫辛酸的综述,更多集中于α-硫辛酸自身的合成及应用[9-10],有关硫辛酸衍生物的合成及其活性方面的报道较少,基于以上原因,本文将对近几年国内外有关硫辛酸衍生物的生物和化学合成及其活性的研究进展进行综述,对拓展硫辛酸衍生物的应用领域提供理论指导。

图1 硫辛酸及其衍生物的化学结构[11-15]
1 硫辛酸衍生物的制备方法
1.1 生物转化法
生物转化是指利用生物有机体(组织、细胞、细胞器)或酶作为催化剂对外源性化合物进行结构修饰生成有价值产物的过程,也称为生物催化[16]。利用生物转化法对硫辛酸进行结构修饰合成具有多种功能特性的新化合物,可以避免有机合成中对保护基的使用,降低反应成本,提高产物的收率,现已成为开发硫辛酸衍生物的有效途径。研究者们利用生物酶法制备出了多种新型硫辛酸结构酯,通过结构改造可以解决由于硫辛酸化学结构导致的生物利用度低的问题。
1.1.1 米黑根毛霉脂肪酶 Lipozyme RMIM 为来源于米黑根毛霉脂肪酶固定化在阴离子交换树脂上的固定化脂肪酶。Kaki 等[11]以摩尔比为1∶30 的1,2-二油酰基-sn-丙三基-3-胆碱磷和硫辛酸作为底物,来自热霉菌(Lipozyme TLIM)、南极洲假丝酵母(CALB)和根茎霉(Lipozyme RMIM)的固定化脂肪酶为催化剂,含5%半胱氨酸的甲苯为溶剂,在受控的水活度下通过酯交换反应,进行新型化合物的合成。反应在热振荡器(650 r/min,25℃)上进行,用柱色谱对粗产物进行纯化,得到的白色固体,即为新化合物1-硫酰基-2-棕榈酰磷脂酰胆碱(LPPC)。在所有被测脂肪酶中,RMIM 表现出最好的催化选择性和催化活性。反应在酶浓度为75 mg/mL,水活度为0.11 的条件下反应96 h,实现97%的原料转化,
形成73%的目标产物(LPPC)和24%的次产物(lyso PC)。LPPC 是两种生物活性分子的智能组合,在营养保健品、化妆品和生物医学领域中具有潜在的 应用。
1.1.2 褶皱假丝酵母脂肪酶 Wang 等[12]以硫辛酸和植物甾醇为底物,固定化于大孔丙烯酸树脂的南极洲假丝酵母脂肪酶B,固定在二氧化硅颗粒上的米曲霉脂肪酶TLIM,固定化在阴离子交换树脂上的米黑根毛霉脂肪酶RMIM,褶皱假丝酵母脂肪酶CRL 为催化剂,2-甲基-2-丁醇/正己烷为反应溶剂,首次成功建立了植物甾醇硫辛酸酯的酶法制备方法。其中,CRL 具有较高的催化能力,在植物甾醇占比150 mmol/L,硫辛酸甾醇比2.5∶1,酶的添加量60 g/L 的条件下,96h达到最高转化率71.2%。通过质谱(MS),傅立叶变换红外(FTIR)和核磁共振(NMR)确定了最终产物豆甾醇硫辛酸酯的结构。
1.1.3 南极假丝酵母脂肪酶 Novozym 435 是来源南极假丝酵母B(Candida Antarctica B)的固定化脂肪酶。Hsieh 等[17]成功筛选出Nov435 作为合成海藻糖酯的最佳生物催化剂。在底物摩尔比1∶4(海藻糖∶硫辛酸),硫辛酸(0.03 mmol/d),反应温度40℃,总酶活性3 000 PLU(月桂酸丙酯单位)和共溶剂比4∶1(二甲基亚砜∶2-甲基-2-丁醇)的条件下反应4 d,海藻糖硫辛酸酯的转化率达到75.9±1.9%。分离纯化后,用核磁共振法确定了硫辛酸的羧基与海藻糖C6羟基的连接。生成的海藻糖硫辛酸酯具有比硫辛酸高2.5 倍的抗氧化活性,在未来治疗神经损伤疾病或营养应用方面,可能比硫辛酸具有更大的应用潜力;Kontham 等[18]以硫辛酸和不同的醇(十八醇、肉豆蔻醇、油醇、3,5,5-三甲基己醇、1,8-丙二醇、1,10-癸二醇)为底物,二氯甲烷为溶剂,Nov435(15%基于底物的总重量)为催化剂,加入半胱氨酸(0.5%)抑制硫辛酸的聚合。将反应混合物在25℃的氮气气氛下搅拌12 h。粗品经正己烷∶乙酸乙酯(90∶10,V/V)硅胶柱层析纯化得到相应的硫辛酸酯(收率范围90%-95%)。合成路线温和高效,收率高(表1)。
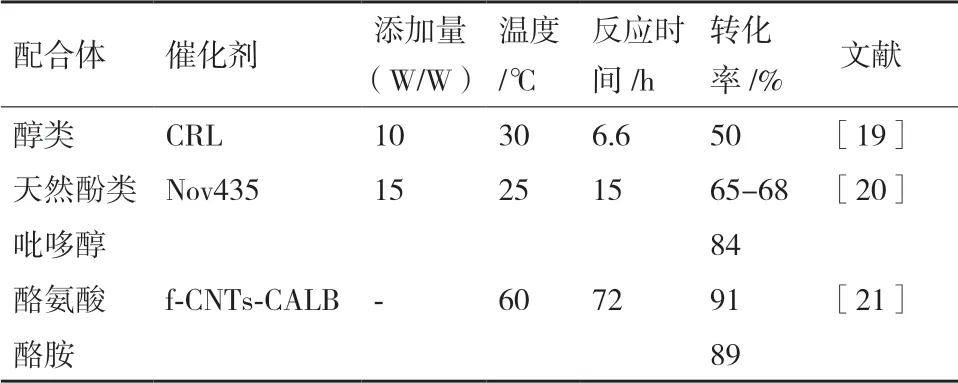
表1 酶法修饰的主要条件参数
1.2 化学合成法
1.2.1 4-二甲氨基吡啶(DMAP)催化酯化法 DM- AP(4-二甲氨基吡啶)结构上给电子的二甲氨基基团与作为母环的吡啶环之间产生共轭作用,能激活环上的氮原子进行亲核取代,从而显著地加速一些高位阻化学反应的进程[22],近几年广泛用作化学合成的新型催化剂。Madawala 等[23]以DMAP 为催化剂,EDCI 为缩合剂,在0℃下将摩尔比为1∶1 的甘油二酯和硫辛酸溶解在二氯甲烷中,室温下搅拌过夜。随后,将反应混合物萃取干燥并浓缩,得到粗产物,通过色谱法纯化,得到产率80%的1,3-二油酰基-2-硫辛酰基-sn-甘油和产率70%的1,3-二油酰基-2-二氢硫辛酰基-sn-甘油。RP-HPLC-MS-APCI 分析显示不同组分之间具有良好的分离;Madawala 等[24]又以DMAP 为催化剂,EDCI 为缩合剂,二氯甲烷为溶剂,在室温的条件下将摩尔比为1∶1.2 的植物甾醇和硫辛酸在氮气气氛下搅拌溶解,混合物与盐酸酸化后,用二氯甲烷萃取得到硫辛酸甾醇酯,采用薄层色谱法对产物进行进一步纯化,分别得到收率为60%的硫辛酸甾醇酯和80%的二氢硫辛酸酯;段良兴等[25]以α-硫辛酸和氨基丁苯酞为原料,EDCI和DMAP 为催化剂,在二氯甲烷介质中反应4-10 h,经无水硫酸镁干燥后得到了10 个硫辛酸类衍生物,收率均在77%以上。
1.2.2 二环己基碳二亚胺(DCC)催化缩合法 DCC在化学反应中常被用作偶联试剂。可以应用于酰胺和酯化反应中。DCC 加速酯化反应的机制是硫辛酸羧基结构上的氧原子进攻DCC 分子中间的碳原子,使DCC 结合在羧基上,进而形成一种活性酯结构,这使得醇或酚上羟基的亲核进攻变得较为容易进行。DCC 催化反应的成本低且产率高,但产生的副产物难以除去,限制了它的应用[26]。Melagraki 等[13]以香豆素和硫辛酸为底物,N-羟基苯并三唑(HOBt)和N,N 二环己基碳二亚胺(DCC)为缩合剂,进行官能化衍生物的构建。使用n-羟基琥珀酰亚胺和DCC 对外消旋的硫辛酸在二氯甲烷中进行活化,得到N-(脂氧基)-琥珀酰亚胺酯。将摩尔比为1∶1的香豆素-3-氨基碳酰亚胺和N-(脂氧基)-琥珀酰亚胺酯混合于二氯甲烷中,滴加二甲基甲酰胺促进反应物溶解。将混合物于避光条件下搅拌过夜。然后加入水、二氯甲烷萃取,将有机萃取物用硫酸钠进行干燥,在真空环境下浓缩,得到新型香豆素硫辛酸酯,其最高产率达到79%。Lahiani 等[14]以DCC 为脱水剂,二氯甲烷为溶剂,α-硫辛酸和4-羟基2,2,6,6-四甲基哌啶-1-氧基为底物,反应混合物在室温下搅拌48 h。采用真空过滤去除沉淀的副产物DCU,减压蒸发溶剂。将固体溶解在热乙醇中,在4℃下放置24 h。得到产率为73%的硫辛酸衍生物(表2)。

表2 化学法修饰的主要条件参数
2 生物活性
2.1 抗氧化活性
硫辛酸结构中的二硫五元环是活性区域,电荷密度大,可以螯合金属离子,二硫键较长且解离焓和电离势小,可以与自由基反应形成阳离子自由基,从而发挥抗氧化作用。硫辛酸进入细胞后,其二硫键可以被多种酶还原生成二氢硫辛酸,两者可以共同发挥抗氧化作用[1,31]。研究表明,对α-硫辛酸进行结构修饰,不仅可以解决其生物利用度低的问题,反应生成的衍生物还具有良好的抗氧化活性。
2.1.1 清除自由基活性 张露云等[32]以硫辛酸为原料,DCC 和DMAP 为缩合剂合成了23 个硫辛酸酯类衍生物。生物活性测试结果表明,大部分衍生物对丙烯醛、1,1-二苯基-2-苦肼基和羟基自由基等均具有良好的抑制作用。其中硫辛酸丙酯3h对丙烯醛的清除率达到96.6%,清除活性高于对照品肌肽,硫辛酸己酯对1,1-二苯基-2-三硝基苯肼(DPPH)的清除率达到64.9%,清除活性接近于对照品喹诺二甲基丙烯酸酯和维生素 C,对羟基自由基的清除率达到99.9%,清除活性高于对照品维生素E 水溶性类似物(Trolox)。Wang 等[12]采用化学法合成了植物甾醇硫辛酸酯,评估了植物油脂中植物甾醇硫辛酸酯的溶解度和抗氧化能力等物理化学性质。结果表明,二氢硫辛酸甾醇酯(EC50=0.43)的抗氧化作用与阿魏酸相似(EC50=0.43),但低于抗坏血酸(EC50=0.27)和α-生育酚(EC50=0.25)。Madawala 等[23]首次规模合成1,3-二油酰基-2-硫辛酰基-sn-甘油(产率80%)和1,3-二油酰基-2-二氢硫辛酰基-sn-甘油(产率70%)。DPPH 自由基清除实验表明,硫辛酸与DPPH 在摩尔比为8 的条件下,DPPH 自由基剩余率达到98.2%。同样的实验条件下,1,3-二油酰基-2-硫辛酰基-sn-甘油(DHLA)与DPPH 摩尔比为1 的情况下,DPPH 残留率仅为14.4%,而1,3-二油酰基-2 二氢硫辛酰基-sn-甘油(DODHLA)仅为6.4%。结果显示出1,3-二油酰基-2-二氢硫辛酰基-sn-甘油(EC50=0.21 mol/L)具有非常高的体外自由基清除能力。
2.1.2 抗脂质过氧化 Kaki 等[20]采用化学-酶法,以6 种天然酚醛树脂和α-硫辛酸为底物,合成了6种具有潜在生物活性的新型酯。新型酯的分子量较低,氢键受体,氢键供体,羟基和甲氧基的数量较少,表明分子具有良好的吸收和渗透性以及较高的生物利用度。对合成的化合物进行了抗氧化活性评价。分别用DPPH 法和TBARS 测定了新型酯和商业抗氧化剂(作为对照)的自由基清除活性和在鱼油乳液体系中的抗氧化活性。两个方法结果均显示化合物2-(3,4-二羟基苯基乙基)-5-(1,2-二硫杂环戊烷-3-基)戊酸酯表现出最高活性,其自由基清除活性(90.92±0.08)和脂质过氧化抑制活性(57.08±3.83)与生育酚(91.11±0.07,57.28±0.84)相当且优于商业抗氧化剂BHT(86.37±0.08,54.50±0.28)。Kontham 等[18]用硫辛酸与不同的醇进行酯化得到相应的硫辛酸酯并对其热稳定性、抗磨性(AW)、极压(EP)和抗氧化(AO)性能进行了测定。在合成基液中的摩擦学试验表明,所合成的化合物均为抗磨极压添加剂。与工业抗氧化剂BHT(氧化起始温度:221℃,分解温度:230℃)相比,所有制备的酯具有良好的热稳定性和优异的抗氧化性能。其中癸烷-1,10-双二烷基(5-(1,2-二硫戊环-3-亚基))戊酸酯表现出最好的热稳定和抗氧化特性。氧化起始温度和分解温度分别达到295℃和320℃。
2.2 抗癌活性
α-硫辛酸是一种天然存在的辅酶因子,存在于多种调节代谢的多酶复合物中,具有抗癌抗肿瘤活性[33-34]。研究表明,对α-硫辛酸分子改性后获得的衍生物仍然具有显著的抗肿瘤抗癌活性。
2.2.1 抑制癌细胞活性 徐庙军等[35]通过绿色环保的四步一锅法合成α-硫辛酸,并进一步通过酯化、肼化和腙化得到不同的硫辛酸酰肼衍生物。采用四氮唑盐还原法(MTT 法)对衍生物进行了抗肿瘤活性测试,结果表明,α-硫辛酸的衍生物均具有显著的抗肿瘤活性,尤其是衍生物1-(4-羟基苯基亚甲基)-2-(1,2-二硫杂环戊烷-3-基)戊酰肼,其IC50值达到3.69 μg/mL,具有相当于抗癌药物顺铂(IC50=2.62μg/mL)的抑制肿瘤活性;李珊珊[36]将替拉扎明和色氨酸衍生物分别与外消旋的或光学纯的硫辛酸进行酰胺缩合制得目标缩合物。采用MTT比色法考察目标缩合物的体外抗肿瘤活性,发现其对人慢性粒细胞白血病细胞K562、人卵巢透明细胞癌细胞ES-2、人前列腺癌细胞PC-3、人乳腺癌细胞株MDA-MB-231 和人肺癌细胞A549 均具有一定的
抑制活性。其中,化合物N-(2,7,8-苯并三唑-2,7-二氮氧化物)硫辛酰胺的活性最高,对5 种被测细胞株的IC50值均能控制在10 μmol/L 以内。
2.2.2 抑制细胞迁移 Olejarz 等[15]以硫辛酸与别黄木素为底物进行酯化反应生成新的化合物硫辛酸别黄木素酯(LAA),并对其进行了抗癌活性评价。结果表明,LAA 对人正常皮肤细胞HaCaT(IC50=55.5μmol/L)的毒性低于对癌细胞系HTB-140(IC50=34.1 μmol/L)和A549 细胞(IC50=37.2 μmol/L)的毒性。此外,LAA 可显著(P<0.001)抑制细胞迁移,浓度为20 μmol/L 时,LAA 抑制A549 细胞迁移39.5%,HTB-140 细胞47.9%,HaCaT 细胞35.7%。当浓度为40 μmol/L 时,A549 细胞迁移被抑制49.2%,HTB-140 细胞56.4%,HaCaT 细胞迁移被抑制47.9%。
3 结论与展望
本文对近年来硫辛酸衍生物的化学和生物转化法合成情况及其抗氧化活性和抑制癌细胞活性研究进展进行了综述,弥补了现阶段关于硫辛酸衍生物的合成与活性研究进展总结不足的缺陷。现阶段对于硫辛酸衍生物的制备及其活性评价主要存在下列问题:(1)目前国内外关于生物转化制备硫辛酸衍生物的研究报道不多,广大研究学者还需拓宽思路,尽可能引入更多的活性基团及适当的催化剂,进一步丰富硫辛酸衍生物的种类及其功能特性,提高产率,缩短反应时间,是现阶段待解决的问题。(2)现在绝大部分与生物转化在天然产物化学中应用的相关研究工作仍停留在酶的筛选、反应条件的优化水平上,对生物转化规律的归纳、生物催化机制的研究相对薄弱,尤其从分子水平对酶的三维结构与其立体选择性的关系及其底物与酶的结合位点和亲和力等方面的研究更少。(3)硫辛酸衍生物的抗氧化机理、抗癌机制和构效关系尚不清楚。随着现代生物技术的发展,相信生物转化将会被更好地应用到天然产物的结构修饰上来,更多不同种类的硫辛酸酯类衍生物将被合成,其抗氧化、抗癌、抗衰老等多方面的活性会被不断发掘,抗氧化机理和抗癌机制会得到深入的研究。我们有理由相信未来硫辛酸及其衍生物将会被更好的应用在食品、医药、化妆品等行业。

