胃癌颅骨转移1例并文献复习*
尤文铮 胡豆豆 杜水仙 刘守胜 黄新刚 辛永宁,&南京医科大学附属青岛临床医学院 青岛市市立医院(660)青岛市市立医院消化内二科 感染性疾病科 肝病研究室 病理科
病例:患者男性,63岁,因“发现颅骨肿物1个月”于2020-05-08收入青岛市市立医院神经外科。患者于入院前1个月发现左侧额顶颞部肿块,伴头部胀痛,阵发性加重,无恶心、呕吐,无发热、咳嗽、咳痰等症状。既往史、个人史、家族史无特殊。
入院体格检查:体温36.7 ℃,心率76次/min,呼吸17次/min,血压129/78 mm Hg(1 mm Hg=0.133 kPa);神志清,全身浅表淋巴结未触及肿大,左侧额顶颞部见一大小约4 cm×5 cm的肿块,质韧,轻压痛、边界清;心、肺、腹部未见明显异常;神经系统未见阳性体征。
入院后完善各项检查。血常规、肾功能、电解质、尿本周蛋白、粪常规+隐血试验、尿常规未见明显异常;肝功能:总蛋白62.40 g/L,白蛋白35 g/L,碱性磷酸酶(ALP) 360.43 U/L;D-二聚体0.67 μg/mL;血清肿瘤标志物:CEA 196.50 ng/mL,CA19-9>1 000 U/mL。颅脑CT平扫示左侧额顶颞骨骨质破坏,考虑肿瘤,转移瘤可能(图1A)。颅脑MRI增强示左侧额顶颞骨占位性病变:转移瘤?颅骨脑膜瘤?骨髓瘤?(图2)。上腹部CT平扫示胃小弯侧壁结节(图1B)。胸部、下腹部、盆腔CT平扫均未见占位性病灶。为进一步明确左侧颅骨占位性病变性质,在排除禁忌证后于全身麻醉下行颅底肿瘤切除术+颅骨修补术。术后病理:脑膜、横纹肌和骨组织见腺癌浸润(图3);免疫组化标记:CK7(+)、MUC2(-)、MUC5AC(+)、MUC6(-)、CDX(局灶+)、Ki67(约70%+)、CK20(局灶+)、CEA(-)、Villin(+)、TTF-1(-)、NapsinA(-)、HER2(-)、p53(野生型),建议查胃肠道等处寻找原发灶。胃镜检查:胃体小弯偏后壁见大小约2.0 cm×1.5 cm、向腔内生长的半球形肿物,表面结节感、充血糜烂(图4A);活检病理:中分化腺癌(图4B)。进一步完善相关检查。全身骨显像示颅骨左侧颞顶部放射性核素缺损,枕骨、右侧肩胛骨、颈椎、右坐骨、双侧部分肋骨多发放射性核素浓聚灶(图5)。上腹部增强CT示胃小弯侧壁占位,考虑癌;肝左叶弱强化灶,考虑转移。胸部、下腹部、盆腔增强CT均未见占位性病灶。

A:颅脑CT平扫示左侧额顶颞骨多发骨质破坏;B:上腹部CT平扫示胃小弯侧壁局部结节影,最大截面1.5 cm×0.9 cm图1 颅脑和上腹部CT平扫图像
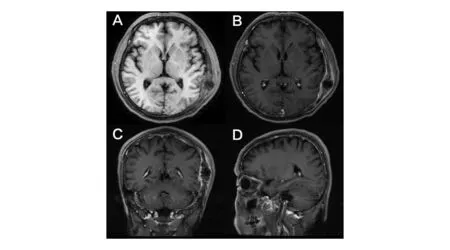
A:左侧额顶颞骨骨质破坏,可见不规则等T1信号影;B、C、D:增强后呈明显不均匀强化,边界欠清,内见不均匀囊变区,邻近硬脑膜增厚强化图2 颅脑MRI图像
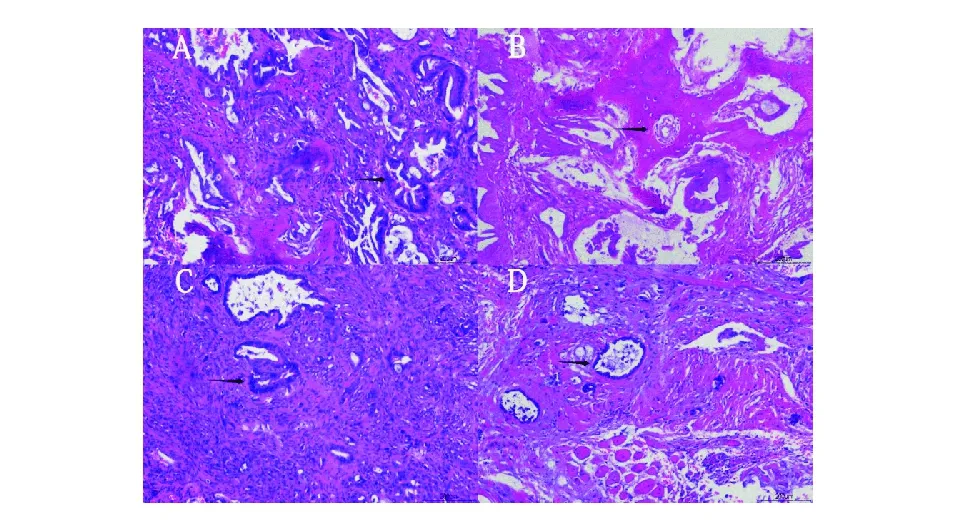
A:脑膜、横纹肌和骨组织见腺癌浸润;B:骨组织见腺癌浸润;C:脑膜见腺癌浸润;D:横纹肌见腺癌浸润图3 颅底肿瘤切除标本病理检查结果(HE染色,×100)
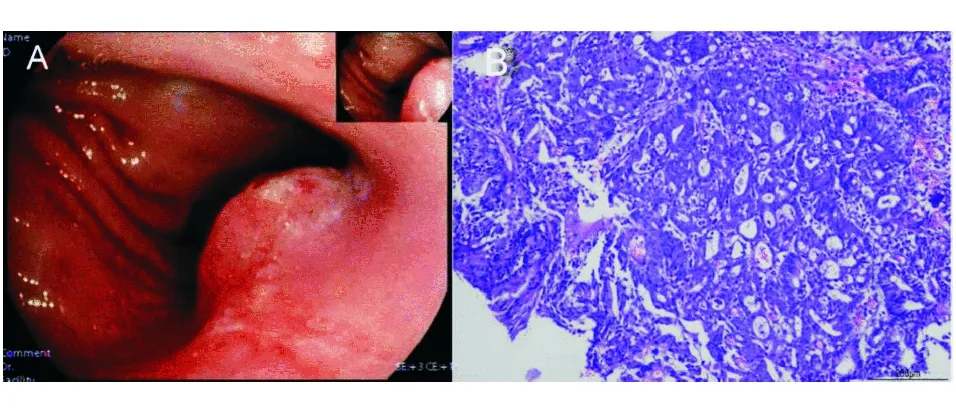
A:胃体小弯偏后壁见大小约2.0 cm×1.5 cm、向腔内生长的半球形肿物,表面结节感、充血糜烂;B:胃组织见腺癌浸润(HE染色,×100)图4 胃镜和活检病理检查结果
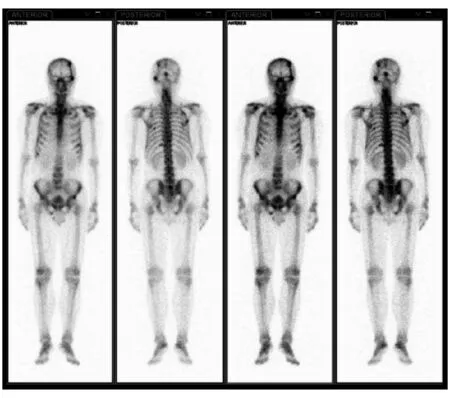
颅骨左侧颞顶部放射性核素缺损,枕骨、右侧肩胛骨、颈椎、右坐骨、双侧部分肋骨多发放射性核素浓聚灶图5 全身骨显像
最终诊断:胃体中分化腺癌TxN0M1Ⅳ期(骨转移,肝转移)。术后患者头痛症状缓解。经普外科、肿瘤科、疼痛科会诊,考虑患者胃癌广泛转移,无根治性手术指征,转入肿瘤科继续治疗。患者HER2阴性,不适宜行曲妥珠单抗靶向治疗,遂予化疗(白蛋白结合型紫杉醇联合顺铂)、唑来膦酸(抑制骨破坏)以及对症止痛等综合治疗。至本文总结,患者仍在继续治疗和随访中。
讨论:胃癌是常见的消化道恶性肿瘤,2018年全球癌症报告显示胃癌年新发病例数超过100万例,死亡病例数超过78万例,发病率和死亡率在恶性肿瘤中分居第5位和第3位[1]。胃癌最常见的转移部位是肝脏和肺,相关临床报道较多。骨转移相对少见,国内学者报道的临床发生率为0.46%~6.93%[2],国外报道发生率为0.9%~2.1%,然而尸检胃癌骨转移率高达13.4%~15.9%[3]。新近国内一项单中心研究[4]报道的胃癌骨转移率也达到11.3%,并指出胃癌骨转移的真实发病率可能被低估。大多数骨转移患者缺乏早期特异性临床表现,易延误诊治。胃癌骨转移最常见的转移部位是腰椎(54.5%)、胸椎(46%)、骨盆(29%)[5],颅骨转移少见,诊治延误率更高,确诊颅骨转移时患者多已处于疾病终末期,往往伴有多器官转移,病情进展迅速,预后差,故早期诊断至关重要。
本例患者病程为1个月,主要表现为头部肿物和头痛,由于症状不典型,加之胃癌颅骨转移发生率低,临床医师对其缺乏认知,起初考虑原发性骨肿瘤可能。胸部、下腹部、盆腔CT平扫均未见占位性病变,故排除常见的前列腺癌、肾细胞癌、原发性肺癌转移可能。因颅脑CT平扫具有溶骨性特征,通过体格检查、实验室检查以及其他相关检查逐一排除了佩吉特病(Paget’s disease)、淋巴瘤、白血病、多发性骨髓瘤等具有溶骨性特征的疾病。血清肿瘤标志物CEA、CA19-9升高,上腹部CT平扫示胃小弯侧壁结节,提示消化道恶性肿瘤转移可能。于是对左侧颅骨占位性病变进行切除,以提供准确、快速的诊断。术后患者头痛症状缓解,手术标本病理检查提示腺癌转移。最后经胃镜活检病理检查和全身骨显像明确诊断为胃癌转移至颅骨。本例患者以头部肿物和头痛为首发表现,最终病理确诊胃癌颅骨转移,实属罕见。以下结合本病例和国内外相关文献报道,对胃癌骨转移的临床特点进行分析总结。
胃癌发生骨转移的机制目前尚不明确。有学者认为癌细胞系通过胃黏膜丰富的毛细血管或通过椎静脉丛非门静脉途径血源性扩散发生骨转移[6]。有学者指出,病例报道中罕见的胃癌迟发性颅骨转移与“肿瘤休眠”机制有关[7]。还有学者从分子水平出发,认为由相关miRNAs参与调控的上皮-间质转化(EMT)在胃癌进展和转移中起关键作用,EMT使肿瘤细胞获得干细胞特性和侵袭性,从而促进远处转移[8]。国内专家总结的胃癌骨转移途径如下:门静脉系统-肝脏-体循环;第四站淋巴结-胸导管-体循环;门静脉与奇静脉间交通支-体循环,或第四站淋巴结-奇静脉-体循环;门静脉-奇静脉系-脊柱静脉[2]。本病例胃癌细胞系通过何种途径转移至颅骨,尚待进一步研究。
诊断胃癌骨转移需符合以下 3个或3个以上条件[9]:①有明确的胃癌病史;②临床骨转移症状明显,如疼痛、恶液质、ALP升高;③全身骨显像有放射性核素浓聚病灶;④X线或 MRI检查诊断为骨转移瘤;⑤病理性骨折。病理检查诊断为骨转移者可确诊。对于临床确诊的胃癌患者,可结合MRI、CT检查明确有无骨质破坏征象。胃癌患者发生不明原因腰背部酸痛或肿胀时,可行全身骨显像。有临床研究[10]发现,半数以上的胃癌骨转移患者在诊断骨转移时存在血清肿瘤标志物CEA、CA19-9升高;另有研究[11]表明骨ALP可作为胃癌骨转移的替代标志物。本例患者亦存在血清CEA、CA19-9升高。对于存在骨转移高危因素的胃癌患者,如组织学类型为低分化腺癌、印戒细胞癌、Borrmann分型Ⅲ型、浸润深度为T3、T4、多发淋巴结转移、多发转移灶、肿瘤位于胃体部的患者[2],可常规行全身骨显像。
胃癌发生骨转移时通常已是疾病的晚期阶段,治疗原则以综合治疗为主。化疗、放疗、手术、双膦酸盐类药物等均在治疗中起重要作用。发生骨转移的胃癌患者预后较差,国内外多项研究报道骨转移诊断后的中位生存期仅为3~6个月[3-5,10,12]。美国一项以SEER数据库为基础的大数据研究[13]亦显示胃癌骨转移患者的中位生存期为3个月。一项纳入208例确诊骨转移胃癌患者的多中心研究[12]表明,未发生骨相关事件(skeletal-related events, SREs),包括骨放疗、骨手术、病理性骨折、脊髓压迫、高钙血症等的患者中位生存期为5个月,发生首次SRE后,中位生存期缩短至3个月。国内一项回顾性研究[4]发现,接受化疗的骨癌骨转移患者中位生存期显著长于未接受化疗者(P=0.004)。与胃癌骨转移患者中位生存期延长相关的因素包括孤立性骨转移、高分化肿瘤、姑息化疗、双膦酸盐类药物治疗等[5]。异时性转移、骨外转移、乳酸脱氢酶(LDH)、CEA、CA19-9水平升高、基础状况差、骨髓转移、高钙血症和多发性骨骼受累则与较短的生存期相关[3-5,10,12]。
综上所述,临床上遇有以头部肿物、头痛为主要表现的患者时,可予完善颅脑CT、MRI、全身骨显像或PET-CT等影像学检查,在排除颅内病变后,需警惕颅外系统恶性肿瘤发生颅骨转移的可能。对于原发部位不明的颅骨转移患者,在排除常见的前列腺癌、乳腺癌、肾细胞癌、原发性肺癌等转移的可能外[13],还应考虑消化系统恶性肿瘤如胃癌颅骨转移可能。胃癌发生骨转移时缺乏特异性临床表现,易延误诊治,患者病情危重,预后较差。尽早甄别具有骨转移高危因素的胃癌患者进行早期筛查和干预,可能有助于改善预后。

