Ni在纳米Fe/Ni还原水中Cr(Ⅵ)过程中的促进机制
刘 红,宁晓勇,阮 霞,王珺雯,廖丽莎
(1. 武汉科技大学资源与环境工程学院,湖北 武汉,430081;2. 武汉科技大学冶金矿产资源高效利用与造块湖北省重点实验室,湖北 武汉,430081;3. 中国水利水电科学研究院,北京,100038)
随着电镀、冶金、化工颜料、纺织等现代工业的持续发展,其生产过程中产生的含Cr(Ⅵ)废水对环境的污染日益严重[1]。Cr(Ⅵ)具有易蓄积、难降解、毒性大等特点,进入环境后难以消除,并可参与食物链循环进入人体,对人类健康产生威胁[2]。近年来,研究者利用纳米零价铁(nZVI)去除水中重金属污染物,收到明显效果[3-4]。Cr(Ⅵ)在nZVI的强还原作用下可转变为毒性较低的Cr(III),且Cr(III)多以沉淀形式存在,迁移性较差,因此对于环境和人类的危害程度显著降低[5]。但nZVI在制备和存储过程中易氧化,造成其还原能力弱化[6],针对该状况,已有研究表明,若引入另一种氧化还原电位较高的过渡金属,沉积于nZVI表面获得纳米铁基双金属复合材料,进而利用其中由双金属构筑而成的大量微小原电池,即可加速nZVI的电子转移,有效提高其与污染物的反应速率,并且双金属体系还可避免nZVI发生氧化,保持其反应活性及稳定性[7-9]。截止目前,研究报道较多的纳米铁基双金属有纳米Fe/Pd、Fe/Ni、Fe/Cu、Fe/Au等[10-11],但其中Fe/Pd、Fe/Au双金属制备成本较高,Fe/Cu复合材料去除重金属效果又欠佳,因此选择纳米Fe/Ni复合材料,不仅价格适中,而且其对重金属污染物的去除能力也较强。一般认为,Ni通过三种机制发挥其对nZVI还原性能的增强作用[12]:(1)Ni沉积于nZVI表面在一定程度上能避免nZVI发生氧化,从而保护其还原活性;(2)Ni可将nZVI腐蚀产物H2转化为活性氢原子,而活性氢原子比H2有更强的还原能力;(3)Ni作为Fe-Ni原电池的阴极,可促进Fe0发生电化学腐蚀,产生更多具有还原性的Fe2+来增强其还原能力。为了明确Ni对nZVI/Ni双金属复合材料还原水中Cr(Ⅵ)的具体促进机制,本文对比了nZVI与nZVI/Ni复合材料之间的形貌组成及二者对水中Cr(Ⅵ)的去除效果,考察了二者还原Cr(Ⅵ)时的活化能变化,并研究了外加H2或Fe2+对材料还原水中Cr(Ⅵ)性能的影响,在此基础上重点分析了Ni影响nZVI/Ni复合材料还原性能的具体机制。
1 实验材料与方法
1.1 试剂
硫酸亚铁、硼氢化钠、硫酸镍、重铬酸钾等,均为分析纯;四丁基硫酸氢铵和乙腈,色谱纯。
1.2 材料的制备
采用液相还原法制备nZVI/Ni双金属复合材料。具体步骤为:在N2保护氛围下,向盛有50 mL FeSO4溶液(浓度为2 mol/L)的三口烧瓶中滴加相同浓度的NaBH4溶液总计100 mL并持续搅拌15 min,随后向其中加入1 mL浓度仍为2 mol/L的NiSO4溶液,继续搅拌15 min后将混合液抽滤,滤后所得固体物质经去离子水多次冲洗后置于真空冷冻干燥机中干燥处理8 h,即可制得nZVI/Ni双金属材料,实测所制样品中w(Ni)为1.9%。期间发生的主要化学反应为

(1)

(2)
此外,依照上述制备步骤,在取消NiSO4溶液添加环节的条件下制得nZVI样品备用。
1.3 测试与表征
借助JEM-2100 UHR型高分辨透射电镜(TEM)并结合能谱仪(EDS)对样品微观形貌及成分进行分析。
使用重铬酸钾配制一定浓度的含Cr(Ⅵ)溶液(初始pH=5.0±0.1),将样品按预设添加量加入该溶液后置于振荡反应器中使其充分反应,分别在5、10、20、40、60、80、100、120 min时用注射器取2~5 ml水样,水样经0.45 μm微孔滤膜过滤后采用UltiMate 3000 Series型高效液相色谱仪检测溶液中Cr(Ⅵ)的浓度,流动相为5 mmol/L的四丁基硫酸氢铵溶液和乙腈按体积比6∶4混合。
2 结果与讨论
2.1 样品的微观分析
nZVI和nZVI/Ni样品的TEM照片及EDS分析结果如图1所示。从图1(a)可见,nZVI颗粒呈较规则的球状形貌,其粒径约为57 nm,中心区域颜色较深,边缘颜色略浅,为典型核-壳结构,经测量,其中壳层厚度为5.46 nm,这与黄潇月等的研究报道[13]一致。这主要是因为nZVI在空气中易被氧化,从而在其颗粒外表面形成了一层较薄的氧化铁层。EDS分析结果(图1(b))也表明,nZVI样品颗粒由铁元素和氧元素组成。根据nZVI颗粒直径及其表面氧化壳层厚度,计算得到nZVI颗粒的核心体积约为52241.90 nm3,其壳层体积约为46367.24 nm3,即nZVI颗粒中nZVI体积约占颗粒总体积的52.98%,这与本课题组采用张威等的专利装置[14]对该样品进行测试所得实测值(50.12%)十分接近。从nZVI/Ni样品的TEM照片(图1(c))可以看出,nZVI/Ni颗粒外部氧化壳层不完整,约有1/3部分残缺不全,表明nZVI表面沉积的Ni阻碍了空气中O2对nZVI的氧化。nZVI/Ni样品的EDS分析结果(图1(d))显示其元素组成为铁、氧和镍,这表明虽然Ni沉积到nZVI表面,但仍有部分nZVI被氧化。以上表征结果证实了Ni可在一定程度上避免nZVI氧化,因此能对其还原活性起到了促进作用。
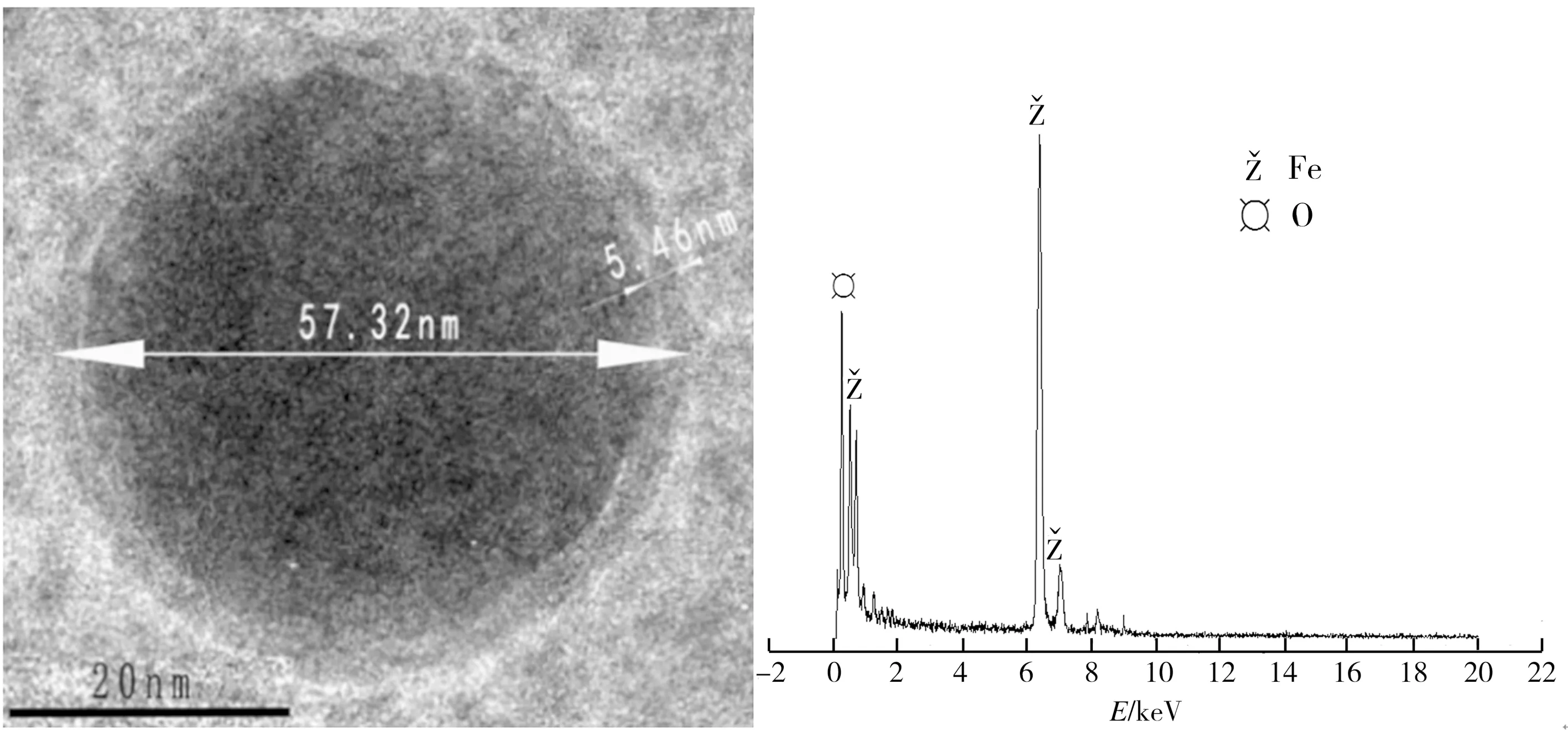
(a)nZVI的TEM照片 (b)nZVI的EDS图谱

(c)nZVI/Ni的TEM照片 (d)nZVI/Ni的EDS图谱
图1 样品的TEM照片及EDS图谱
Fig.1 TEM images and EDS patterns of samples
2.2 样品去除水体中Cr(Ⅵ)的效果
常温时在含Cr(Ⅵ)溶液初始浓度为22 mg/L、材料投加量为0.2 g/L的条件下,分别经nZVI和nZVI/Ni材料处理一段时间后,水体中Cr(Ⅵ)的实际浓度如图2所示。基于图2测试结果,可计算出反应时间为120 min时,nZVI和nZVI/Ni对Cr(Ⅵ)的去除率η分别为73.79%、96.24%, nZVI/Ni对Cr(Ⅵ)的去除能力相比nZVI明显提升。因nZVI和nZVI/Ni还原Cr(VI)的反应均属于物质在溶液中的复相反应,该复相反应动力学符合表观一级反应方程[15-16],故可计算出nZVI和nZVI/Ni还原水中Cr(Ⅵ)时的表观速率常数k分别为0.007 80、0.022 49 min-1,显然当nZVI表面沉积一定量的Ni后,其还原Cr(Ⅵ)的性能得到较大提升,这与样品微观分析所得结论相吻合。此外,在nZVI和nZVI/Ni还原水体中Cr(VI)的反应过程初期,溶液pH值均由初始的5.0左右迅速上升直至接近8.0,随着反应时间的延长,溶液pH值变化趋于平缓,反应60 min时溶液pH值基本稳定在8.0附近。这是因为在二者还原Cr(VI)的过程中,材料中的Fe0会消耗溶液中H+或与H2O反应产生OH-,使溶液pH升高。由于在上述Cr(VI)还原过程中,溶液pH值变化规律相近,故难以通过该值变化反映出Ni在nZVI/Ni双金属复合材料还原Cr(VI)过程中的促进机制。
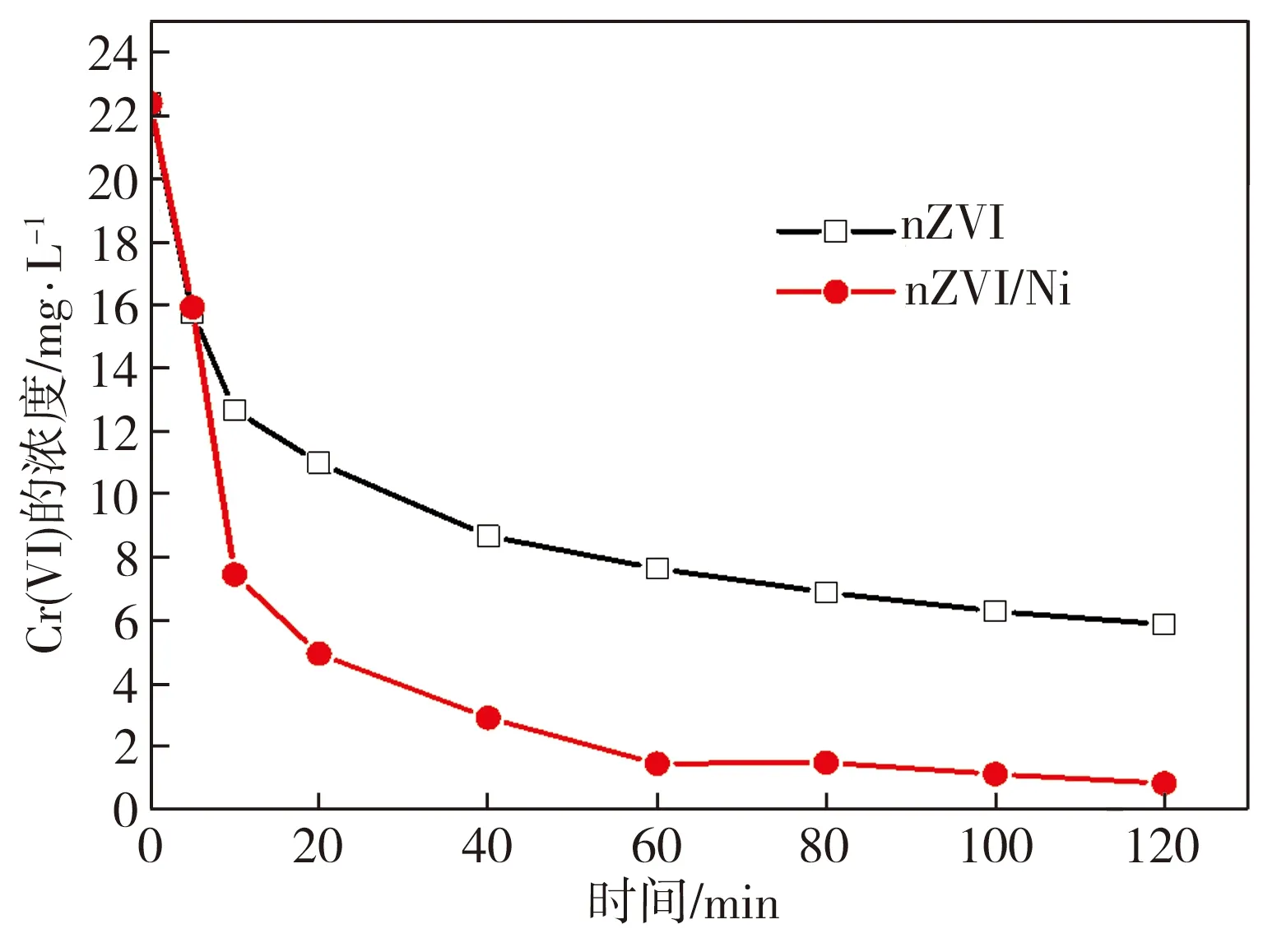
图2 Cr(Ⅵ)的浓度变化
2.3 样品还原水体中Cr(Ⅵ)的活化能
在含Cr(Ⅵ)溶液初始浓度为50 mg/L、nZVI和nZVI/Ni材料投加量均为0.2 g/L的条件下,温度对Cr(Ⅵ)去除率的影响如图3所示。由图3可见,在相同处理条件下,当反应进行一段时间后,随着温度上升, nZVI和nZVI/Ni材料对水中Cr(Ⅵ)的还原效率整体均呈上升趋势。基于图3试验数据,计算出两种材料在不同温度下还原水体中Cr(Ⅵ)的表观速率常数k,所得结果列于表1,其中r为相关系数。由表1可以看出,在相同温度条件下,nZVI/Ni复合材料还原Cr(Ⅵ)的表观速率常数均大于nZVI的相应值。

(a)nZVI/Ni

(b) nZVI
表1 不同温度下的表观速率常数
Table 1 Apparent rate constants at different temperatures

温度/℃nZVI/Nik/min-1r2 nZVIk/min-1r2100.002 80.852--200.003 50.8800.002 20.835300.004 10.9040.002 40.869400.005 10.9340.004 60.934500.006 20.9490.005 90.966600.011 30.9870.009 90.990
借助Arrhenius模型,结合表1数据,对表观速率常数k与反应温度T进行拟合的结果见图4。拟合方程为
(3)
式中,Eα为反应活化能,R为摩尔气体常量(8.3144 J/(mol·k)),A为常数。


图4 nZVI and nZVI/Ni还原Cr(Ⅵ)反应的活化能
Fig.4 Activation energy of Cr(VI) reduction by nZVI and nZVI/Ni
2.4 外加H2对样品还原水体中Cr(Ⅵ)的影响
常温条件下,当含Cr(Ⅵ)溶液初始浓度为22 mg/L时,分别在通氢及无氢条件下往溶液中投加不同材料对Cr(Ⅵ)进行去除,材料投加量均为0.2 g/L,相应Cr(Ⅵ)去除率的变化如图5所示。由图5可见,在反应过程中,仅通入H2对水中Cr(Ⅵ)几乎没有去除效果;在无氢条件下,向溶液中加入nZVI或nZVI/Ni材料,反应120 min时, Cr(Ⅵ)的去除率分别为78.01%、81.72%,而在有氢环境下,向溶液中加入nZVI或nZVI/Ni材料时的相应值相比未通H2时分别下降了5.90%、11.77%,由此可见,本研究中加入H2对还原Cr(Ⅵ)并无促进作用。此外,已有研究表明,金属Ni具有吸附氢的性质,并能将其分解转化为还原能力更强的活性氢原子,从而实现H2的还原作用[18],然而,图5实验结果表明,在无氢或有氢条件下,加入纳米Ni(n-Ni)至体系中反应120 min时,水中Cr(Ⅵ)的去除率均较低且相差不大,所以,即使H2被Ni分解产生了活性氢原子,但对Cr(Ⅵ)的还原却几乎不起作用,由此推断,在本研究中,Ni将nZVI腐蚀产物H2转化为活性氢原子未能促进水体中Cr(Ⅵ)的还原。

图5 在通入/未通H2条件下Cr(VI)的去除率
2.5 外加Fe2+对样品还原水体中Cr(Ⅵ)的影响
常温条件下,当含Cr(Ⅵ)溶液初始浓度为22 mg/L、nZVI或nZVI/Ni材料投加量均为0.2 g/L时,外加Fe2+对上述两种材料还原水体中Cr(Ⅵ)的影响如图6所示。由图6可见,在nZVI/Ni还原Cr(Ⅵ)体系中加入0.1 mmol/L Fe2+时,在反应过程最初20 min内,水体中Cr(Ⅵ)浓度迅速下降,反应120 min时,Cr(Ⅵ)去除率达到了99.96%,相比其未加Fe2+时的相应值增加了6.78%。同样,在nZVI还原Cr(Ⅵ)体系中外加0.1 mmol/L Fe2+,反应120 min时,Cr(Ⅵ)去除率为83.73%,相比该体系未加Fe2+时的相应值增加了5.49%。因此,外加一定量的Fe2+后,两种材料对于水中Cr(Ⅵ)的去除效果均得到提升,表明Fe2+对于Cr(Ⅵ) 还原具有促进作用。

图6 外加Fe2+对nZVI和nZVI/Ni还原水中Cr(Ⅵ)的作用
Fig.6 Effect of adscititious Fe2+on Cr(VI) reduction by nZVI and nZVI/Ni
为进一步探究Fe2+在材料还原水体中Cr(Ⅵ)时的促进作用,向初始浓度为22 mg/L的含Cr(Ⅵ)溶液添加不同浓度的Fe2+来还原Cr(Ⅵ),结果如图7所示。由图7可见,在反应阶段最初10 min内,不同Fe2+浓度体系中的Cr(Ⅵ)浓度均迅速下降,此后,随着时间的延长,Cr(Ⅵ)浓度基本不发生改变。当外加Fe2+浓度由0.1 mmol/L增加到0.5 mmol/L,反应120 min时,相应的Cr(Ⅵ)去除率由15.73%增加到68.61%。

图7 不同浓度的Fe2+对Cr(Ⅵ)的去除效果
Fig.7 Removal effect of Cr(Ⅵ) by Fe2+of different concentrations


(4)


(5)
由式(4)、式(5)可知,ΔE1、ΔE2均大于0且ΔE1小于ΔE2,表明理论上Fe0和Fe2+均可直接将Cr(Ⅵ)还原,且Fe2+对于Cr(Ⅵ)的还原能力要强于Fe0。此外,由于离子态Fe2+与Cr(Ⅵ)的反应是均相反应,而固体材料nZVI与Cr(Ⅵ)的反应属于非均相反应,所以前者的反应速度和效率也会高于后者。据此推断,在nZVI或nZVI/Ni材料还原水中Cr(Ⅵ)的过程中,材料中的Fe0先将一部分Cr(Ⅵ)还原并产生Fe2+,而后Fe2+再进一步将Cr(Ⅵ)还原,该过程的反应式为
2Cr3+(aq)+3Fe2+(aq)+7H2O
(6)
2Cr3+(aq)+6Fe2+(aq)+7H2O
(7)
不过,与nZVI不同的是,nZVI/Ni材料中的Ni还可与Fe0形成Fe-Ni原电池[19],而Ni作为Fe-Ni原电池的阴极,可促进Fe0发生电化学腐蚀,加快Fe2+产生的速度,该过程如图8所示。因此,Ni既加速了Fe0的电子转移,同时也促进了还原性更强的Fe2+的产生,从而使Cr(Ⅵ)的还原效率得以提高,故Ni与Fe0形成Fe-Ni原电池,是nZVI/Ni还原Cr(Ⅵ)过程中的促进机制。

图8 nZVI/Ni还原Cr(VI)示意图
Fig.8 Schematic diagram of Cr(VI) reduction by nZVI/Ni
3 结论
(1)Ni可降低nZVI还原Cr(Ⅵ)的反应需要克服的能垒,与nZVI相比,nZVI/Ni还原水体中Cr(Ⅵ)的去除率增加了30.42%,反应活化能降低了15.31 KJ/mol。
(2)Ni阻止Fe0氧化以及形成Fe-Ni原电池均增强了nZVl/Ni材料还原水体中Cr(Ⅵ)的能力,但其将nZVI腐蚀产物H2转化为活性氢原子并没有发挥促进作用。

