基于微流控芯片的核酸适配体筛选技术研究进展
姜浩 吕雪飞 赵可心
摘 要 适配体(Aptamer)是通过指数富集的配体系统进化技术(SELEX)筛选得到的,可与靶标分子以高亲和力特异性结合的单链DNA或RNA,在生物分离分析、临床诊断和疾病靶向治疗等领域应用广泛。适配体的发展与筛选技术的进步密切相关,以SELEX为基础,研究者开发了磁珠SELEX和毛细管电泳SELEX等多种适配体体外筛选技术,但这些方法存在筛选轮次多、筛选周期长和样品消耗量大、对小分子筛选效率低等缺点。微流控芯片具有体积小、高通量和易集成等特点,基于微流控芯片的SELEX技术在一定程度上可解决上述问题,实现适配体快速、高通量的体外筛选。本文在总结SELEX及其关键技术要点的基础上,重点评述了基于微流控和微阵列芯片SELEX技术的研究进展,并对SELEX技术中未来的发展方向进行了总结和展望。
关键词 适配体;筛选;指数富集的配体系统进化技术;微流控芯片;微阵列芯片;评述
1 引 言
适配体是通过指数富集的配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)在体外筛选得到的一段寡聚核糖核苷酸(RNA)或单链脱氧核糖核苷酸(ssDNA)序列,与靶标分子之间具有特异性相互作用,借助范德华力、氢键、疏水作用和静电作用等分子间作用力,折叠成复杂稳定的3D结构,如茎环[1]、发夹[2]和G四链体[3]等。自1990年Ellington[4]和Tuerk[5]从含有1015种寡核苷酸文库中筛选出RNA适配体以来,研究者陆续筛选出许多适配体,其靶标范围覆盖了金属离子、三磷酸腺苷(ATP)、氨基酸等小分子物质;生长因子和细胞粘附分子等蛋白质以及其它大分子有机物,甚至可通过靶向特定的膜蛋白识别病毒、细菌和细胞。目前,适配体已被广泛用于靶向药物递送[6]、生物分子识别和检测[7]等领域,并已尝试用于临床治疗方面[8]。
适配体与靶标分子的亲和力可达mmol/L~pmol/L级别,与抗体水平相当[9]。适配体具有抗体不能比拟的优势,如更高的选择性和稳定性、制备简单、易修饰、无免疫原性等,因此受到研究者关注。
适配体的发展与筛选技术的进步密切相关。研究者根据SELEX的关键技术要点对传统筛选技术进行了改良,如依据结合与未结合寡核苷酸的分离技术,提出了基于磁珠分离法的SELEX技术[10]和基于毛细管电泳分离法的SELEX技术[11]等;提出了基于不对称PCR法[12]、λ核酸外切酶法[13]和磁珠法的次级文库制备技术[14]。但是,SELEX技术仍存在筛选轮次多、筛选周期长、文库合成量大、利用率低、样品消耗量大等问题。微流控芯片具有体积小、高通量和易集成等特点,基于微流控芯片的SELEX技术在一定程度上可解决上述问题,为实现适配体快速、高通量的体外筛选提供了新思路。
本文依据近年来适配体筛选技术的研究进展,在总结SELEX及其关键技术要点的基础之上,重点评述了基于微流控芯片和微阵列芯片SELEX技术的研究进展。
2 SELEX及其关键技术要点
2.1 SELEX技术
SELEX技术首先需构建一个特定长度、库容量为1014~1015的寡核苷酸文库,理论上,该文库应包含所有序列的适配体;然后,将文库与靶标分子孵育、洗涤后,将未结合和结合不牢固的寡核苷酸洗掉,收集牢固结合的寡核苷酸与靶标分子复合物,采用聚合酶链式反应(Polymerase chain reaction,PCR)对收集到的寡核苷酸进行扩增,制备次级文库,用于下一轮的筛选;经过十余轮的筛选即可得到与靶标分子具有较高亲和力的适配体候选物;最后,通过克隆与测序,得到相应的适配体序列。
2.2 结合与未结合寡核苷酸的分离技术
2.2.1 基于磁珠的结合与未结合寡核苷酸的分离技术 磁珠表面可修饰多种功能化基团,如链霉亲和素、氨基、羧基和甲苯磺酰基等,适用于不同靶标分子的固定[10],并可利用磁场实现快速分离。因此,磁珠SELEX技术是目前应用最广的固定靶标的适配体筛选技术。
本研究组在前期的工作中,建立了基于磁珠分离法的SELEX技术(磁珠SELEX),用于生物大分子的适配体筛选。例如,Xiao等[15]通过磁珠SELEX技术筛选出一组特异性与胰蛋白酶结合的适配体,并作为酶的固载介质,制备了基于适配体的酶反应器,与质谱技术联用,用于蛋白质的在线酶解。Zhang等[16]通过磁珠SELEX技术筛选得到一组肌酸激酶同工酶的适配体,并进一步优化出可结合肌酸激酶同工酶不同位点的一对适配体,建立了基于双适配体夹心的荧光侧向流层析技術,实现了肌酸激酶同工酶的定量检测。
但是,磁珠SELEX技术存在靶标分子易过度修饰问题,过高密度的靶标分子间的协同作用会降低每轮筛选中寡核苷酸的富集效率[17],可能对筛选进程产生影响。Hünniger等[18]建立了快速磁分离和固相乳液PCR(emPCR)的适配体筛选技术,将文库与靶标分子的孵育、洗涤和洗脱等步骤集成为“FISHing”自动化程序,将所得的洗脱液直接通过emPCR进行扩增。所建立的筛选技术用于葡萄酒澄清剂中溶菌酶的适配体筛选,得到了亲和力在nmol/L级的适配体(Kd=4.0~20.7 nmol/L),与以往报道的溶菌酶的适配体亲和力(Kd=2.8~52.9 nmol/L)相当[19]。
2.2.2 基于毛细管电泳的结合与未结合寡核苷酸的分离技术 毛细管电泳(Capillary electrophoresis,CE)可根据寡核苷酸与寡核苷酸-靶标复合物在电场中的迁移速度不同实现分离。通常情况下,复合物的迁移较寡核苷酸慢,与之对应的筛选技术为毛细管电泳SELEX技术(CE-SELEX)。不同于磁珠SELEX,CE-SELEX技术无需固定靶标,只需2~4轮即可筛选出能结合靶标的适配体,大大加快了筛选进程。但是,CE-SELEX技术会出现结合与未结合靶标分子的寡核苷酸均向毛细管电泳仪的出口端移动,会对适配体的筛选产生一些干扰,因此需要严格控制筛选时间,这可能会导致文库富集率低等问题[20]。
研究人员先后在CE-SELEX技术的改良方面做了很多创新性的工作,提出了低pH CE-SELEX技术(LpH-CE-SELEX)[21]、分流收集CE-SELEX技术(FCE-SELEX)[22]和同步竞争CE-SELEX技术(scCE-SELEX)[20]等,其中,LpH-CE-SELEX在一定程度上避免了未结合靶标分子的寡核苷酸对筛选过程的干扰,FCE-SELEX有效降低了被其它寡核苷酸污染的可能性,scCE-SELEX可实现多个靶标分子适配体的同时筛选。
2.3 次级文库的制备技术
作为新一轮SELEX的起点,次级文库中寡核苷酸的数量和质量对筛选结果至关重要。因此,次级文庫制备技术成为适配体筛选的关键技术之一。
2.3.1 磁珠法制备次级文库 利用链霉亲和素与生物素之间的非共价相互作用以及磁珠在磁场下易操作的特点,磁珠在次级文库制备中发挥了重要作用[14]。首先,利用生物素标记的引物进行PCR扩增得到生物素化的双链DNA;然后,生物素化的双链DNA与链霉亲和素修饰的磁珠共同孵育;最后,在碱性条件下,双链DNA变性解链,磁分离后,上清液中不带生物素的正义链经乙醇沉淀回收,即为制备的次级文库。
2.3.2 λ核酸外切酶法制备次级文库 λ核酸外切酶作用于5端修饰有磷酸基团的双链DNA,可通过其对5端磷酸化的双链DNA的水解制备次级文库[13]。首先,利用带磷酸基团标记的引物进行PCR扩增,得到5端磷酸化的双链DNA;其次,λ核酸外切酶水解5端磷酸化的双链DNA,使其反义链从5端逐步降解;最后,利用乙醇沉淀等方式将正义链回收,即得到所需的次级文库。
2.3.3 不对称PCR法制备次级文库 不对称PCR法是利用不等量的一对引物扩增产生大量单链DNA的方法,在次级文库制备和核苷酸序列分析中具有重要作用[12]。通过控制限制引物和非限制引物浓度的比例(1∶50~1∶100)达到制备单链DNA的目的。反应初期的主要产物为双链DNA,待限制引物用尽后,反应产生的均为正义链。最后,对正义链和双链DNA进行电泳分离,回收得到的正义链即为制备的次级文库。
3微流控芯片SELEX技术
3.1 微流控芯片概念及特点
微流控芯片又称为微全分析系统,是由Manz等[23]在20世纪90年代首次提出并发展起来的跨学科分析技术。通过微加工技术,在硅、玻璃或有机聚合物基质上构建流体微通道、反应微腔室和储液池等微结构单元,将分析过程的样品制备、反应、分离、检测等基本操作单元集成到一块微米尺度的芯片上,自动完成分析全过程。微流控芯片具有集成化、小型化、自动化等特点,以及样品和试剂消耗量少、反应速度快、可大量平行处理等优点,在生物、化学和医学等领域表现出巨大的发展潜力。目前,微流控芯片技术已被广泛用于细胞培养[24]、基因扩增与分析[25~27]和蛋白质检测[28]等领域。
基于微流控芯片的SELEX技术是近年发展起来的一种快速高效的适配体筛选体系。将微流控芯片与SELEX技术结合,可将样品和试剂的消耗量降至微升级,大大降低了筛选成本,提升了分析速度和准确性。目前,已发展的微流控芯片SELEX技术主要包括磁珠法[29]和溶胶-凝胶法[30]等。
3.2 微流控芯片SELEX技术筛选适配体
3.2.1 基于磁珠的微流控SELEX技术 基于磁珠的微流控SELEX技术主要包括连续流磁激活分离芯片(Continuous-flow magnetic activated chip-based separation,CMACS)系统和微磁分离(Micro magnet separation,MMS)系统。
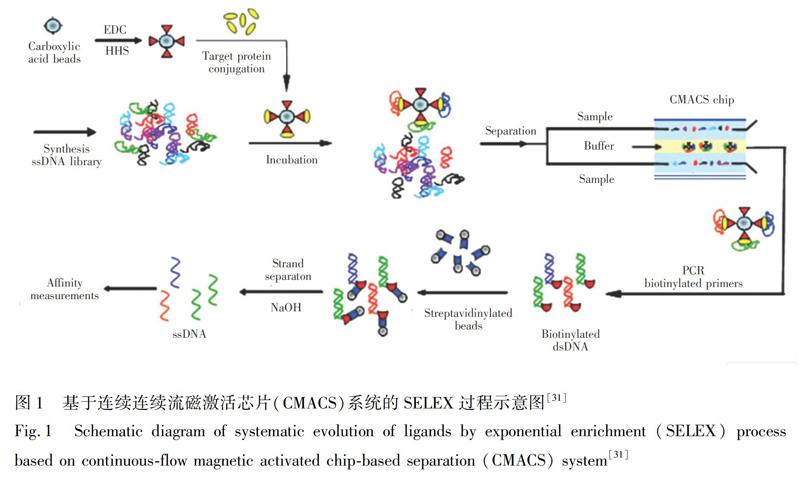
Soh研究组[31]利用CMACS系统,通过芯片连续流磁分离对重组A型肉毒杆菌神经毒素轻链的适配体进行筛选(图1)。首先,通过PCR扩增制备DNA文库,并通过1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)介导法将靶标分子固定在磁珠上;然后,将DNA文库与固定有靶标分子的磁珠共同孵育,在CMACS芯片上进行连续洗涤;最后,用生物素化的反义引物进行PCR扩增,通过磁珠法制备次级文库,并测定其亲和力。
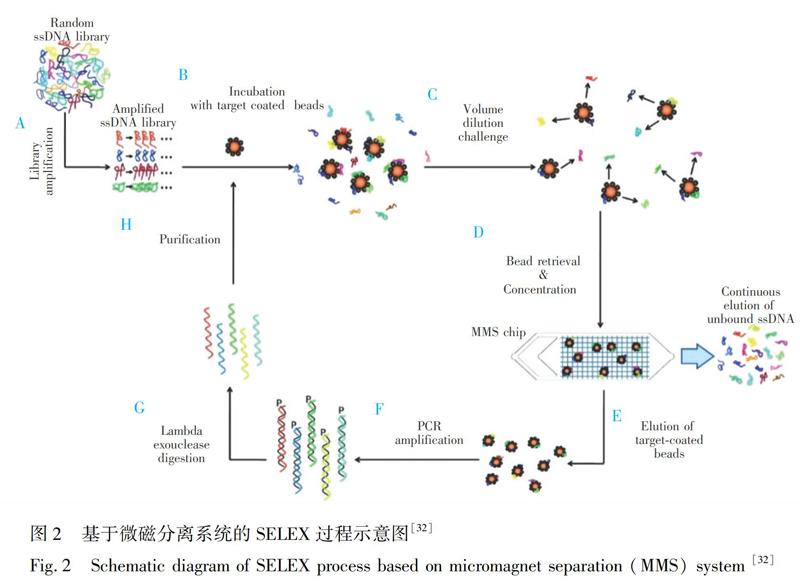
然而,CMACS系统使用过程会出现微气泡导致的气流扭曲,以及微通道阻塞导致的磁珠聚集等问题,影响适配体的纯度和回收率。在后续的研究中,Soh研究组[32]开发了MMS系统(图2),将铁磁材料整合到微通道中,通过芯片中镍材料和缓冲液间磁导率的相对差异,实现对通道内流体动力和磁致动力的精确控制[33],减少了磁珠和适配体候选物的损失,实现了较高的分子分配效率。
Huang等[34]在MMS芯片的基础上,将反应池、分离通道和微加热系统整合到一块芯片上,成功筛选出C反应蛋白的适配体,与传统SELEX技术相比,基于微流控芯片的SELEX技术在单轮筛选时间和样品消耗量上均大大降低。
Ahmad等[35]利用MMS芯片高效的捕获能力和可高流速洗涤的特点,成功筛选出3种蛋白质的适配体:人血小板衍生生长因子BB(Kd=0.028 nmol/L)、凝血酶(Kd=0.33 nmol/L)和载脂蛋白E3(Kd=3.1 nmol/L)。通过低浓度蛋白筛选和高流速、长时间洗涤,降低了非特异性吸附和弱结合的情况,获得了与文献[36,37]不同的人血小板衍生生长因子BB和凝血酶的适配体序列,而且亲和力也有了较大程度的提升。研究人员还发现适配体的亲和力受蛋白质带电状态的影响,由人血小板衍生生长因子BB在不同pH条件下的筛选结果发现,在酸性缓冲液中,其与适配体具有更高的亲和力。
Stoltenburg等[38]使用常规磁珠SELEX技术经13轮筛选得到链霉亲和素的适配体,其解离常数约为56~86 nmol/L。而使用MMS系统经3轮分离后即得到了解离常数在25~65 nmol/L之间的适配体。由此可见,基于微流控芯片的微磁分离SELEX技术比常规的磁珠SELEX技术更高效。
3.2.2 基于溶胶-凝胶的微流控SELEX技术 溶胶-凝胶是用含高化学活性的化合物作为前体,在液相下均匀混合并进行水解、缩合等反应,形成稳定的透明溶胶体系,经过胶粒间缓慢聚合,形成三维空间网络结构的凝胶。凝胶经过干燥、烧结、固化,制备出纳米乃至亚纳米结构的材料。通过溶胶-凝胶及其衍生物材料固定蛋白质,无需亲和试剂标记,加入硅酸盐可最大程度地保持蛋白质的生物活性[39],且可长期保存不失活[40]。此外,溶胶-凝胶材料价格相对便宜,与芯片底板材料性质相近,具有极好的相容性。这些特点为溶胶-凝胶在微流控芯片上的应用和这一类型芯片的大规模生产奠定了基础[41]。
基于溶胶-凝胶的微流控SELEX技术中,靶标分子包裹于具有多孔纳米结构的硅酸盐水凝胶中,寡核苷酸进入纳米孔与靶标分子结合[42]。因此,溶胶-凝胶颗粒的加工工艺极为关键[43~45]。首先,溶胶-凝胶基质中纳米孔结构的尺寸必须与靶标分子匹配;其次,溶胶-凝胶颗粒须在点样后长时间稳定存在,并且有足够强的粘附力,以防洗涤过程中颗粒丢失;最后,每个颗粒的形态与尺寸必须统一,这对采用计算机自动分析实验结果至关重要。
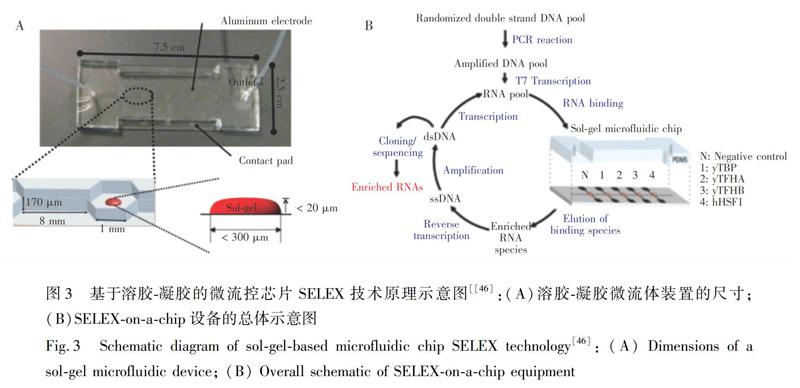
Ahn等[46]在芯片上集成溶胶-凝胶腔室和微加热器等结构单元,用于文库的洗脱和筛选(图3)。该芯片带有一组铝电极、5个相连的六边形腔室和聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)微通道,各腔室靶标分子竞争性结合寡核苷酸链。每个腔室内单个溶胶-凝胶颗粒的体积约为7 nL,每个颗粒可容纳30 fmol蛋白质。将该技术用于酵母TATA结合蛋白和几种同源蛋白质的适配体筛选,仅经过6轮筛选,得到了解离常数为2.7 nmol/L的TATA结合蛋白的适配体。
小分子适配体的体外筛选工作极具挑战性,一是因为小分子难以固定;二是受小分子本身结合位点数的限制,筛选出的适配体与小分子的结合也会受到影响。通过改变溶胶-凝胶颗粒孔径的尺寸,可很好地实现小分子靶标的固定。Bae等[47]加工了具有纳米孔径和微米通道的溶胶-凝胶颗粒,寡核苷酸可在微米通道内自由移动,但与小分子靶标相互作用后,被截留在溶胶-凝胶颗粒中。通过基于溶胶-凝胶法的微流控SELEX技术,采用7轮筛选得到了黄嘌呤的适配体,解离常数为4.2 μmol/L。
微流控芯片与SELEX技术结合,提高了适配体的筛选效率,降低了筛选成本。但是,基于微流控芯片的适配体筛选技术在流体流动过程中常会产生气泡[48],对靶标分子与适配体的识别,以及后续的PCR扩增等均会产生影响。
4 微阵列芯片SELEX技术筛选适配体
4.1 微阵列芯片及其分类
微阵列芯片是通过微点阵技术或微颗粒填充技术将数以万计的生物探针固定在基板上,通过生物探针与溶液中的待测分子特异性结合完成分析和检测过程。微阵列芯片表面不存在微通道、微腔室等微结构,无需考虑流体在芯片内部流动造成的堵塞和气泡等问题,降低了芯片加工和使用的难度。另外,微阵列芯片的实验结果可通过计算机阵列分析技术获得。
4.1.1 核酸微阵列芯片与蛋白质微阵列芯片
核酸微阵列芯片常以玻璃、硅和塑料作为基板材料,通过光引导原位合成技术[49]或物理递送技术制造高密度核酸阵列,其中,物理递送技术,如喷墨或微喷射沉积[50],可将纳升甚至皮升的溶液体积分配和点样到微阵列芯片的特定部位。微阵列芯片上检测探针与带有修饰的报告探针(如荧光、化学发光、放射性同位素等)结合,通过检测报告探针完成信号检测[51]。
与核酸微阵列芯片相同,蛋白质微阵列芯片的构建最初是直接将蛋白质点样在相关载体上。常用于制作蛋白质微阵列芯片的载体有硝酸纤维素膜、硅树脂、玻璃和塑料等[52]。载体的固定对蛋白质的生物活性和空间结构的维持有一定的影响。另外,常见的蛋白质微阵列芯片的制备工艺中通常只点样一种蛋白质,将多种蛋白质点样在一块微阵列芯片上的报道较少[53]。
4.1.2 微颗粒阵列芯片 微颗粒因其具有比表面积大、结合动力学快的特点而在生化分析中得到广泛应用[54]。与传统的平面微阵列芯片相比,微颗粒微阵列芯片利用其上的微颗粒可实现对生物分子的更快、更灵敏的检测[55]。同时,微颗粒微阵列芯片易实现多种蛋白质的固定[56]。
Zhu等[54]通过光聚合反应,以4-二甲氨基吡啶(4-Dimethylaminopyridine,DMAP)作为光引发剂,将掺杂DMAP和丙烯酰胺/双丙烯酰胺的溶液按照掩膜图案进行交联反应,形成微阵列芯片的微结构,并采用物理俘获法实现微颗粒在微阵列芯片上的填充,有效克服了静电自组装和电场辅助组装中微颗粒必须带电的问题。每块芯片上有40个凝胶垫阵列单元,每个单元外周均以聚乙二醇微柱作为亲水屏障,将试剂和样品限制在微阵列芯片上。他们利用该芯片初步实现了前列腺特异性抗原和人绒毛膜促性腺激素的免疫测定。Kim等[57]报道了一种微颗粒阵列芯片的加工工艺,即用停流光刻法进行微颗粒的加工,通过负压法实现微颗粒在阵列芯片上的填充。另外,他们还通过改变掩膜图案,制作出形状各异的微颗粒,并成功生成了防伪应用程序的二维粒子阵列代码。
微阵列芯片不存在气泡等问题带来的干扰,而且微阵列芯片上固定的靶标数量大、种类多。特别是微颗粒阵列芯片的出现,可使不同靶标分子固定于不同微颗粒上,再将这些微颗粒填充于相应区域,便于检测且不会产生干扰。微阵列芯片与SELEX技术的结合为发展新型适配体筛选技术提供了思路。
4.2 微阵列芯片SELEX在适配体筛选中的应用
4.2.1 基于溶胶-凝胶的微阵列SELEX技术筛选适配体 基于微阵列SELEX技术筛选适配体时,研究者将蛋白质靶标包裹于凝胶颗粒内,再点样于微阵列芯片上,可有效维持蛋白质的生物活性和空間结构。例如,Park等[58]将包裹有蛋白质的凝胶颗粒点样在微加热器上,在微混合器的作用下,先后在微阵列芯片上完成寡核苷酸文库与靶标分子的结合、洗涤和洗脱等过程。目前,利用该芯片可同时实现5种靶标分子适配体的筛选。
溶胶-凝胶颗粒已广泛用于大分子的捕获,但将其应用于小分子的捕获时仍存在一定挑战,原因在于,若将溶胶-凝胶设计为截留小分子,通常会损害溶胶-凝胶颗粒与常规基质(如微量滴定孔板聚合物)的粘附性[59]。Ahn等[60]基于阳极刻蚀技术和电化学工艺开发了一种多孔聚苯乙烯(PS)基质,该材料可有效锚定多种不同孔径的溶胶-凝胶颗粒(图4)。研究者将包裹双酚A的溶胶-凝胶颗粒固定在PS基质上,考察了基于溶胶-凝胶颗粒的微阵列芯片SELEX技术筛选双酚A适配体的可行性,为小分子适配体的筛选开辟了一条通用途径。
4.2.2 微阵列耦合微流控的SELEX技术筛选适配体 微流控芯片技术能较好地集成靶标分子与寡核苷酸文库的结合、洗涤和洗脱等筛选步骤,而微阵列芯片的超高通量的特点也有助于实现多个靶标分子适配体的同时筛选。因此,微阵列耦合微流控的SELEX技术在适配体筛选中具有更大的优势,可发挥更大的作用。
Liu等[61]发展了一种微阵列耦合微流控芯片的SELEX技术(Protein microarray integrated with a microfluidic chip,PMM-SELEX),用于筛选蛋白质的适配体(图5)。利用物理俘获法将靶标分子吸附在微阵列芯片的蛇形微通道上,在靶标分子与寡核苷酸文库结合后,通过微阵列芯片扫描技术检测靶标分子与寡核苷酸文库的结合情况。研究结果表明,PMM-SELEX技术省时、高效,仅需5轮筛选即可得到对乳铁蛋白具有较高亲和力(Kd=0.63 nmol/L)的适配体。
Gortrik等[62]通过将寡核苷酸文库固定在微阵列芯片上,筛选出多条适配体候选物,并通过微流控技术和高通量测序技术分别实现了适配体的分离与测序,克服了筛选过程轮次多、鉴定耗时等缺点。
适配体对(Aptamer pairs)可同时识别靶标分子不同表位,有助于增强检测的灵敏度和特异性[63]。然而,适配体对很难通过筛选得到,因为在常规筛选过程中会优先产生可识别显性“热点”表位的适配体,而热点表位适配体的确定,对另一表位的结合存在一定的阻碍作用[64]。Cho等[65]建立的基于微阵列芯片的适配体对筛选平台(Array-based discovery platform for multivalent aptamers process,AD-MAP)有效克服了这一问题,实现了适配体对的筛选(图6)。首先,通过微流控芯片分离结合与未结合靶标分子的寡核苷酸;然后,通过高通量测序获得适配体候选物的序列信息,并将这些适配体候选物点样在阵列芯片上;最后,通过平行亲和力检测获得与靶标分子亲和性最高的适配体,并将二者形成复合物,该复合物可有效阻断靶标分子上的主要结合位点。将复合物与微阵列芯片上的适配体候选物共同孵育,即可获得与蛋白质次要表位结合的适配体。他们通过AD-MAP平台筛选出了一对能识别人血管生成素2(Ang 2)不同表位的适配体,该适配体对具有较强的稳定性,即使在未稀释的血清中也能准确识别Ang 2的表位。
适配体的发展与筛选技术的进步密切相关,目前报道的适配体筛选技术各有优缺点,尚未形成一个标准化的模式。表1对磁珠SELEX、毛细管电泳SELEX、微流控芯片SELEX以及微阵列芯片SELEX的筛选轮次数、单轮筛选时间,以及各自优缺点进行了对比。
4.2.3 基于微流控及微阵列芯片SELEX技术的适配体筛选进程监测技术 适配体的筛选过程必须配合实时监测技术[66],从而有效地获得具有更高亲和力、更强稳定性的适配体。
表面等离子体共振(Surface plasmon resonance,SPR)通过适配体候选物与靶标分子结合引起的金属膜表面共振角的改变对SELEX筛选进程进行监测。虽然,利用SPR容易对适配体候选物与靶标分子的结合情况进行评估,但早期研究发现,大多情况下,第1轮筛选并未检测到SPR信号的变化[67],显然传统的SPR并不适于高通量检测。将金纳米颗粒引入SPR的局域表面等离子体共振(Localized surface plasmon resonance,LSPR)可有效增强SPR信号的输出。Gifford等[68]使用金纳米颗粒增强的SPR成像技术(Surface plasmon resonance imaging,SPRI)实现了PCR产物的高灵敏检测。与金纳米颗粒相比,银纳米颗粒可产生更强的共振信号,据此构建的“金核银壳”结构可更好地监测筛选过程[69]。Jia等[70]将微流控芯片和SPRI技术整合至SELEX过程中,利用十面体银纳米颗粒(Ag10)增强表面等离子体共振信号强度,完成了对乳铁蛋白的适配体的筛选,将检测信号提高了128倍。在后续的研究中,Jia等[71]利用十面体银纳米颗粒探针(Ag10-NPs-RP15)在实时监测SELEX过程的同时,消除了因靶标分子末端固定导致的其与适配体候选物亲和力降低的影响,筛选得到了脂质运载蛋白-1(Lipocalin-1)的适配体。
小分子与适配体分子量差异较大,两者亲和力的表征也是难点之一,目前尚无通用的表征方法。Ahn等[60]将包埋有BPA的溶胶-凝胶颗粒固定在微阵列芯片上,利用荧光素标记BPA适配体候选物,与小分子结合的适配体候选物无法从溶胶-凝胶颗粒中逃逸,从而可观察到颗粒的荧光。但是,这种荧光标记探针的方式对适配体的折叠有潜在影响,可能会进一步影响适配体与靶标分子的结合[72]。表征小分子与适配体亲和力的另一种方法是反向散射干涉术(Back scattering interferometry,BSI),即利用激光照射样品,光束在通道内被反射和折射,形成特定的条纹图案,并由电耦合器件(Charge coupled device,CCD)實现阵列检测。监测过程中,适配体和靶标分子均游离在溶液中,无需固定和标记。Kammer等[73]成功地将该技术用于抗生素(如替诺福韦、表阿霉素、氨苄青霉素和四环素)以及激素、神经递质等小分子与适配体的亲和力表征研究中。
5 總结与展望
近年来,适配体筛选技术有了长足的发展,但是,传统基于磁珠和毛细管电泳技术的SELEX方法存在筛选轮次多、筛选周期长和样品消耗量大、对小分子筛选效率低等问题。近几年,研究者利用微流控芯片和微阵列芯片的高通量、低样品消耗和易集成等特点,开发了基于微流控芯片和微阵列芯片的SELEX技术筛选适配体。然而,到目前为止,仅是将筛选环节中部分关键步骤(如分离和检测等操作单元)转移至芯片上,在芯片上并未实现所有适配体筛选环节。随着微纳米技术的发展,利用微流控芯片高集成和微阵列芯片超高通量的特点,未来SELEX技术的全部过程将有可能都在芯片上实现。因此,将微流控和微阵列芯片与高通量测序等技术结合,实现自动化筛选过程,将是适配体筛选工作的发展趋势之一。
适配体筛选技术可从以下几方面加强研究:(1)增加适配体筛选过程中的监测手段,如结合微阵列芯片点阵扫描技术,及时发现问题,并对筛选过程进行优化;(2)加强适配体与靶标分子结合的机理研究,结合靶标分子自身特点和结合位点的作用机制,合理设计适配体序列及结构,提高筛选成功率;(3)加快适配体数据库的建设,除适配体序列、亲和性和特异性等信息之外,也应该附有最新的筛选技术信息如微磁技术的改进等,为适配体的筛选提供理论指导;(4)努力建立通用型筛选模式,简化筛选过程,如利用微流控芯片易集成的特点,将进样、结合、洗脱、扩增和测序等技术集成于多块甚至是一块芯片上。可预见,随着新的分离技术、次级文库制备技术和监测技术的不断发展,适配体的筛选过程会变得更加快速、便捷和高效,而适配体也会在生物医学检测、靶向识别和疾病治疗等领域发挥更大的作用。
References
1 Li J,Fu H E,Wu L J,Zheng A X,Yang H H. Anal. Chem.,2012,84(12): 5309-5315
2 Jiang B,Li F,Yang C,Xie J,Xiang Y,Yuan R. Anal. Chem.,2015,87(5): 3094-3098
3 Leung K H,He B Y,Yang C,Leung C H,Wang H M D,Ma D L. ACS Appl. Mater. Interfaces,2015,7(43): 24046-24052
4 Ellington A D,Szostak J W. Nature,1990,346(6287): 818-822
5 Tuerk C,Gold L. Science,1990,249(4968): 505-510
6 Wang C,Liu B,Lu J,Zhang G,Lu A. J. Nanosci. Nanotechnol.,2014,14(1): 501-512
7 Ilgu M,Nilsen-Hamilton M. Analyst,2016,141(5): 1551-1568
8 Zhou J,Rossi J. Nat. Rev. Drug Discov.,2017,16(3): 181-202
9 Chang A L,McKeague M,Liang J C,Smolke C D. Anal. Chem.,2014,86(7): 3273-3278
10 Ozer A,Pagano J M,Lis J T. Mol. Ther-Nucl. Acids,2014,3(8): 183-200
11 Zhu C,Wang X,Li L,Hao C,Hu Y,Rizvi A S,Qu F. Biochem. Biophys. Res. Commun.,2018,506(1): 169-175
12 Sanchez J A,Pierce K E,Rice J E,Wangh L J. Proc. Natl. Acad. Sci. USA,2004,101(7): 1933-1938
13 Avci-Adali M,Paul A,Wilhelm N,Ziemer G,Wendel H P. Molecules,2010,15(1): 1-11
14 Costa G,Leamon J,Rothberg J,Weiner M. U.S. Patent Application. No.10/767,894. 2004
15 Xiao P,Lv X,Wang S,Iqbal J,Qing H,Li Q,Deng Y. Anal. Biochem.,2013,441(2): 123-132
16 Zhang J,Lv X F,Feng W,Li X Q,Li K J,Deng Y L. Microchim. Acta,2018,185(8): 364-371
17 Wang J,Rudzinski J F,Gong Q,Soh H T,Atzberger P J. PLoS One,2012,7(8): e43940
18 Hünniger T,Wessels H,Fischer C,Paschke-Kratzin A,Fischer M. Anal. Chem.,2014,86(21): 10940-10947
19 Han B,Zhao C,Yin J,Wang H. J. Chromatogr. B,2012,903: 112-117
20 Zhu C,Yang G,Ghulam M,Li L S,Qu F. Biotechnol. Adv.,2019,37(8): 9734-9750
21 Li Q,Zhao X,Liu H,Qu F. J. Chromatogr. A,2014,1364: 289-294
22 Luo Z,Zhou H,Jiang H,Ou H,Li X,Zhang L. Analyst,2015,140(8): 2664-2670
23 Manz A,Fettinger J C,Verpoorte E,Lüdi H,Widmer H,Harrison D J. TrAC-Trend. Anal. Chem.,1991,10(5): 144-149
24 Li R,Zhang X,Lv X,Geng L,Li Y,Qin K,Deng Y. Anal. Biochem.,2017,539: 48-53
25 Qin K,Lv X,Xing Q,Li R,Deng Y. Anal. Methods,2016,8(12): 2584-2591
26 Xu J,Lv X,Wei Y,Zhang L,Li R,Deng Y,Xu X. Sens. Actuators B,2015,212: 472-480
27 Zhang C,Lv X,Yasmeen S,Qing H,Deng Y. Anal. Methods,2017,9(24): 3619-3625
28 Yu L,Li X,Hu X,Yu S,Lv X,Li Q,Deng Y. 2015 8th International Conference on Biomedical Engineering and Informatics (BMEI),2015: 328-332
29 Li J L,Chang K W,Wang C H,Yang C H,Shiesh S C,Lee G B. Biosens. Bioelectron.,2016,79: 887-893
30 Xu Y,Yang X,Wang E. Anal. Chim. Acta,2010,683(1): 12-20
31 Lou X,Qian J,Xiao Y,Viel L,Gerdon A E,Lagally E T,Atzberger P,Tarasow T M,Heeger A J,Soh H T. Proc. Natl. Acad. Sci. USA,2009,106(9): 2989-2994
32 SOh S,Ahmad K M,Cho M,Kim S,Xiao Y,Soh H T. Anal. Chem.,2011,83(17): 6883-6889
33 Qian J,Lou X,Zhang Y,Xiao Y,Soh H T. Anal. Chem.,2009,81(13): 5490-5495
34 Huang C J,Lin H I,Shiesh S C,Lee G B. Biosens. Bioelectron.,2010,25(7): 1761-1766
35 Ahmad K M,Oh S S,Kim S,McClellen F M,Xiao Y,Soh H T. PloS One,2011,6(11): e27051
36 Bock L C,Griffin L C,Latham J A,Vermaas E H,Toole J J. Nature,1992,355(6360): 564-566
37 Green L S,Jellinek D,Jenison R,stman A,Heldin C H,Janjic N. Biochemistry-US,1996,35(45): 14413-14424
38 Stoltenburg R,Reinemann C,Strehlitz B. Biomol. Eng.,2007,24(4): 381-403
39 Gill I. Chem. Mater.,2001,13(10): 3404-3421
40 Livage J,Coradin T,Roux C. J. Phys.Condens.Mat.,2001,13(33): R673-R691
41 Pastor I,Ferrer M L,Lillo M P,Gómez J,Mateo C R. J. Phys. Chem. B,2007,111(39): 11603-11610
42 Kim Y Y,Chae S Y,Kim S,Byun Y,Bae Y H. J. Biomater. Sci. Polym. Edit.,2005,16(12): 1521-1535
43 Besanger T R,Easwaramoorthy B,Brennan J D. Anal. Chem.,2004,76(21): 6470-6475
44 Cho E J,Bright F V. Anal. Chem.,2002,74(6): 1462-1466
45 Rupcich N,Goldstein A,Brennan J D. Chem. Mater.,2003,15(9): 1803-1811
46 Ahn J Y,Jo M,Dua P,Lee D K,Kim S. Oligonucleotides,2011,21(2): 93-100
47 Bae H,Ren S,Kang J,Kim M,Jiang Y,Jin M M,Min I M,Kim S. Nucleic Acid Ther.,2013,23(6): 443-449
48 Huang C J,Lin H I,Shiesh S C,Lee G B. Biosens. Bioelectron.,2012,35(1): 50-55
49 Hughes T R,Mao M,Jones A R,Burchard J,Marton M J,Shannon K W,Lefkowitz S M,Ziman M,Schelter J M,Meyer M R. Nat. Biotechnol.,2001,19(4): 342-347
50 Okamoto T,Suzuki T,Yamamoto N. Nat. Biotechnol.,2000,18(4): 438-441
51 Jain K. Science,2001,294(5542): 621-623
52 Albala J S. Expert Rev.Mol.Diagn.,2001,1(2): 145-152
53 Butun S,Sahiner N. Polymer,2011,52(21): 4834-4840
54 Zhu Q,Trau D. Anal. Chim. Acta,2012,751: 146-154
55 Verpoorte E. Lab Chip,2003,3(4): 60N-68N
56 Kawaguchi H. Prog. Polym. Sci.,2000,25(8): 1171-1210
57 Kim J J,Bong K W,Retegui E,Irimia D,Doyle P S. Nat.Mater.,2017,16(1): 139
58 Park S M,Ahn J Y,Jo M,Lee D K,Lis J T,Craighead H G,Kim S. Lab Chip,2009,9(9): 1206-1212
59 Ressine A,Ekstrom S,Marko-Varga G,Laurell T. Anal. Chem.,2003,75(24): 6968-6974
60 Ahn J Y,Lee S,Jo M,Kang J,Kim E,Jeong O C,Laurell T,Kim S. Anal. Chem.,2012,84(6): 2647-2653
61 Liu X,Li H,Jia W,Chen Z,Xu D. Lab Chip,2017,17(1): 178-185
62 Gotrik M R,Feagin T A,Csordas A T,Nakamoto M A,Soh H T. Acc. Chem. Res.,2016,49(9): 1903-1910
63 Lao Y H,Peck K,Chen L C. Anal. Chem.,2009,81(5): 1747-1754
64 Fitter S,James R. J. Biol. Chem.,2005,280(40): 34193-34201
65 Cho M,Oh S S,Nie J,Stewart R,Radeke M J,Eisenstein M,Coffey P J,Thomson J A,Soh H T. Anal. Chem.,2014,87(1): 821-828
66 Tran D T,Knez K,Janssen K P,Pollet J,Spasic D,Lammertyn J. Biosens. Bioelectron.,2013,43: 245-251
67 Dausse E,Barré A,Aimé A,Groppi A,Rico A,Ainali C,Salgado G,Palau W,Daguerre E,Nikolski M. Biosens. Bioelectron.,2016,80: 418-425
68 Gifford L K,Sendroiu I E,Corn R M,Luptk A. J. Am. Chem. Soc.,2010,132(27): 9265-9267
69 Hobbs K,Cathcart N,Kitaev V. Chem. Commun.,2016,52(63): 9785-9788
70 Jia W,Li H,Wilkop T,Liu X,Yu X,Cheng Q,Xu D,Chen H Y. Biosens. Bioelectron.,2018,109: 206-213
71 Jia W,Lu Z,Yang H,Li H,Xu D. Anal. Chim. Acta,2018,1043: 158-166
72 Ruscito A,de Rosa M C. Front.Chem.,2016,4: 14
73 Kammer M N,Olmsted I R,Kussrow A K,Morris M J,Jackson G W,Bornhop D J. Analyst,2014,139(22): 5879-5884

