FAD 为辅基的葡萄糖脱氢酶发酵、纯化及酶学性质
林 荣, 宋祖坤, 张 玲, 王 男, 杨海麟
(江南大学 工业生物技术教育部重点实验室,江苏 无锡214122)
血糖水平是糖尿病临床诊断的主要和常规检测指标[1]。 葡萄糖氧化酶是葡萄糖检测试剂盒或葡萄糖传感器中应用最广泛的原料用酶,但其催化活性易受溶解氧的限制,会造成测量误差。 目前发现葡萄糖脱氢酶具有替代葡萄糖氧化酶的潜力,因其不以氧气为电子受体,不受溶解氧的限制,检测结果误差更小[2]。
葡萄糖脱氢酶按照辅基或辅酶类型可分为4类[3]: 1)以NADP+为辅酶的葡萄糖六磷酸脱氢酶(EC1.1.1.49 简称G6PDH); 2)以NAD+为辅酶的葡萄糖脱氢酶 (EC 1.1.1.47 简称NAD-GDH); 3)以PQQ 为辅基的葡萄糖脱氢酶(EC1.1.5.2 简称PQQGDH);4)以FAD 为辅基的葡萄糖脱氢酶(EC1.1.99.10简称FAD-GDH)。 G6PDH 和NAD-GDH 辅因子结合不紧密,催化过程中需要不断添加辅酶[4-5]。 PQQGDH 热稳定性差,底物谱较广[6],除葡萄糖外还能以多种单糖和二糖为底物, 限制其检测血糖的应用。FAD-GDH 具有热稳定性好、催化效率高、辅基结合紧密等优势,可作为替代目前诊断用葡萄糖氧化酶的首选。
FAD-GDH 主要来源于真菌[7],罕见于细菌。 真菌分泌FAD-GDH 较少,研究者主要研究其基因在Pichia pastoris和E.coliBL21 中的异源表达。杨愈峰等人将来源于土曲霉的FAD-GDH 基因在Pichia pastoris中进行表达, 通过表达筛选及15 L 发酵罐发酵,上清液酶活达2.6×105U/L[8],但在酵母菌中表达的异源葡萄糖脱氢酶存在糖基化修饰,会干扰血糖检测电极的灵敏度,实际生产应用中需进行酶的去糖基化步骤[9]。 周立伟等人筛选克隆出来源于青霉的FAD-GDH 基因,在E.coliBL21 中表达的蛋白质大部分为包涵体[10]。 来源于真菌的葡萄糖脱氢酶在大肠杆菌中异源表达常常需要与分子伴侣共表达才能实现可溶性表达,蛋白质纯化和放大生产较为困难。Koji Sode 等人发现并克隆了迄今惟一来源于细菌Burkholderia cepacia的FAD-GDH 基因,并研究了分子伴侣对酶表达的影响[11],但并未对其异源表达发酵生产、纯化和酶学性质做全面和深入研究。
作者将来源于Burkholderia cepacia的以FAD为辅基的葡萄糖脱氢酶基因[12]在E.coliBL21(DE3)中进行表达,选用工业生产上廉价的乳糖作为诱导剂,7.5 L 发酵罐放大培养,探索分离纯化工艺,研究其酶学特性,为其工业化生产及应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌 株 重 组E.coliBL21 (DE3)/pTrc99a-GDH:由作者所在实验室构建。
1.1.2 培养基 LB(g/L):酵母粉5,蛋白胨10,氯化钠5,加入2 g/dL 的琼脂为LB 固体培养基。
发酵培养基(g/L):酵母膏10,蛋白胨15,葡萄糖0.5, 甘油5 mL/L, 无机盐成分Na2HPO27.1,KH2PO42,K2HPO44,(NH4)2SO41.3,MgSO40.12,微量元素[11]。 培养基均添加过滤除菌的氨苄青霉素100 mg/L。
补料培养基(g/L):酵母膏50,蛋白胨50,甘油100 mL。
乳糖诱导液(g/L):乳糖200。
1.1.3 缓冲液 50 mmol/L 柠檬酸缓冲液(pH 4.0),50 mmol/L 醋酸缓冲液(pH 5.0),50 mmol/L 磷酸钾缓冲液(pH 6.0~7.0),50 mmol/L Tris-HCl 冲液(pH 8.0~9.0)。
1.2 方法
1.2.1 培养方法 种子液的制备:从平板挑取单菌落接种到LB 培养基,于37 ℃、200 r/min 摇床培养8 h。
7.5 L 罐发酵:7.5 L 发酵罐中加入4 L 培养基,115 ℃灭菌30 min,将活化的种子液按体积分数5%接入发酵罐分批培养,溶氧迅速上升,恒速0.04 L/h流加补料培养基10 h, 温度从37 ℃降到30 ℃,恒速0.015 L/h 流加乳糖诱导表达。 pH 通过自动流加50%的磷酸和25%的氨水控制在7.0,通过搅拌转速及通气量调节溶氧维持在30%[13]。
1.2.2 菌体生物量测定 取不同OD600的适量菌液,8 000 r/min 离心10 min 清洗两次,105 ℃烘干至恒定值,称取细菌干重,细胞干重与OD600成线性y=0.44x-0.036。
1.2.3 酶的分离纯化 8 000 r/min 离心5 min 收集菌体后,用pH 7.0、50 mmol/L 的磷酸钾缓冲液重悬菌体,冰水浴超声破碎菌体,破壁后8 000 r/min 离心10 min,上清液即为粗酶液。 利用融合在酶C 末端的组氨酸标签,将粗酶液分别过HisTrap HP(镍柱)、HiPre TM 26/10 Desalting(脱盐柱)和DEAE FF(阴离子交换柱层析柱),获得纯酶。
1.2.4 酶活测定 酶活定义:在一定条件下,每分钟还原1 μmol 2,6-二氯靛酚钠所需的酶量定义为一个酶活单位。
以葡萄糖为底物,取100 μL 适当稀释的酶液,加入3 mL 显色液(50 mmol/L 的磷酸钾缓冲液,pH 7.0,0.03 mmol/L 的2,6-二氯靛酚钠,1.6 mmol/L 的吩嗪硫酸甲酯,100 mmol/L 的葡萄糖溶液) 轻轻混匀,用重蒸水调零,37 ℃每隔1 分钟记录600 nm 处吸光值的变化,共记录2~3 min[7]。
比酶活为每毫克蛋白质具有的酶活力。 蛋白质质量浓度用考马斯亮蓝法测定[14]。
1.2.5 聚丙烯酰胺凝胶电泳 SDS-PAGE 凝胶电泳采用5 g/dL 的浓缩胶与12 g/dL 的分离胶, 电泳缓冲液为pH 8.3 的Tris-Gly 缓冲液, 当用电压80 V 跑过浓缩胶,调节电压至100 V,电泳后用考马斯亮蓝染色。 胶的具体配置操作方法参照SDS-PAGE试剂盒。
1.2.6 等电聚焦凝胶电泳 将蛋白质样品加入到加样纸上, 将加样纸排放在电极间的凝胶中央,恒压60 V 电泳15 min,8 mA 恒流至电压升至550 V,关闭电源,揭去加样纸,然后恒压550 V 电泳3 h,等电流降至接近零,停止电泳。 将胶在固定液中浸泡40 min,除去两性电解质(降低考马斯亮蓝对两性电解质的染色),用蒸馏水漂洗一次,然后用染色工作液染色。 胶使用GE 的预制胶。
1.2.7 葡萄糖脱氢酶酶学性质分析 将纯化得到的酶液取200 μL 进行300~500 nm 范围的全波长扫描, 再加入20 μL、1 mol/L 葡萄糖溶液反应5 min,再进行全波长扫描。
酶对不同糖类的催化差异: 分别选择葡萄糖、麦芽糖、木糖、半乳糖、海藻糖、果糖、山梨醇、蔗糖作为底物,加入0.1 U/mL 的酶液100 μL,以葡萄糖为底物测得的酶活为100%, 计算其它底物的相对酶活。
酶动力学参数测定:配置0.2~4 mmol/L 不同浓度的葡萄糖、麦芽糖、木糖溶液为底物,测定不同底物浓度下酶的活力,计算相应的反应速度。 用双倒数作图法(Lineweaver-Burk)作图,以1/[S]为横坐标,1/V为纵坐标,求得Km与kcat。
最适反应pH:在pH 5.0~9.0 条件下,于37 ℃测定酶活, 以酶活最高者为100%, 计算其相对活性,确定最适反应pH。
pH 稳定性: 将纯酶置于pH 5.0~9.0 不同缓冲液中,25 ℃下放置16 h,测定其剩余酶活力。
最适反应温度:以葡萄糖为底物,在pH 7.0 缓冲液中, 于不同温度(30、37、40、45、50、55、60、65、70、75、80 ℃)测定酶活,以酶活最高者为100%,计算其相对酶活,确定其最适反应温度。
温度稳定性:以葡萄糖为底物,在pH 7.0 缓冲液中,于不同温度(30、37、40、45、50、55、60、65、70、75、80 ℃)放置30 min 后,测定残余酶活。
2 结果与分析
2.1 7.5 L 罐发酵培养
相比真菌来源的FAD-GDH 在E.coli中可溶性表达困难,常常需要与分子伴侣系统共表达,细菌来源的外源基因在E.coli可实现可溶性表达, 且产量可进一步通过发酵优化提升。
IPTG 由于价格昂贵且存在潜在的化学毒性,限制了其在工业上的应用。 乳糖作为天然的诱导剂无污染, 价格便宜, 诱导强度相比IPTG 较小,可以减少包涵体产生,同时作为碳源还能促进菌体生长[13-14]。 作者选取乳糖作为诱导剂, 通过分批补料提高菌体浓度,再通过分阶段温度控制促进蛋白质表达[15]。
图1 为7.5 L 发酵罐培养。 发酵过程分为3 个阶段:第一阶段初始的营养物质大约在10 h 左右消耗完,此时溶氧上升。 第二阶段的补料开始,恒速0.04 L/h 流加补料培养基。在这一阶段400 mL 补料培养基大约10 h 内被消耗。将温度调到30 ℃,恒速0.015 L/h 流加乳糖诱导开始第三阶段,乳糖终质量浓度10 g/L。 酶活达到1 341 U/L,菌体量达12.4 g/L。

图1 7.5 L 罐发酵培养Fig. 1 7.5 L tank fermentation culture
2.2 酶的分离纯化
通过镍柱、脱盐柱、阴离子交换柱三步层析对粗酶液进行分离纯化。
重组酶的C 末端带有组氨酸标签, 见图2(a)。先经过镍柱纯化,去掉绝大多数的杂蛋白质,对目的蛋白质起到很好的浓缩效果,将这一步得到的酶液过脱盐柱去除多余的盐离子, 见图2 (b)。 再经DEAE 阴离子交换柱,见图2(c)。 紫外吸收峰较为明显,通过三步层析,获得纯化倍数为40、总回收率为40%的酶,分离纯化结果见表1。利用SDS-PAGE检验最终所得的蛋白质纯度,图2(d)显示最终样品呈现单一条带,说明该酶达到电泳纯。
DEAE 纯化时要求酶缓冲液的pH 高于酶的等电点,同时要求缓冲液盐离子浓度较低。 DNAMAN软件预测FAD-GDH 的等电点为6.71。 镍柱层析时使用的是pH 7.0 的磷酸钾缓冲液,经过脱盐柱层析缓冲液置换成pH 8.2 的Tris 缓冲液。DEAE 高盐洗脱及较高的缓冲液pH 条件可能抑制部分酶活性,这可能是造成该酶经过DEAE 纯化后比酶活及纯化倍数没有很大提升的原因。

图2 FAD-GDH AKTA avant 层析图谱及重组蛋白质纯化的SDS-PAGE 鉴定Fig. 2 Chromatogram of FAD-GDH by AKTA avant and SDS-PAGE analysis on purified protein

表1 蛋白质的纯化Table 1 Purification of protein
2.3 辅基FAD 的检测
全波长扫描结果见图3。 可以看出,FAD-GDH溶液在385 nm 和454 nm 左右有2 个特征吸收峰(实线),是由酶的FAD 辅基造成的,当加入足量的底物葡萄糖溶液,FAD 被还原成FADH2, 吸收峰消失(虚线),这些结果证明该葡萄糖脱氢酶的辅基是FAD。重组酶的氨基酸序列中含有一段FAD 结合位点的甘氨酸保守序列(GXGXXG),由此推测FAD 与酶非共价键结合。

图3 全波长扫描FAD-GDH 酶液Fig. 3 Whole-weight screen of FAD-GDH solution
2.4 酶学性质研究
2.4.1 酶的等电点 等电聚焦电泳见图4。 结果显示酶的等电点5.3,DNAMAN 软件预测的等电点为6.71,表明该酶的等电点偏酸性。对等电点的精确测量有助于提高分离纯化的效率及酶的稳定性。

图4 等电聚焦电泳图Fig. 4 Isoelectric focusing electrophoresis pattern
2.4.2 酶对不同底物的催化差异 为了研究酶对不同底物的催化差异,测定了酶对不同底物相对酶活及动力学参数。
对异源表达的FAD-GDH, 以不同糖类为底物测定相对酶活,结果见表2。除对葡萄糖外仅对麦芽糖具有较高的催化活性,可能是由于麦芽糖由两分子葡萄糖中间以α-1,6 糖苷键连接,水解产物为葡萄糖,对其他糖的催化活性较低,对果糖、山梨醇、蔗糖没有催化活性, 较好的葡萄糖催化特性使得FAD-GDH 有较好的工业化应用前景。

表2 FAD-GDH 对不同糖类的催化差异Table 2 Catalytic differences by FAD- GDH to different sugars
Km是酶的一个特征常数, 在一定反应条件下Km的大小与酶的浓度无关,只与酶的性质有关。 使用稀释成不同浓度的不同糖为底物进行酶活测定,得到的双倒数曲线见图5 和表3。 以葡萄糖为底物时,经米氏方程计算得到Km为2.56 mmol/L,相比麦芽糖和木糖,半乳糖的Km最小,其对葡萄糖的亲和力最高。 以葡萄糖为底物时,最大反应速度Vmax为500 mmol/(L·s),kcat/Km为3 487.7 L/(mmol·s)。

图5 FAD- GDH 催化不同糖的Lineweaver-Burk 关系Fig. 5 Lineweaver-Burk graph of FAD-GDH catalyze different sugars

表3 以不同糖为底物FAD-GDH 动力学参数Table 3 FAD-GDH kinetic parameters with different sugars as substrate
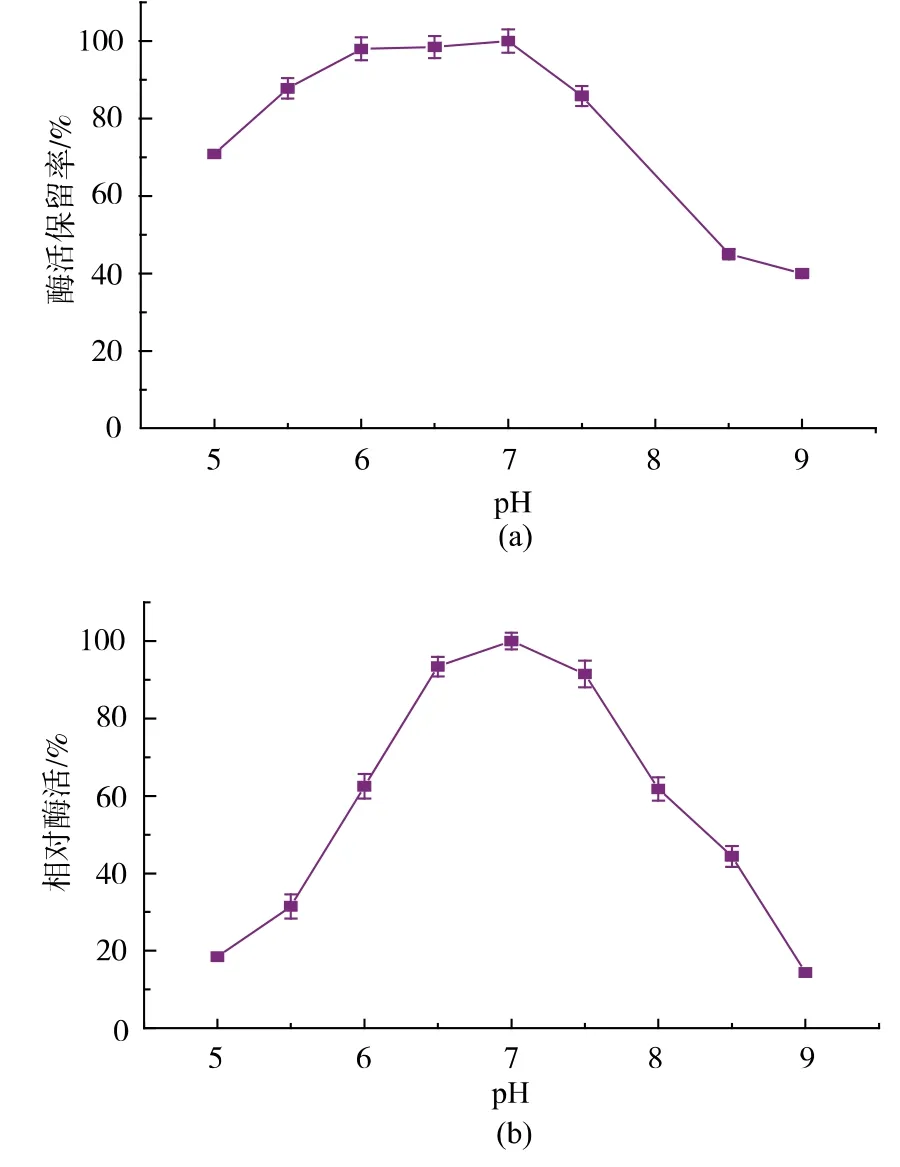
图6 酶的pH 稳定性及最适反应pHFig. 6 pH stability of the enzyme and the optimum reaction pH

?
2.4.3 酶pH 稳定性 反应体系的pH 会影响酶构象的稳定性,也会影响酶活性中心必需基团及底物的解离状态,进而影响酶的催化效果。 由图6 可知,酶的最适反应pH 为7.0, 重组酶在pH 为5.5~8.0时,具有较好的稳定性。 当pH 大于8.0 时酶活力迅速下降。 2.2 中蛋白质纯化过程中DEAE 阴离子交换层析使用的是pH 8.2 的Tris 缓冲液,过碱的条件可能抑制了酶的活性,所以纯化后比酶活及纯化倍数没有很大提升。
2.4.4 酶温度稳定性 温度升高导致溶液的扩散作用加剧, 一定程度上促使底物与酶分子的碰撞,使得反应速率加快。 温度的上升也会改变酶分子的构象,从而影响酶的催化效率。 温度过高使酶分子的结构被破坏,最终失去催化活性。 图7 显示,酶的最适反应温度在70 ℃,55 ℃以内稳定。 同时通过DSC 测定该酶的Tm值为77 ℃,该重组酶的热稳定性较好。

图7 酶的温度稳定性及最适反应温度Fig. 7 Temperature stability of the enzyme and the optimum reaction
3 结 语
作者利用乳糖诱导改善来源于Burkholderia cepacia葡萄糖脱氢酶表达水平,利用乳糖作为诱导剂在7.5 L 发酵罐放大,通过分批补料、分阶段温度控制,酶活达到1 341 U/L,菌体量达12.4 g/L。 酶活及菌体量可通过发酵优化进一步提升。
将重组菌破碎得到的粗酶液利用镍柱、 脱盐柱、阴离子交换柱三步层析,最终获得纯化倍数40、比酶活109 U/mg 的酶, 这一系列方法达到较好的纯化效果。 SDS-PAGE 凝胶电泳显示,重组蛋白质纯化后达到电泳纯,相对分子质量约60 000,与理论值相符。 等电聚焦电泳显示,该酶的等电点为5.3,与DNAMAN 软件预测的6.71 相比更加精确。 酶标仪全波长扫描吸收光谱表明, 该酶的辅基为FAD,通过保守位点(GXGXXG)推测辅基与酶非共价键结合。
酶学性质研究发现,该酶对葡萄糖的亲和力最高,Km为2.56 mmol/L,与报道的2.8 mmol/L[18]有所差异, 可能是因为文献中所用的表达宿主为E.coliDH5α,质粒为pUC18,与本研究中存在差异。 最大反应速度Vmax为500 mmol/(L·s),kcat/Km为3 487.7 L/(mmol·s)。 在pH 5.5~8.0 内稳定,最适反应pH 在7.0, 当pH 大于8.0 时酶活力迅速下降,55 ℃稳定,差式扫描量热分析(DSC)测得Tm值为77 ℃。
上述研究表明,该酶稳定性较好,催化效率高且不存在糖基化修饰, 适用于高灵敏度电极的开发,该细菌源葡萄糖脱氢酶具有替代市场上葡萄糖氧化酶的潜力。 本研究为该酶的进一步工业化应用提供参考与借鉴。

