PM2.5对角质形成细胞增殖、凋亡及对CCL20和核转录因子-κB表达的影响
李锦濯,林志鹏,曾倩文,孙仁山
大气颗粒物(PM)是空气动力学直径<2.5 μm的大气颗粒物,成分复杂,主要由重金属、多环芳烃、过敏原、内毒素等有害物质组成[1,2]。皮肤是机体抵御PM2.5的第一道屏障,皮肤长时间暴露在PM2.5中,PM2.5附着在皮肤表面,可以通过毛囊吸收[3],作用于皮肤细胞,引发多种生物学效应。流行病学研究表明PM2.5与多种皮肤病的发病率增加或症状加重相关[4,5],对银屑病、特应性皮炎、痤疮等炎症性皮肤病以及皮肤老化、皮肤肿瘤均有一定的影响[6],但是具体发生机制仍不明确。
既往关于PM2.5对皮肤损伤机制的研究认为颗粒物及其吸附的有毒物质可破坏皮肤屏障,对皮肤细胞具有直接毒性,造成细胞凋亡,同时可使皮肤细胞产生氧化应激反应、芳香烃受体活化及炎症级联反应等损伤效应[7,8]。角质形成细胞的表面受体识别外界环境危险信号,产生和分泌抗菌肽、趋化因子及多种细胞因子,进而趋化或激活其他免疫细胞,在皮肤天然免疫反应及多种炎症性皮肤病发病机制中发挥重要作用[9]。本文通过检测PM2.5刺激角质形成细胞株(HaCaT细胞)后细胞存活率、凋亡率、核转录因子(NF)-κB信号通路相关蛋白以及炎性因子CCL20可能的表达变化,旨在明确PM2.5对角质形成细胞的生物学效应和免疫调节功能改变,初步探讨PM2.5对皮肤的损伤作用及其可能机制。
1 材料和方法
1.1 材料
1.1.1 主要仪器 CO2细胞培养箱(美国Thermo 公司)、CFX Connect实时荧光定量聚合酶链反应(RTPCR)仪(美国BIO-RAD公司)、NanoDrop2000超微量核酸蛋白测定仪(Thermo)、流式细胞仪(美国BD公司)、全波长酶标仪(Thermo)、ChemiDoc™Touch化学发光成像系统(BIO-RAD)等。
1.1.2 主要试剂 DMEM 培养基、胎牛血清(美国Hyclone公司),CCK-8试剂盒(杭州联科生物),PE Annexin V Apoptosis Detection Kit(美国 BD 公司),RT-PCR引物(上海生物工程有限公司),SYBR Green 试剂盒(日本toyobo公司),RNA逆转录试剂盒(日本takara公司),酶联免疫吸附试验(ELISA)试剂盒(武汉Elabscience公司),NF-κB单抗(美国CST公司)等。
1.2 方法
1.2.1 PM2.5提取 PM2.5收集膜来自重庆市生态环境监测中心下面某监测站点。将载有PM2.5的滤膜剪成 0.5 cm × 0.5 cm 小块,置于离心管,加三蒸水超声振荡5 h。收集振荡液,过滤。滤液经真空冷冻干燥48 h,收集黑色絮状产物,放射性核素60Co 放射灭菌后存放于-20℃冰箱。称取适量PM2.5,超净台内紫外照射30 min,用无菌PBS配成10 mg/ml的储存液,存放于4℃冰箱。实验前用完全培养基稀释成不同浓度混悬液(25、50、100、200、400 μg/ml)。
1.2.2 细胞培养 HaCaT细胞(重庆市陆军军医大学防原教研室提供)。用含10%胎牛血清的DMEM培养基,在37℃,5% CO2条件下培养。每2~3 d换液1次,0.25%胰蛋白酶消化传代,取对数生长期细胞进行实验,细胞传代至3~5代内完成实验。
1.2.3 实验分组 HaCaT细胞按处理条件分为两组:对照组和实验组。对照组:PM2.5浓度为0 μg/ml。实验组:不同浓度PM2.5刺激,PM2.5浓度为25、50、100、200、400 μg/ml;每个 PM2.5 浓度组设了3个平行孔;不同时间PM2.5刺激,PM2.5浓度均为200 μg/ml。刺激时间为 1、3、6、、12、24 h,每个时间组设3个平行孔;实验均重复3次。
1.2.4 CCK-8法检测细胞存活率 不同浓度PM2.5刺激:细胞接种于96孔板,待细胞融合至80%左右,不同浓度PM2.5刺激24 h,弃培养基。PBS洗涤2次,加100 μl含l0%胎牛血清的DMEM培养基,加入10 μl CCK-8检测试剂,孵育2 h。使用全波长酶标仪在450nm模式下测定各孔吸光度值(A值)。不同时间PM2.5刺激:刺激浓度为 200 μg/ml,分别在1、3、6、12、24 h检测A值,方法同上。计算细胞存活率(%)=(实验组A-空白组A)/(对照组A-空白组A)×l00%。
1.2.5 流式细胞仪检测细胞凋亡 细胞接种于24孔板,不同浓度PM2.5刺激24 h后,收集细胞培养上清液及胰酶消化下来的细胞。40 μm的细胞滤网过滤,去除杂质,离心,弃液。4℃预冷的PBS冲洗2次,离心,弃液。1× staining buffer 重悬细胞,调整细胞浓度 1 × 106/ml。吸取 100 μl细胞悬液于 U 型底 96 孔细胞培养板,每孔加 1 μl PE Annexin V 和 1 μl 7-AAD 流式抗体,避光孵育 15 min。加 150 μl 1×staining buffer终止染色,1 h 内上机检测。
1.2.6 RT-PCR法检测CCL20 mRNA表达水平 细胞接种于6孔板,不同浓度PM2.5刺激24 h后,提取细胞内总RNA。按照逆转录试剂盒操作说明,逆 转 录 合 成 cDNA。SYBR Green法 检 测 CCL20mRNA表达水平。引物序列:GAPDH 上游引物:5'-ACCCAGAAGACTGTGGATGG-3',下游引物:5'-CAGTGAGCTTCCCGTTCAG-3';CCL20上 游 引物:5'-TGTGCGTCTCCTCAGTAAAA-3',下游引物:5'-CAAGTGAAACCTCCAACCC-3'。PCR运行程序:95℃ 3 min,95℃ 10 s,58℃ 5 s,72℃ 20 s,40 个循环。内参基因为GAPDH,采用2-△△CT法分析目的基因的相对量呈表达。
1.2.7 ELISA法检测CCL20分泌水平 细胞接种于12孔板,不同浓度PM2.5刺激24 h后,收集细胞培养液,离心,取上清,-20 ℃冰箱保存。采用ELISA试剂盒推荐的步骤,检测上清液中CCL20水平。
1.2.8 Western blot法检测NF-κB 信号通路相关蛋白细胞接种于6孔板,不同浓度PM2.5浓度刺激24 h后,每孔加入150 μl RIPA裂解液(含蛋白酶、磷酸酶抑制剂)裂解细胞获得蛋白质提取物。按照标准Western blot法上样、电泳、转膜、免疫反应、显影,比较GAPDH及NF-κB通路中p65、p-p65的表达水平。
1.3 统计学方法
采用Graphpad prism7软件进行统计分析,计量资料以均数±标准差 (±s)表示,组间比较采用单因素方差分析或t检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 PM2.5对HaCaT细胞存活率的影响
与对照组比较,刺激浓度为50、100、200、400 μg/ml各组细胞存活率明显降低,差异具有统计学意义(P<0.05),且刺激浓度越高,存活率越低(图1a);与对照组比较,刺激时间为3、6、12、24 h各组存活率明显降低,差异具有统计学意义(P<0.01),且刺激时间越长,存活率越低(图1b)。
2.2 PM2.5对HaCaT细胞凋亡率的影响
与对照组比较,刺激浓度为50~400 μg/ml各组细胞凋亡率显著增高(P<0.01),且随刺激浓度升高,细胞凋亡率逐渐增高(图2)。
2.3 PM2.5对HaCaT细胞表达CCL20mRNA水平的影响
与对照组比较,暴露于 50 ~ 400 μg/ml PM2.5浓度各组细胞内CCL20 mRNA表达水平显著升高(P<0.05),且随刺激浓度升高,mRNA表达水平逐渐增高(表1)。
2.4 PM2.5对HaCaT细胞分泌CCL20水平的影响
与对照组比较,刺激浓度为25~400 μg/ml各组细胞分泌CCL20水平显著升高(P<0.05);且随PM2.5刺激浓度升高,细胞分泌CCL20水平逐渐增高(表1)。
2.5 PM2.5对HaCaT细胞表达NF-κB蛋白水平的影响
随着PM2.5刺激浓度增高,细胞表达NF-κB p-p65蛋白水平逐渐上调。NF-κB p-p65是NF-κB信号通路中的关键蛋白,其表达上调,表明细胞内NF-κB信号通路激活(图3)。
表1 不同浓度PM2.5刺激下HaCaT细胞表达CCL20 mRNA和分泌CCL20水平 (±s)
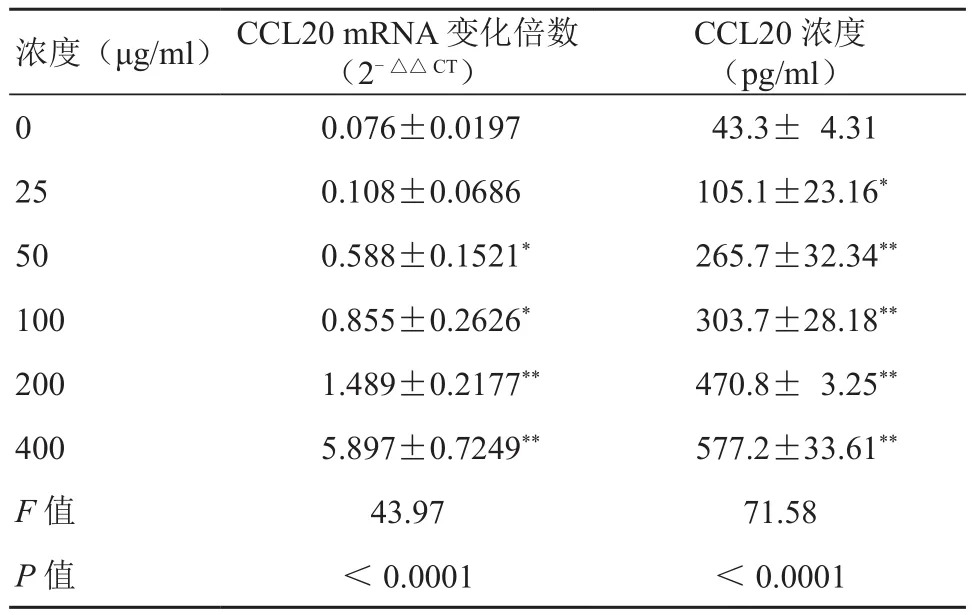
表1 不同浓度PM2.5刺激下HaCaT细胞表达CCL20 mRNA和分泌CCL20水平 (±s)
注:与对照组比较,*P<0.05,**P<0.01
浓度(μg/ml) CCL20 mRNA 变化倍数(2-△△ CT)CCL20 浓度(pg/ml)0 0.076±0.0197 43.3± 4.31 25 0.108±0.0686 105.1±23.16*50 0.588±0.1521* 265.7±32.34**100 0.855±0.2626* 303.7±28.18**200 1.489±0.2177** 470.8± 3.25**400 5.897±0.7249** 577.2±33.61**F值 43.97 71.58 P值 <0.0001 <0.0001
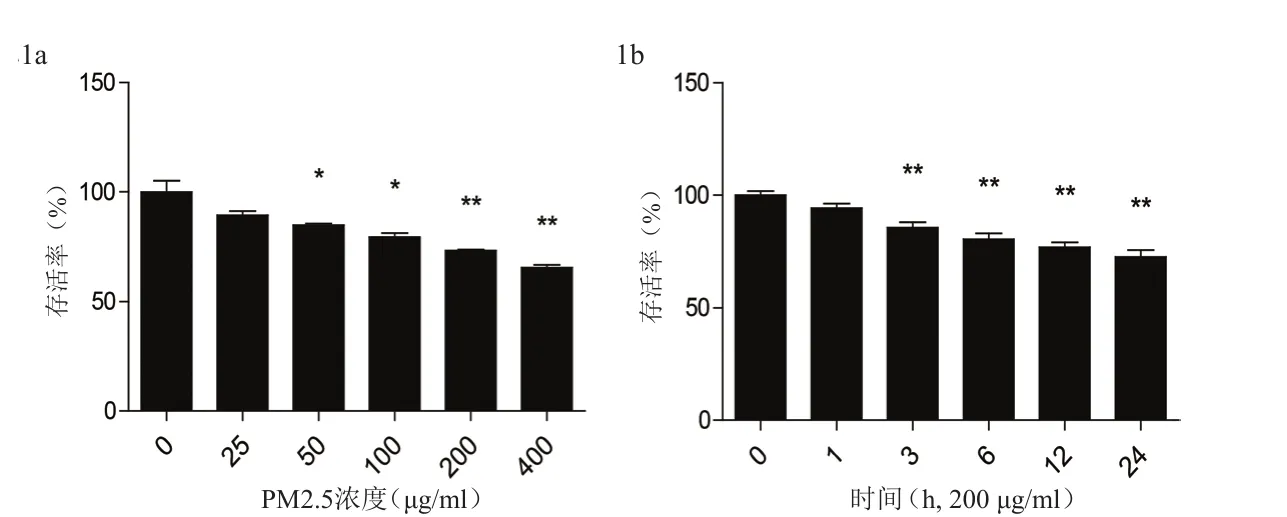
图1 不同浓度与时间PM2.5刺激下细胞存活率
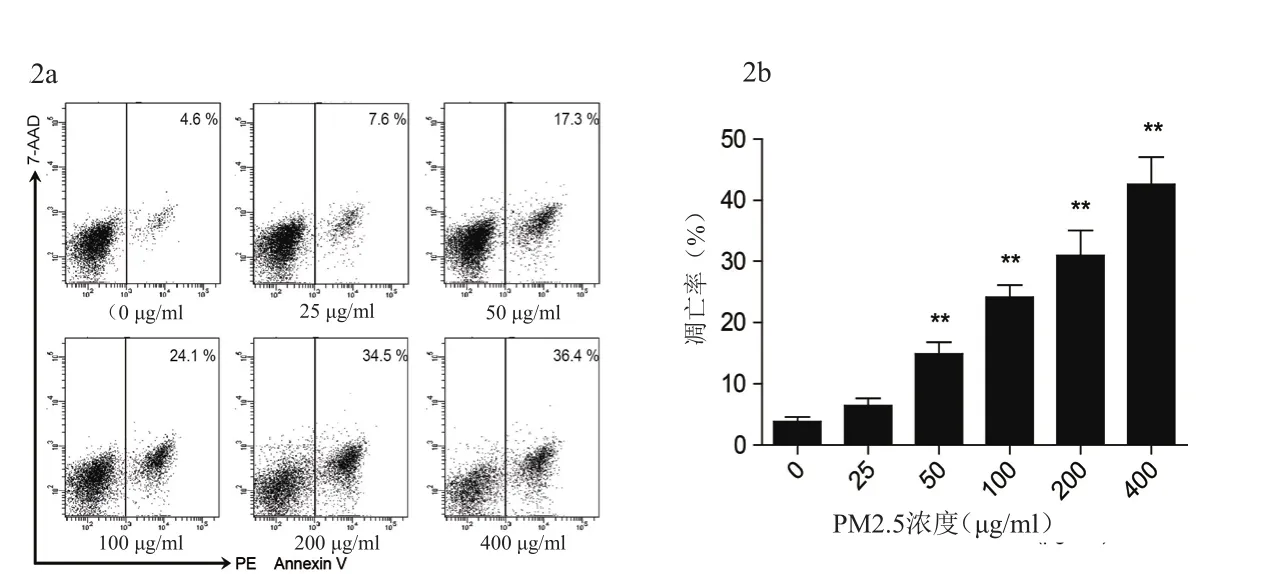
图2 不同浓度PM2.5刺激下细胞凋亡率
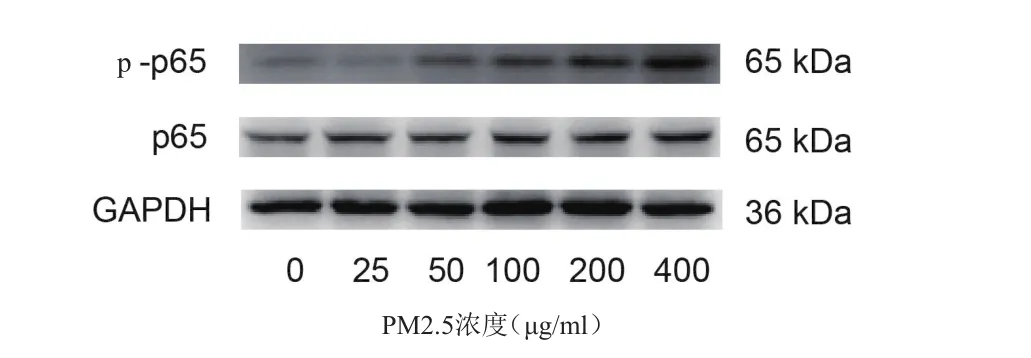
图3 不同浓度PM2.5刺激下细胞表达NF-κB蛋白水平
3 讨论
本研究揭示PM2.5诱导角质形成细胞内NF-κB p-p65蛋白上调。NF-κB是重要的转录调控因子,可以特异性结合多种基因启动子和增强子序列位点,调控白细胞介素(IL)-1、肿瘤坏死因子(TNF)、IL-6等多种重要的细胞因子及黏附分子、趋化因子、生长因子和免疫受体的表达[10]。NF-κB p-p65蛋白作为NF-κB信号通路中的一种关键蛋白,其表达上调,表明该信号通路激活,异二聚体p50-p65进入细胞核中与特定的κB位点结合,激活多种NF-κB靶基因,发挥转录调节作用[11]。上皮细胞中的NF-κB信号在调节上皮组织稳态以及在慢性炎症疾病的病理机制中具有重要作用[12]。
同时,PM2.5诱导角质形成细胞CCL20 mRNA表达水平及CCL20分泌水平上调,呈剂量依赖关系。CCL20是一种重要的趋化因子,细胞受体为CCR6。皮肤角质形成细胞分泌的 CCL20,通过趋化效应使CCR6+的树突状细胞,Th17细胞和γδT淋巴细胞向皮损区募集,参与银屑病的发病机制,CCL20在银屑病皮损区表皮基底层表达明显增多[13]。研究发现,使用CCL20单抗可以阻断CCR6+T淋巴细胞向皮损区的募集,进而显著减轻小鼠银屑病样皮损[14]。研究认为银屑病易感人群表皮角质形成细胞受到外在环境中毒素及微生物等刺激后,细胞内NF-κB信号通路激活及CCL20、IL-1等多种炎性因子表达增高,CCL20、IL-1等炎性因子通过募集树突状细胞并诱导其产生IL-23,进而导致Th17细胞的增殖与活化,并产生IL-17、IL-22等细胞因子,这些细胞因子反过来作用于角质形成细胞,又进一步导致角质形成细胞产生CCL20增多,最终形成恶性炎症循环,在银屑病的发病机制中发挥重要作用[15]。且研究发现角质形成细胞分泌的CCL20主要依赖于细胞内NF-κB信号通路的激活[16]。
既往关于PM2.5刺激角质形成细胞的研究发现,急性PM2.5暴露可诱导HaCaT细胞内胸腺基质淋巴细胞生成素(TSLP)、TNF-α、IL-1α、IL-8数种炎性因子的释放,可能与PM2.5增加湿疹发病风险有关[17]。文献报道急性PM2.5暴露可诱导HaCaT细胞内丝裂原活化蛋白激酶(MAPK)信号通路激活,进而介导一系列炎症反应[18]。Zhang等[19]研究发现PM2.5刺激后,HaCaT细胞中的NF-κB和核苷酸结合寡聚化结构域样受体蛋白3(NALP3)炎症体信号转导被激活,进而诱导炎症反应。Zhang等采用蛋白微阵列芯片检测NF-κB蛋白,而本研究采用Western blot法检测NF-κB p-p65蛋白水平,结果一致,均显示PM2.5刺激角质形成细胞导致细胞内NF-κB信号通路被激活。这些研究结果均表明角质形成细胞受PM2.5刺激后细胞内炎症相关信号通路激活,促炎细胞因子产生增多。
本研究结果还显示PM2.5刺激角质形成细胞导致细胞存活率降低,凋亡率增加。这与薛晨红等[20]研究结果基本一致,认为PM2.5对HaCaT细胞产生细胞毒性,导致细胞形态改变,抑制细胞增殖,诱导细胞S期阻滞,并促进细胞凋亡。
本研究结果表明,PM2.5可降低角质形成细胞存活率,促进细胞凋亡,且可能通过激活NF-κB信号通路诱导角质形成细胞内细胞因子CCL20的表达上调,进而介导多种慢性皮肤炎症反应,具体机制仍有待进一步研究。

