外周血免疫及炎性指标与下肢动脉硬化严重程度相关性分析
王子豪 胡何节 方征东 王晓天 孙小杰 葛新宝 程 灿
安徽医科大学附属省立医院血管外科,安徽 合肥 230001
闭塞性动脉硬化(arteriosclerosis obliterans,ASO)是一种全身性疾病,国外超过75 岁人群中ASO 发病率近20%,中国老年群体中发病率超过10%,随着社会老龄化阶段进展,其趋势仍在不断升高[1]。当ASO 涉及腹主动脉及其远侧主干动脉时,引起下肢慢性缺血,称为下肢动脉硬化症(lower extremity atherosclerosis disease,LEAD)。LEAD 的发生受不同因素影响,包括环境、饮食或基因等。其发病机制至今仍不完全明确,涉及不同假说,包括脂代谢紊乱、内膜损伤[2]、血流剪切力等。随着研究不断进展表明,在动脉硬化的发生及发展中,免疫的作用始终贯穿其中。调节性T 细胞(regulatory T cells,Treg)与调节性B 细胞(regulatory B cells,Breg)是一种起负性调节作用的免疫细胞,Treg 数量的高低与局部动脉硬化的进程呈负相关性[3],外周血中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR),是易获得的一项数据。本研究探讨LEAD 患者外周血免疫功能及炎性指标与LEAD 严重程度的相关性,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年1月至2019 年8月就诊于安徽医科大学附属省立医院的LEAD 患者45例,按照疾病临床严重程度,将其分为间歇性跛行组(Rutherford 1~3 级)24例,严重肢体缺血组(Rutherford 4~6 级)21例,临床分级参考Rutherford分级[6]。排除ABI >1.0、明确诊断的活动性感染、自身免疫性疾病、血液病、接受慢性免疫治疗及激素治疗、肝肾功能不全、4 周内出现心梗及脑卒中的患者。
1.2 方法
入院患者根据其临床症状进行Rutherford分级,分级由2 位医师进行,如出现差异则请第3 位医师进行评定。记录入院患者性别、年龄、有无吸烟史及饮酒史,有无高血压、糖尿病、冠心病、脑梗塞病史。患者入院完善并记录其白细胞计数、肌酐、尿酸、中性粒细胞绝对值、淋巴细胞绝对值、单核细胞绝对值,并由此计算NLR,抽取患者晨起空腹血2 ml,采用流式细胞术测定其外周血Treg/CD4+T 细胞及Breg/B 细胞。
1.3 统计学方法
采用SPSS 21.0 软件进行统计学分析,计量资料以(±s)表示,组间比较采用独立样本t检验;计数资料以n(%)表示,采用χ2检验;Breg/B 细胞和NLR 采用四分位间距M(P25,P75)表示,组间比较采用非参数曼-惠特尼U 检验;相关性采取Pearson相关分析,单因素分析显示有意义的纳入Logistic回归分析,P<0.05 时为差异有统计学意义。
2 结果
2.1 一般资料比较
45例LEAD 患者,男性35例,女性10例。两组患者一般临床资料比较,差异无统计学意义,见表1。
2.2 免疫功能比较
间歇性跛行组患者外周血Treg 细胞/CD4+T 细胞、Breg 细胞/B 细胞均高于严重肢体缺血组患者,NLR 低于严重肢体缺血组患者,差异有统计学意义(P<0.05,表2)。
2.3 患者外周血免疫细胞与Rutherford分级相关性分析
Treg/CD4+T 细胞与LEAD 患者Rutherford分级无相关性(r=-0.263,P=0.093),NLR 与LEAD 患者Rutherford分级呈正相关(r=0.357,P=0.016),Breg/B 细胞与LEAD患者Rutherford分级呈负相关(r=-0.297,P=0.047)。
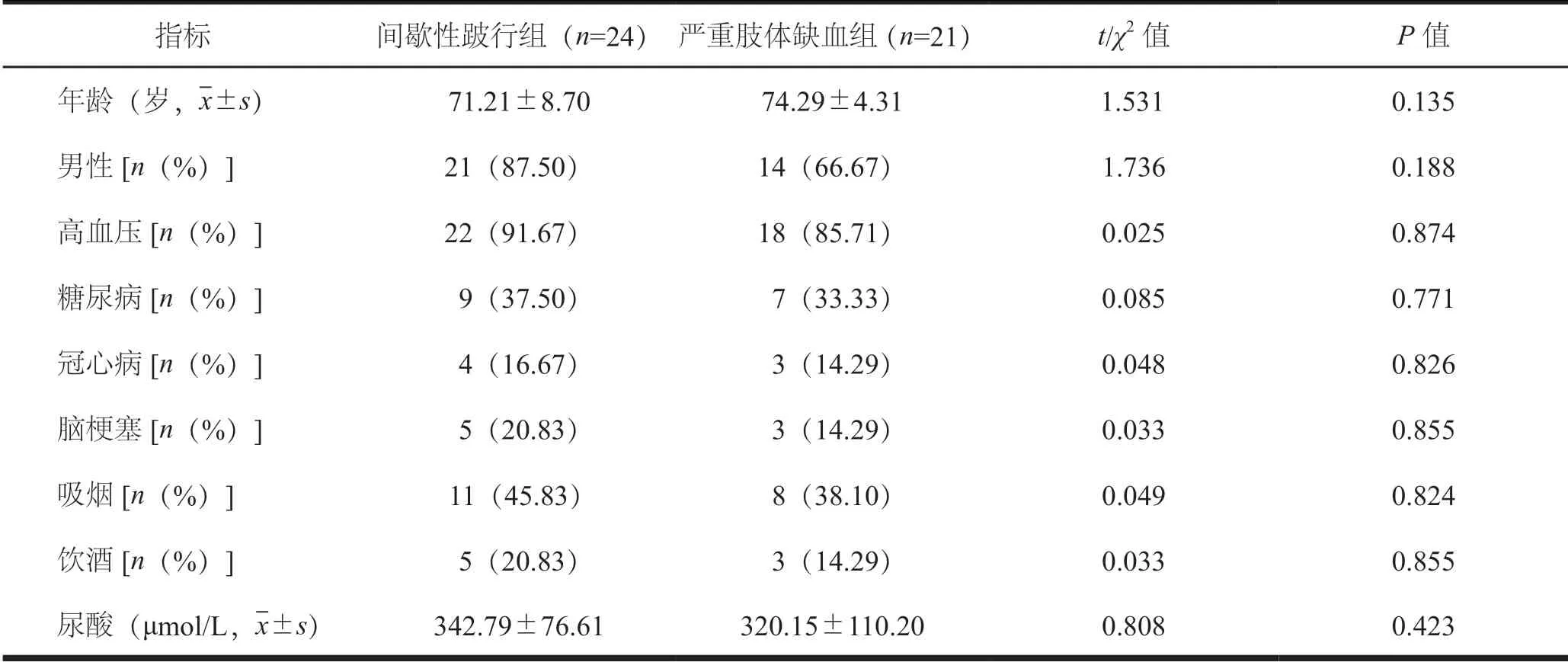
表1 两组患者一般临床资料比较
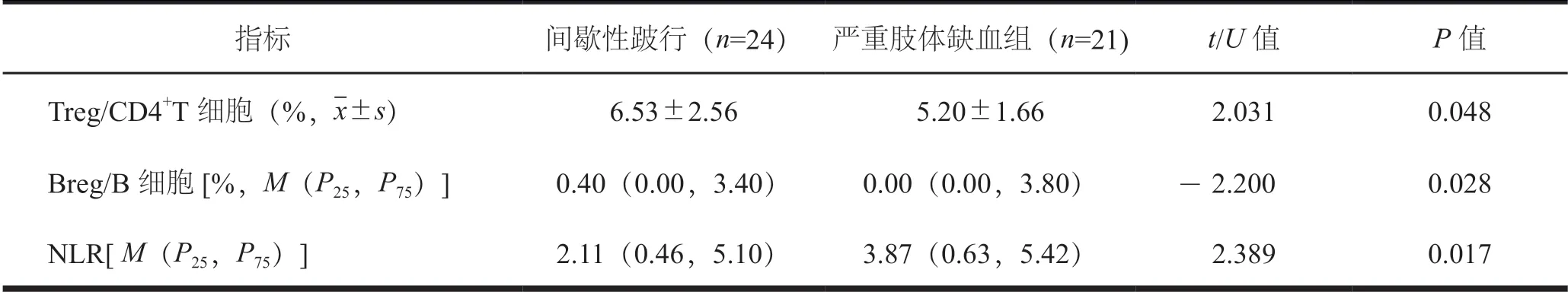
表2 两组患者外周血免疫细胞比较
2.4 严重下肢缺血多因素分析
NLR 是LEAD 患者独立危险因素,见表3。
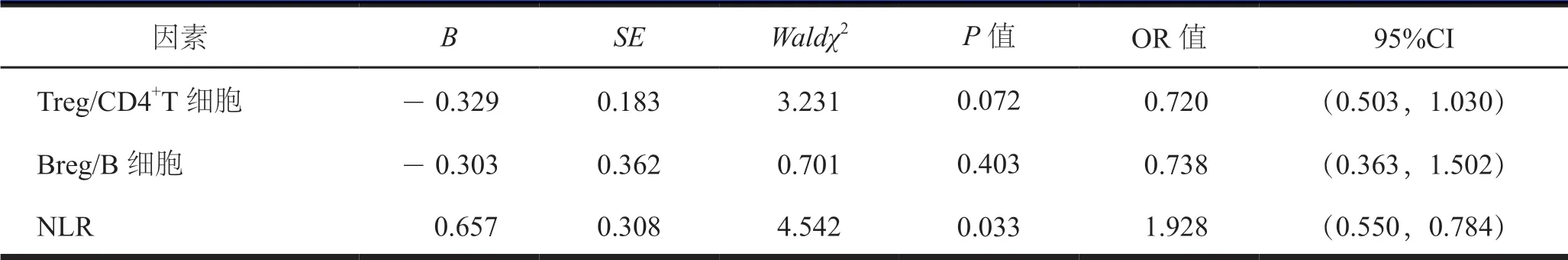
表3 严重下肢缺血多因素Logistic 回归分析
3 讨论
动脉粥样硬化是一种进行性疾病,随疾病逐步进展,会诱发一系列诸如冠心病、脑卒中、外周血管病变的血管相关疾病。LEAD 通常早期症状不明显, 随疾病阶段进展,逐渐出现皮肤发凉、感觉异常、间歇性跛行, 继则出现静息痛、皮肤营养障碍, 甚至溃疡、坏疽, 最终导致截肢甚至危及生命[1]。当累及下肢动脉且具有静息痛(2 周以上)、破溃时,称为严重肢体缺血(critical limb ischemia,CLI)。研究证实,动脉粥样硬化不仅仅是动脉壁内脂质堆积的结果,血管损伤后所导致的一系列慢性炎性反应及免疫反应,包括固有免疫和特异性免疫,对其的发生发展亦起着重要作用。通常认为,当血管壁脂质堆积或动脉壁损伤后,会触发固有及特异性免疫。单核/巨噬细胞、中性粒细胞、T 淋巴细胞和B 淋巴细胞是动脉粥样硬化的主要参与者。本研究显示外周血中中性粒细胞、Treg及Breg 变化与动脉硬化严重程度有关系。
Treg 被认为是一种免疫调节细胞,通过TGF-β, IL-10, IL-35 等抗炎因子以及细胞接触起抑制作用,人类动脉粥样硬化斑块中约包含1%~5%具有抗动脉硬化功能的Treg[10],在小鼠模型中,诱导Treg 生成可抑制动脉粥样硬化的发展,而Treg 的耗竭则可加速动脉粥样硬化的发展[11]。研究表明,健康患者与动脉硬化患者外周血Treg表达比例不同[4],本研究发现,外周血Treg 比例在间歇性跛行患者与CLI 患者存在显著差异,间歇性跛行患者外周血Treg 百分比显著高于CLI 患者,说明随疾病进展,Treg 进一步耗竭,患者体内细胞免疫调节失调,导致免疫功能紊乱可能是LEAD 加重的因素之一。
Breg 存在于脾脏中,约占B 细胞总数的不到1%,具有免疫调节特性,且有助于激活Treg[15]。Breg 通过在其表面分泌抗炎因子IL-10、转化生长因子(TGF)-β、促凋亡因子和IgM 抗体来促进免疫抑制。研究表明,在Apoe—/— 小鼠中,调节性B 淋巴细胞的减少伴随着IL-10 的减少和主动脉动脉粥样硬化程度的增加[13]。此外,使用中和抗体抑制IL-10,或移植IL-10 缺陷的B 淋巴细胞,均可消除Breg 的抗动脉粥样硬化作用[14]。我国关于外周血中Breg 与动脉硬化的研究较少,大多集中于与肿瘤及自身免疫性疾病关系的研究上。本研究表明,外周血Breg 比例在间歇性跛行患者与CLI 患者存在显著差异,且与LEAD 患者Rutherford分级呈负相关,说明在LEAD 的进程中存在全身体液免疫失调,且与上述小鼠研究结果相一致。
中性粒细胞是公认的急性炎性反应的第一道防线,但在动脉粥样硬化的病理生理中,其作用往往被忽视。近年来对动脉粥样硬化机制的研究进展表明,中性粒细胞是动脉粥样硬化形成的重要因素之一。中性粒细胞是通过某些趋化因子,特别是由活化的血小板产生的趋化因子,参与到动脉粥样硬化病变中来的。其首先与选择素、整合素等相互作用, 以使单核细胞在动脉硬化病变处聚集,此外,这些蛋白可以激活巨噬细胞,并促进泡沫细胞的形成[7]。因此,中性粒细胞绝对值可以作为评定动脉硬化严重程度的衡量指标,但单一纳入中性粒细胞绝对值易受感染、机体脱水等因素影响,因此中性粒细胞与淋巴细胞比值作为一种组合型炎性标志物,整合了细胞及体液免疫两种途径,一定程度上回避了单一指标的劣势。现已有研究证明,NLR 对于动脉硬化性脑梗死有着积极的评估作用,且与颈动脉的狭窄程度呈正相关[8],高血压人群中动脉硬化患者与非动脉硬化患者外周血NLR 不同[5]。本研究发现,NLR 与LEAD 患者Rutherford分级呈正相关,患者临床症状愈严重,其NLR 值愈高,结合Treg 及Breg与LEAD 严重程度关系可知,当患者临床症状越重,机体炎性反应越大,这一结果与NLR 与颈动脉硬化结果相一致。回归分析提示NLR 是LEAD 患者发展为CLI 的独立危险因素,提示炎性反应始终存于LEAD 患者疾病各个阶段,炎性反应的进一步加重及免疫调节的进一步失调促进了LEAD 患者疾病的进展,NLR 对于LEAD 疾病的转归起到一定预测作用。有研究表明,对高炎性反应的患者进行卡那单抗治疗,有效降低了其心脑血管意外事件再发的风险[9]。因此,针对中性粒细胞参与动脉粥样硬化的发病机制为动脉硬化的治疗提供了新思路,但目前没有研究证实抗炎治疗能显著减轻下肢动脉缺血或减慢抑制下肢动脉粥样硬化进程。此外,应该注意的是,LEAD 患者常合并下肢破溃处的局部感染,抑制中性粒细胞功能的策略必须谨慎使用,以免产生任何严重的不良影响。
综上所述,LEAD 患者疾病进程中存在着全身免疫调节紊乱及慢性炎性反应。随疾病严重程度增加,免疫功能紊乱及炎性反应会进一步加重,Treg 及Breg 的降低可能对LEAD 的进一步加重起着重要作用,未来治疗LEAD可以从免疫调节及炎性反应控制上切入,但需注意治疗所带来的不良反应。

