基于气相离子迁移谱研究肺隐球病患者呼出气中特征挥发性有机物
王 彤,曾沛荧,王明蝶,李征途,李 雪,霍羽佳,张志娟,4*,叶 枫*
(1.暨南大学 质谱仪器与大气环境研究所,广东 广州 510632;2.广州医科大学附属第一医院,广州呼吸健康研究院,呼吸疾病国家重点实验室,国家呼吸系统疾病临床医学研究中心,广东 广州 510120;3.山东海能科学仪器有限公司,山东 德州 251500;4.河南中医药大学 药学院,河南 郑州 450046)
肺隐球菌病(Pulmonary cryptcoccosis,PC)是由新型隐球菌引起的一种急性、亚急性或慢性深部真菌感染,已成为目前常见的感染性疾病[1]。近年来,肺隐球病的发病率逐年升高,其临床诊断的难点在于临床表现无特异性[2],且处于不同免疫状态下患者的表现也各不相同。目前,肺隐球菌病的诊断方法主要有影像学检查、标本培养检查以及传统织病理学检查等,其中影像学检查是诊断肺隐球病患者的重要方法,但受到宿主免疫状态影响,如免疫功能正常的宿主影像表现和肺癌患者相似,易误诊成肺癌;标本培养(如痰标本、咽拭子等)检查易出现假阳性,耽误患者治疗时间;传统的组织(如肺泡灌洗液、肺部组织等)病理学检查一直是肺隐球病检查的“金标准”,但其获取肺泡灌洗液过程中会对患者造成身体上的创伤[3-4]。呼气诊断具有快速简单、非入侵性、无创无痛、样本采集不受限制、样本前处理简单等优点,在肺部真菌感染疾病领域的应用逐渐引起关注。如Chambers等[5]采用固相微萃取/气相色谱-质谱联用(SPME/GC-MS)法靶向检测烟曲霉患者呼气和烟曲霉菌株中的VOCs,发现2-戊基呋喃同时存在于患者呼气和菌株中,但后期研究发现辣椒中也能检出2-戊基呋喃[6];Koo等[7]同样采用SPME/GC-MS方法检测烟曲霉患者呼气和烟曲霉菌株中的15种VOCs,发现α和β-反式佛手柑油烯、β-朱栾样倍半萜烯、反式香叶基丙酮同时存在于人体呼气和菌株中。由此可见,呼气标志物有可能受到饮食干扰,在呼气采集时应充分考虑相关影响因素;其次,采用多种VOCs组合的方式,可能会提高呼气诊断的灵敏度和特异性。肺隐球菌同样属于肺部真菌感染类疾病,但目前尚未见肺隐球菌呼气中VOCs成分的研究。因此,研发肺隐球菌病非侵害性诊断方法具有重要的临床意义。
气相色谱-离子迁移谱(GC-IMS)可实时在线分析呼气中醛、酮、醇等化学性质活泼的有机化合物,减少离线采样造成的呼气样本中化学性质活泼成分的损失,且样品分析时间短,单个样品仅需10 min,操作简单,适用于临床诊断。GC-IMS[8]包括GC和IMS两个部分,样品中各化合物因物理化学性质不同在GC色谱柱中流出时间不同,从而实现预分离,预分离后的化合物在电离区被电离为离子,进入离子迁移管中进一步分离。如Allers等[9]采用GC-IMS检测慢性肺阻塞患者的呼气,筛查出3种VOCs在慢性肺阻塞患者与健康对照呼气中存在显著区别。Lewis等[10]发现GC-IMS有望用于细菌性呼吸道感染的早期诊断中,可避免病因不明确而造成抗生素滥用。由此可见,GC-IMS在人体呼吸道疾病的呼气诊断中表现出色,具有良好的应用前景。基于此,本文采用GC-IMS分析肺隐球病患者呼气中的VOCs,并通过与肺曲霉病患者和健康对照组呼气中VOCs比较,研究肺隐球病患者呼气VOCs与曲霉病患者及健康人群等对照组的差异性,筛选出肺隐球病患者呼气中的特征VOCs。
1 实验部分
1.1 仪器与试剂
BreathSpec GC-IMS气相色谱离子迁移谱(德国G.A.S公司);Milli-Q超纯水系列(美国Millipore公司);二壬酮、二辛酮、二庚酮、二己酮、二戊酮、二丁酮6种标准液体,使用6种标液的顶空气作为标气(J&K Chemicals);氮气(99.999%,广州英莱气体有限公司)。
1.2 受试者基本信息
受试者呼气样品采集于广州医科大学第一附属医院呼吸科,采集时间为2018年4月3日至2018年6月4日,肺隐球病患者和肺曲霉病患者均为经美国隐球菌诊治指南[11]和美国感染协会(IDSA)制定的曲霉诊治指南[12]临床确诊的患者;对照组为肺部未感染的健康受试者和确诊的肺曲霉病患者。受试者共纳入肺隐球菌患者20例、肺曲霉病患者28例、健康组33例,其基本信息见表1。分析呼气样品时,同时分析环境空气样品作为背景对照。
1.3 样品采集

表1 受试者基本信息表Table 1 Basic information of the subjects
*Smoking:subjects with smoking habits during breath test;Quit:subjects who had quit smoking during breath test;Never:subjects who never smoke
呼气样本采样前,受试者采用鼻吸口呼的方式深呼吸3次,再用鼻子深吸一口气,屏息10 s后开始吹气[13],吹气方式如图1所示,受试者呼出气中的前半段(约5 s)将管路中的废气吹出,后半段(约5 s)采集至1 mL的定量环中,随后进入检测器。由于人体呼出气中含有大量水蒸气,温度约为35~37 ℃,为防止人体呼气中的水蒸气冷凝,造成呼气中VOCs组分损失[14],呼气将通过40 ℃恒温的保温管进入GC-IMS。环境样本采集方法:利用仪器内部的采样泵,和呼气样本采集方式保持一致,通过保温进样管路直接抽取环境空气样本,进样速率10 mL/min。

图1 人体呼气采集-分析示意图Fig.1 Schematic diagram of human breath sampling and analysis using GC-IMS
1.4 呼气采集的质量控制
(1)每天早上07∶00开始采集受试者的呼吸气,为了排除牙膏和口腔气味的干扰,要求受试者无需刷牙,清水漱口后开始吹气。(2)受试者吹气前需静坐0.5 h,避免因剧烈运动造成呼气中异戊二烯浓度升高[15]。(3)由于饮食会造成呼气中丙酮等VOCs含量变化[16],因此呼气采集前一天要求受试者在19∶00之后禁食且不得饮用清水之外的饮品。(4)由于吸烟会造成呼气中乙腈含量明显升高,饮酒会造成呼气中乙醇含量短时间内升高[17],为避免这些干扰,采样前一天受试者禁止吸烟饮酒。(5)为避免辣椒影响呼气中2-戊基呋喃含量[6],要求受试者在吹气前24 h内不要食用辣椒。(6)同时收集受试者年龄、性别、病史、近3天饮食状况等信息。(7)所有受试者呼气样品均需采集3个平行样以及一个环境样比对。
1.5 分析条件
本研究采用商品化的BreathSpec GC-IMS在线分析系统进行呼气检测[18],MXT-200 GC色谱柱(3 000 mm×0.53 mm,膜厚:0.50 μm),正离子模式检测,离子迁移管管长98 mm,电压6 500 V,离子源:氚源,电离方式:软化学电离。漂移气:氮气(N2,纯度≥99.999%),漂移气流速:150 mL/min。
GC-IMS校准:使用二壬酮、二辛酮、二庚酮、二己酮、二戊酮、二丁酮的标准液体配成质量浓度为50 μg/L的混标溶液,取标液的顶空气进样,将结果的迁移时间和保留时间与数据库进行校准。
1.6 数据分析
使用GC×IMS Library Search和LAV 2.0.0软件(Laboratory Analytical Viewer,德国G.A.S公司,仪器自配)分析受试者呼气VOCs。利用软件内置的NIST和IMS数据库,通过匹配离子迁移时间和保留时间进行定性分析。谱图中的每个特征峰代表1种挥发性有机物,手动框选出特征峰所在区域,以归一化之后的该特征峰区域的相对强度作为参数变量进行后续数据分析。
将已获取的化合物信息根据肺隐球病、肺曲霉病和健康对照组进行分类,再用SIMCA软件(Version 14.1 MKS Umetrics)建立正交偏最小二乘判别分析(OPLS-DA)模型,将获取的高维数据进行降维处理[19],并计算OPLS-DA模型中检查因子的VIP值,基于VIP≥1.0的标准[20],筛选出一组肺隐球菌患者的特征性VOCs。
2 结果与讨论
2.1 受试者呼出气中VOCs的定性
经标准品分析校正,基于NIST和IMS数据库,在肺隐球病患者、肺曲霉病患者和健康对照组呼气中共检出19种VOCs(表2),包括6种酮类(丙酮、4-甲基-2-戊酮、2-丁酮、2-戊酮、2,3-戊二酮、3-戊酮)、2种醇类(辛醇、乙醇)、3种醛类(2-甲基-1-丙醛、丁醛、己醛)、2种酯类(乙酸乙酯、己酸乙酯)、3种烯烃(柠檬烯、β-蒎烯、苯乙烯)、2种芳香烃(吡啶、异丙苯)和1种含氮六元杂环化合物(1,8-桉树脑)。除去柠檬烯外有18种化合物与之前的肺曲霉病呼气研究的靶向物质不重合,因此实验进一步扩充了肺曲霉病呼气研究的挥发性有机化合物谱库。
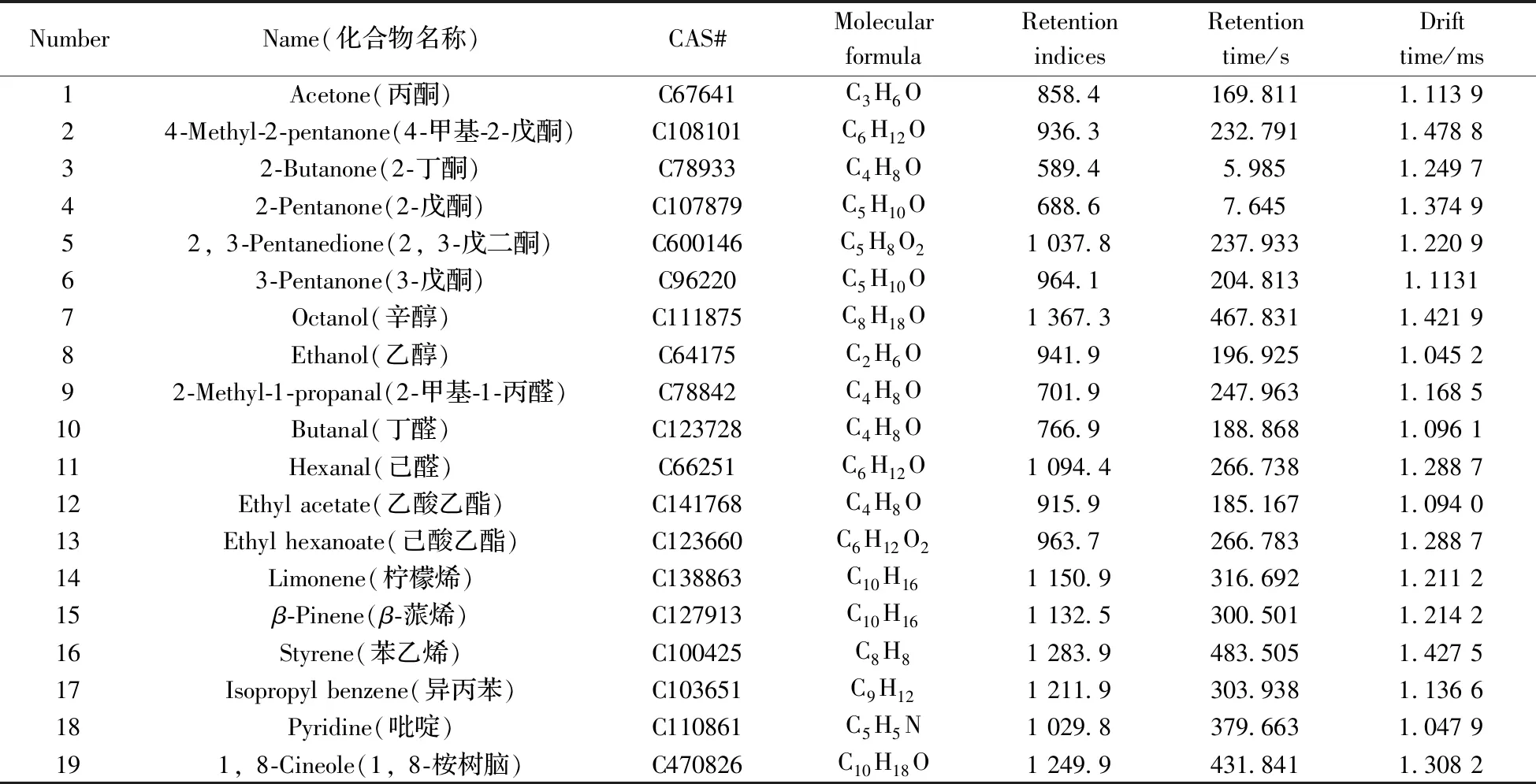
表2 受试者呼气成分定性表Fig.2 Exhalation samples identified by GC-IMS
2.2 肺隐球菌病患者呼气中的特征VOCs筛查
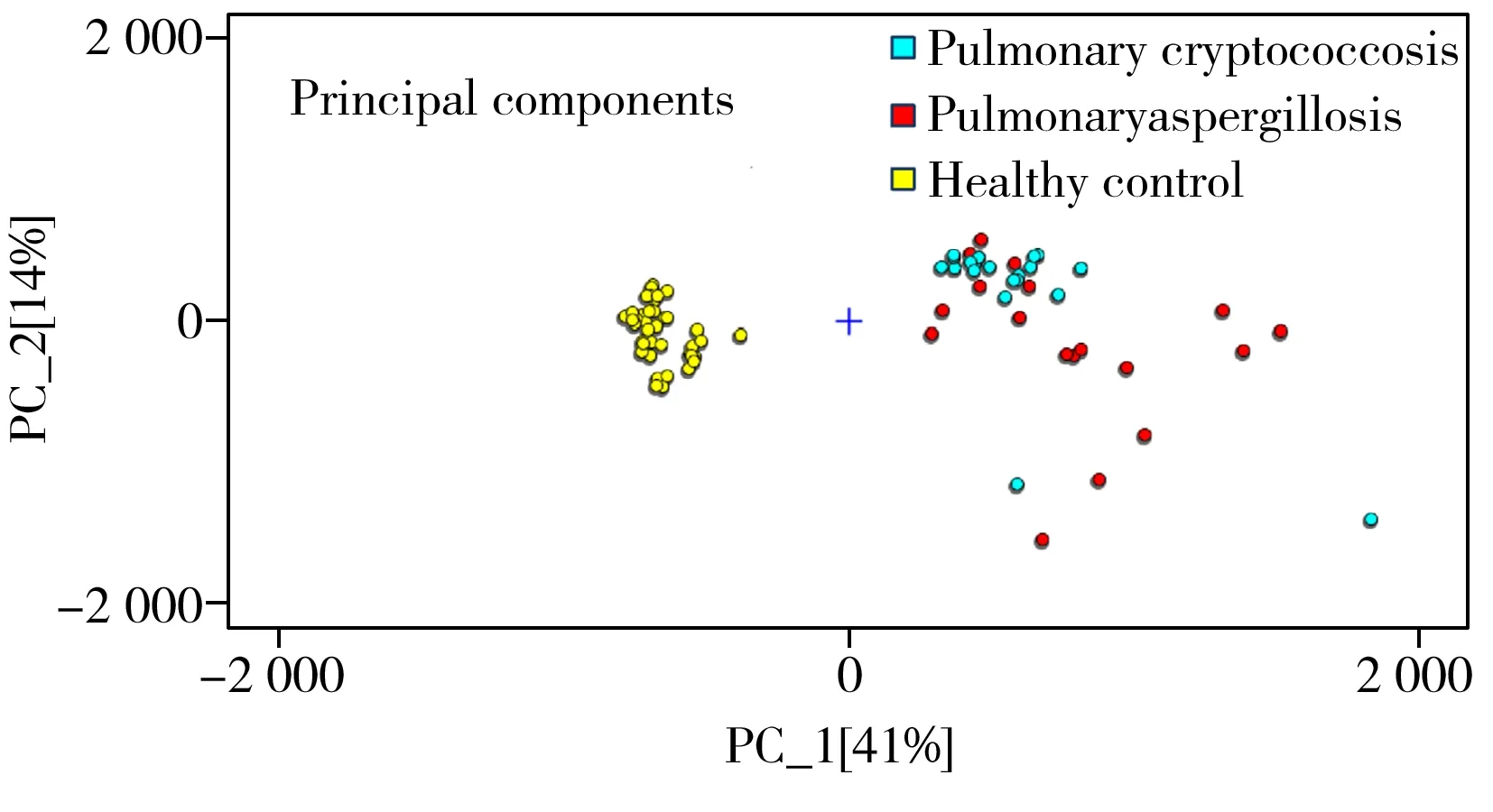
图2 肺隐球病患者、肺曲霉病患者和健康组呼气PCA分析图Fig.2 PCA analysis of patients with pulmonary cryptococcosis pulmonary aspergillosis and healthy control
将肺隐球菌病患者与对照组(肺曲霉病患者、健康受试者)进行PCA分析(图2)。由图可见,肺隐球菌病患者呼气与健康对照组之间存在明显的区别,但与肺曲霉病患者呼气无显著差异,同时发现肺曲霉病患者呼气和健康受试者之间有明显区别,这可能是由于肺隐球病和肺曲霉病同为真菌感染,因此呼气代谢中存在相似的VOCs成分。
进一步采用OPLS-DA模型分析(图3A),发现肺隐球病患者与健康对照组的呼气能很好地区分,验证了PCA分析结果;再根据VIP≥1.0的标准筛选出的肺隐球菌病患者呼气中的特征性VOCs包括2-甲基-1-丙醛、异丙苯、2-戊酮、4-甲基-2-戊酮、丁醛和己醛(图3B)。

图3 肺隐球菌病患者与健康对照组呼气OPLS-DA分析图(A)及肺隐球菌病患者呼气成分VIP值示意图(B)Fig.3 OPLS-DA analysis of exhalation in patients with pulmonary cryptococcosis and healthy control(A) and VIP value of pulmonary cryptococcosis(B)VOCs:1.2-methyl-1-propanal,2.isopropyl benzene,3.2-pentanone,4.4-methyl-2-pentanone,5.butanal,6. hexanal,7.octanol,8.2-methyl-1-propanal,9.2,3-pentanedione,10.3-pentanone
本研究进一步应用OPLS-DA模型分析了肺曲霉病患者与健康受试者的呼气VOCs差异(图4A)。由图可见,肺曲霉病患者呼气VOCs与健康对照组存在明显差异,筛选出的肺曲霉菌感染患者呼气中特征性VOCs包括2-丁酮、2-戊酮、异丙苯、2-甲基-1-丙醛、4-甲基-2-戊酮和3-戊酮(图4B)。

图4 肺曲霉病患者与健康对照组呼气呼气OPLS-DA分析图(A)及肺曲霉病患者呼气成分VIP值示意图(B)Fig.4 OPLS-DA analysis of exhalation in patients with pulmonary aspergillosis and healthy control(A) and VIP value of pulmonary aspergillosis(B)VOCs:1.2-butanone,2.2-pentanone,3.isopropyl benzene,4.2-methyl-1-propanal,5.4-methyl-2-pentanone,6.3-pentanone,7.octanol,8.2,3-pentanedione,9.limonene
研究结果表明,肺部真菌感染(肺隐球病和肺曲霉病)患者的呼气VOCs和健康对照组之间均存在显著差异,但肺隐球病与肺曲霉病之间无显著区分。这可能因为两者同为真菌感染,在人体内部氧化应激的过程相似,所以在呼气代谢中存在相似VOCs成分。实验进一步应用OPLS-DA模型对肺隐球病患者、肺曲霉病患者及健康对照组呼气VOCs进行分析,筛选出相应的特征性VOCs。结果发现肺隐球病和肺曲霉病的呼气特征性VOCs均存在异丙苯、2-戊酮、2-甲基-1-丙醛和4-甲基-2-戊酮,其中2-戊酮和4-甲基-2-戊酮是较为常见的真菌挥发性代谢产物[21-23];肺隐球病患者呼气中的特异性VOCs为丁醛和己醛。目前,肺隐球患者呼气中VOCs来源的研究还十分有限,鉴于真菌感染肺部时,菌体和菌体代谢产物中的某些毒素会在肺部引起炎症[24],从而加剧人体的氧化应激反应,造成过氧化损伤,而人体过氧化损伤过程会导致羰基化合物的形成(醛酮类物质)[25],且在上呼吸道感染患者呼气中也发现过醛酮类物质[26],因此可初步推测丁醛和己醛可能为隐球菌感染肺部后过氧化应激反应的产物。
3 结 论
本研究采用气相色谱离子迁移谱(GC-IMS)在线检测人体呼气,操作方便快捷,过程中无样品损失,在81例人体呼气中共检出19种VOCs。应用PCA分析获取的化合物信息,发现同为肺部真菌感染的肺隐球病和肺曲霉病患者呼气之间区分不显著,但二者与健康人群呼气有明显区分。另外,通过OPLS-DA模型筛选出肺隐球病和肺曲霉病患者相对于健康人群的特征性VOCs,发现肺隐球病和肺隐球病筛选出的特征性VOCs均包括异丙苯、2-戊酮、2-甲基-1-丙醛和4-甲基-2-戊酮,而未重合的丁醛和己醛在肺隐球病患者呼气的特异性更好。由此可见,使用GC-IMS可对人体呼气进行快速检测,并识别出肺隐球病患者呼气中的特征性VOCs,因此肺隐球菌病可以通过呼气检测的方法进行诊断。但是,由于真菌有传染性且灭活困难,进行体外菌株及小鼠实验较为困难,因此目前通过呼气检测筛选出的特征性化合物的来源为初步推测,具体代谢过程仍需后续研究证实。

