莲雾果实C4H基因的克隆及在NO处理下的表达分析
黄利娜,吴光斌,匡凤元,张 珅,陈发河
(集美大学食品与生物工程学院,福建 厦门 361021)
0 引言
肉桂酸4-羟基化酶(cinnamic acid- 4-hydroxylase,C4H)是苯丙氨酸代谢途径的第一个单加氧酶[1],催化反式肉桂酸羟基化成对香豆酸[2]。单加氧酶反应对植物脂肪酸、苯丙氨酸、生物碱和萜类化合物等多种代谢产物的生物合成起着重要作用。这些代谢产物受CYP73家族和苯丙烷途径调控,进而可以介导木质素的合成[3]。C4H是CYP73家族的一员,在调控木质素生物合成中起着关键作用[4]。C4H序列及表达模式已经在独行菜[5]、茶花[6]、芒果[7]、砀山酥梨[8]、桂花[9]中被报道。
莲雾(Syzygiumsamarangense)又称金山蒲桃、洋蒲桃,在中国和东南亚地区均有种植[10]。莲雾果实以优良的品质、独特的风味和较高的营养价值受到人们的喜爱,但采后呼吸代谢旺盛、组织疏松、衰老速率快,采收后如不及时进行保鲜处理,短时间内就会伴随失水而发生絮状绵软的劣变现象,影响其经济价值。前期研究[12]发现,10 μL/L 一氧化氮(nitric oxide,NO)处理可以抑制莲雾果实糖代谢、细胞壁降解酶的活性和苯丙烷代谢途径,从而延缓莲雾果实絮状绵软化的进程[11]。果实的软化通常与细胞壁代谢、以木质素合成为特征的次生代谢有关。山竹[13]和猕猴桃[14]果实中木质素含量在贮藏期间随果实软化程度增加而升高。莲雾果实采后果肉絮状绵软类型既不同于鳄梨、香蕉、番茄等果实,又不同于桃等一些冷敏感果实低温下出现的果肉纤维化絮败,也不同于枇杷果实低温下发生的果肉木质化。因此,探究莲雾果实中木质素合成机制对改善果实絮状绵软具有重要意义。有研究[15]表明,当抑制转基因烟草C4H酶的活性后,其木质素含量明显减少;同时,调控C4H转录水平还会影响木质素构成,造成S/G比值降低,而生长现象无异常。此外,研究还发现,C4H在大麻叶中的高度表达导致了木质素含量的增加[16],银杏中C4H的表达水平与木质素的合成呈正相关[17]。然而对莲雾果实中C4H的研究还未见报道。
本研究克隆了莲雾果实C4H基因并对其进行生物信息学分析,预测其结构和功能。采用NO对莲雾果实进行熏蒸处理,分析采后莲雾果实C4H在贮藏期的表达水平以及木质素含量变化,以探究在NO处理下,C4H的转录水平对木质素合成的影响,为解析莲雾果实C4H基因对木质素合成的作用,进一步探究莲雾果实木质素合成的调控机制奠定了基础。
1 材料与方法
1.1 实验材料
采用台湾‘黑珍珠’莲雾(Syzygiumsamarangenese[Blume]Merrill & L.M.Perry)为材料。挑选大小、表皮颜色、成熟度一致,无机械损伤和病虫害新鲜的莲雾果实,随机分为2组,每组140个。将所有莲雾果实密封在干燥器(16 L)中,通20 min N2以排出干燥器内的O2。一组水果注入一定体积的NO气体使干燥器内的NO浓度达到10 μL/L,熏蒸2 h;另一组不做处理(对照)。将果实置于通风处1 h后保鲜膜(打孔)包装,置于温度(4±0.5)℃、相对湿度(85±2)%条件下贮藏,贮藏期为12 d。贮藏期间每隔48 h取样进行相关指标测定分析。
1.2 莲雾果实C4H基因的分离
使用天根公司的植物RNA提取试剂盒提取莲雾果实总RNA,分别用琼脂糖凝胶电泳和核酸蛋白质分析仪(Eppendorf)检测RNA的完整性和浓度。采用逆转录试剂盒(Invitrogen,MD,USA)的操作步骤,以1 μg RNA为模板生成cDNA的第一条链。根据实验室已测得的莲雾果实转录组数据,使用Primer Premier5.0软件设计C4H扩增的特异性引物(见表1),PCR扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性40 s,72 ℃延伸2 min,重复40个循环;最后72 ℃延伸10 min。利用凝胶提取试剂盒(Omega Bio-Tek,GA,USA)纯化PCR产物,连接克隆载体pMD-19T,转化大肠杆菌感受态细胞DH5a,挑选阳性克隆基因送至厦门博瑞生物公司进行测序。

表1 研究中使用的引物

1.3 莲雾果实C4H的生物信息学分析
利用NCBI Served Domains数据库在线进行保守域的识别。分别使用在线软件ProtParam、Signal P 4.1 Server、TMHMM、Net Phos 3.1 Server对C4H氨基酸序列进行序列、信号肽、跨膜结构、磷酸化位点的分析。通过DNAMAN对不同植物C4H蛋白的氨基酸序列进行多序列比对分析。
1.4 莲雾果实C4H表达水平分析
根据已获得莲雾果实C4H序列,使用Primer Premier 5.0设计定量即时聚合酶链锁反应(quantitative real time polymerase chain reaction,qRT-PCR)特异性引物(见表1),使用ABI7300荧光PCR仪进行C4H表达水平分析,按照Super Real Pre Mix Plus(SYBR Green)配制qRT-PCR反应体系,2×Super Real Pre Mix Plus,10 μL;正向引物,0.6 μL;反向引物,0.6 μL;cDNA模板,1 μL;50×ROX Reference Dye,2 μL;RNase-free ddH2O,补至总体系20 μL。反应程序为:95 ℃预变性15 min;95 ℃变性10 s,60 ℃退火和延伸31 s,40个循环。每种处理设置3个生物学重复以及3次技术重复。根据2-△△Ct法分析贮藏期间果实C4H的表达水平。
1.5 莲雾果实木质素含量的测定
采用Klason法测定莲雾果实中木质素含量[18]。将取自10个莲雾的果肉10 g(记为m)研磨成匀浆,加入12 mL体积分数70%浓硫酸,在40 ℃下振荡水浴1 h,用200 mL蒸馏水反复冲洗匀浆至500 mL锥形瓶中,沸水浴1 h,备好已烘干至恒重的滤纸,称取质量记为m0,匀浆液经布氏漏斗过滤之后,用热水冲洗滤渣,将带有滤渣的滤纸置于65 ℃下烘至恒重,称重记为m1。木质素的计算方法:木质素/%=(m1-m0)/m×100。
2 结果
2.1 莲雾果实C4H序列的获得
基于前期测序得到的莲雾果实转录组数据库,经过分析筛选到一条长度为1 849 bp的Unigene(编号为comp44506_c0),被注释为肉桂酸-4-羟基化酶基因。根据其基因序列设计特异性引物,以莲雾果实提取的RNA为模板,采用RT-PCR进行C4H序列扩增。扩增产物经电泳检测、特异性条带纯化回收与测序,最终获得莲雾果实C4H序列长1 849 bp,含有完整的开放阅读框(open reading frame,ORF)1 518 bp,编码505个氨基酸(见图1)。扩增得到的莲雾果实C4H序列与转录组数据库中的序列一致。
2.2 莲雾果实C4H的生物信息学分析
利用ExPASy对莲雾果实C4H的ORF编码氨基酸序列进行理化性质分析,C4H蛋白质分子式是C2625N732O716S17,原子总数8 260,分子质量57.985 ku,等电点为9.34。属于亲水性蛋白质(总的亲水性平均系数为-0.233)、不稳定蛋白质(不稳定性指数48.36)。在氨基酸的构成中,亮氨酸(Leu)占比最多(12.1%),其次为缬氨酸(Val),占比为7.9%,半胱氨酸(Cys)占比最少,仅为0.6%。该基因编码的氨基酸中,正电荷氨基酸残基数(Arg+Lys)为73,负电荷氨基酸残基数(Asp+Glu)为62。
保守结构域分析结果如图2所示,C4H蛋白质含有P450(cytochrome P450)和PLN02394 (trans-cinnamate 4-monooxygenase)两个保守结构域。C4H催化位点残基包括I109、K113、V118、F220、E301、N302、I303、V305、A306、T310、R366、R368、A370、I371、P372、L374、V375、P376、H377、K484、F488、L490。这些催化位点分布在5个特殊的底物结合区域,包括SRSl、SRS2、SRS4、SRS5和SRS6(见图1)。利用NetPhos 2.0预测莲雾果实C4H蛋白质发现含有28个磷酸化位点,包括14个丝氨酸(Ser)、8个苏氨酸(Thr)和6个酪氨酸(Tyr)(见图3)。
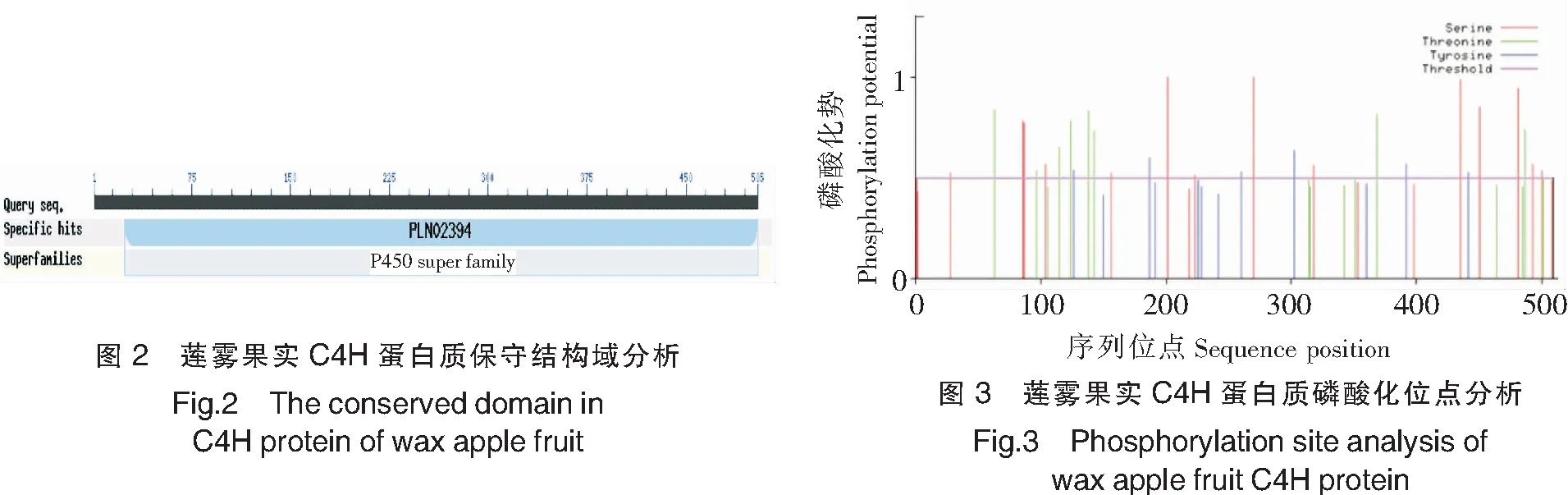
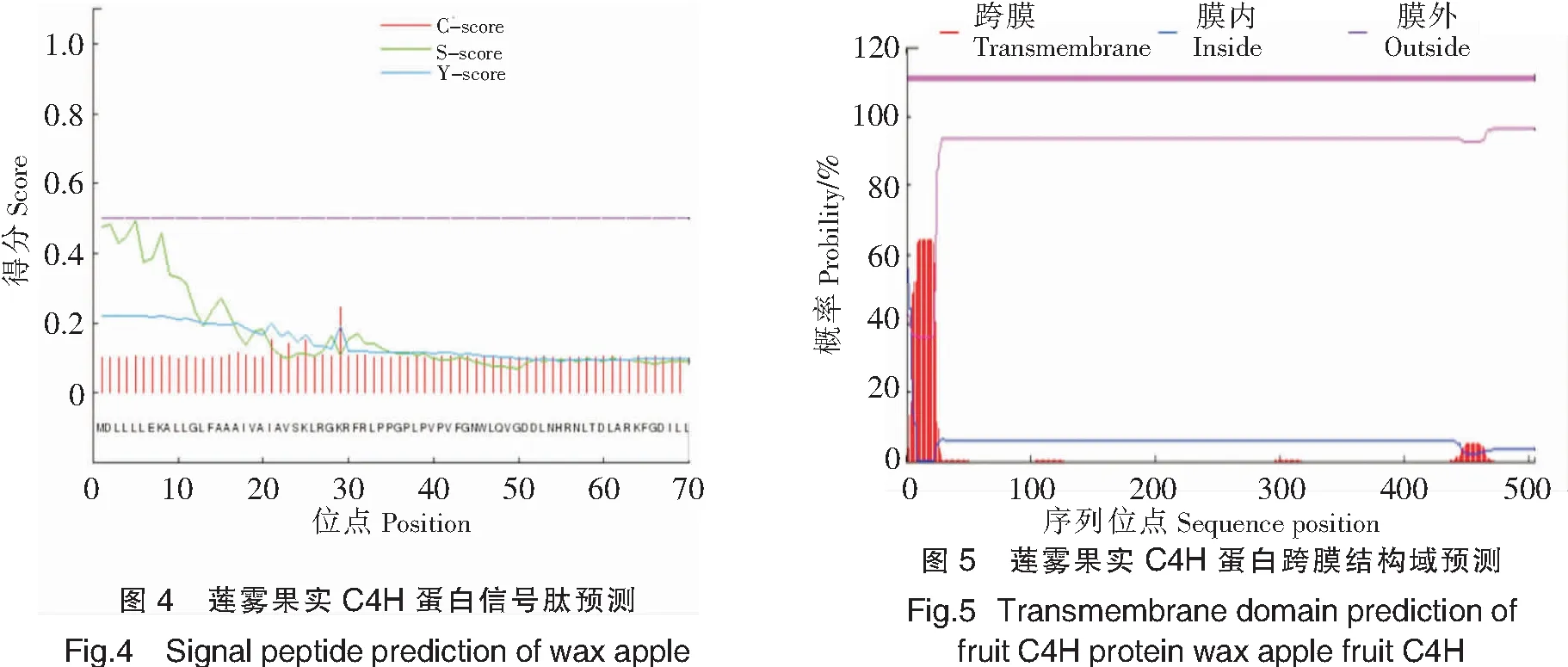
进一步对莲雾果实C4H结构功能研究,采用Signal P 4.1 Server 对氨基酸序列信号肽进行预测,结果如图4显示,其多肽链第29号赖氨酸(Lys)残基具有最高的原始剪切位点分值0.246,第11号亮氨酸(Leu)残基具有最高的综合剪切位点分值0.213,第5号亮氨酸(Leu)残基具有最高的信号肽分值0.492,表明莲雾果实C4H不存在信号肽酶切位点,不具有信号肽。利用TMHMM对莲雾C4H编码的氨基酸序列跨膜结构域进行预测,结果显示,整条多肽链不存在跨膜结构域,不是膜上的受体或者定位于膜上(见图5)。
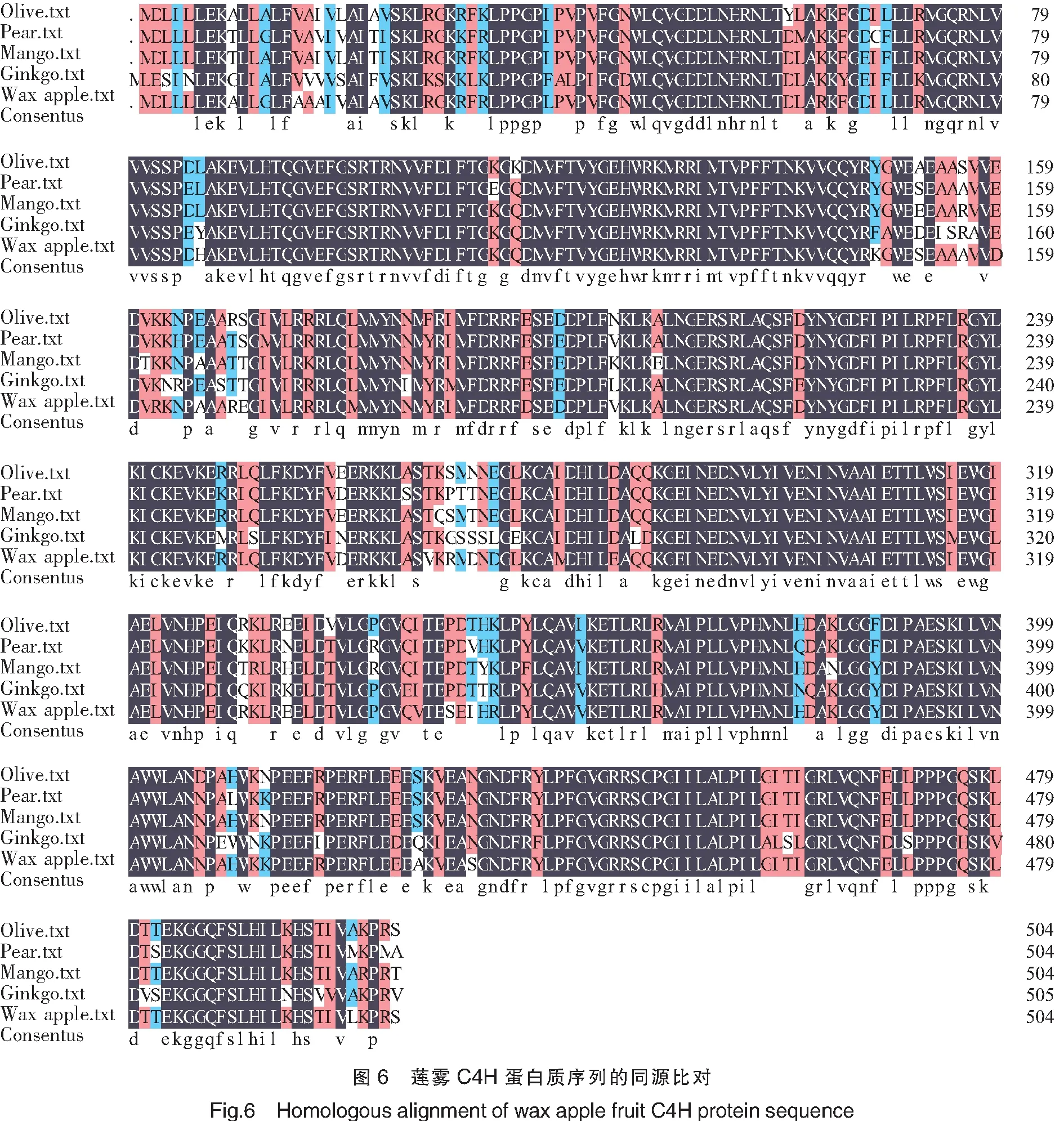
利用DNAMAN软件对不同种类植物C4H蛋白质进行多重比对,分析C4H蛋白质的相似性,结果如图6显示。可见,莲雾果实C4H蛋白质与已研究报道的橄榄、梨、芒果、银杏C4H蛋白质具有较高的相似性,进一步证明了从莲雾果实中获得的基因是C4H基因。之前的研究还证明,芒果、梨、银杏的C4H表达水平与木质素的合成具有正相关关系,是木质素调控的关键基因,进而推断莲雾果实C4H可能也具有此功能。
2.3 NO处理下莲雾果实C4H表达分析
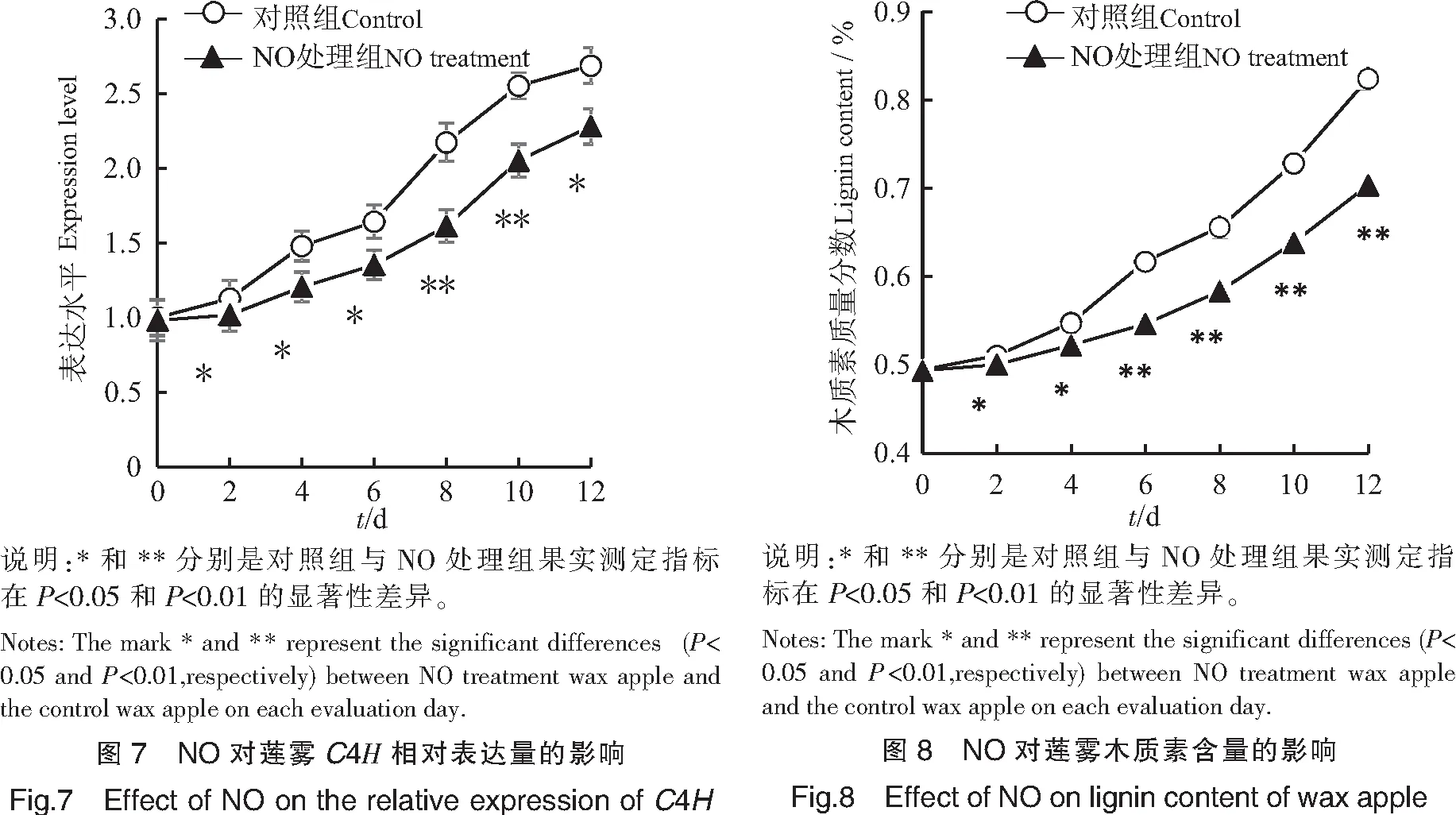
采用实时荧光定量PCR技术对莲雾果实C4H表达水平进行分析,结果如图7所示,在贮藏期间,采后莲雾果实C4H的表达水平逐渐增加。对照果实C4H表达水平在贮藏前两天略有上升,随后迅速上升;而NO处理组果实C4H的表达水平变化趋势相同,但NO处理组果实C4H的表达水平低于对照组。显著性分析表明,NO处理组莲雾果实C4H的表达水平在贮藏第2~12 d显著低于对照组(P<0.05)。由此可见,NO可以抑制采后莲雾果实C4H的转录水平。
2.4 NO处理下木质素含量变化的分析
图8显示,采后莲雾果实木质素含量随贮藏时间的延长而增加。对照组果实木质素含量从第0~4天逐渐升高,贮藏第4~12天木质素含量迅速上升;而NO处理组果实中木质素含量从第0~2天缓慢上升,然后逐渐增加。显著性分析表明,在果实贮藏第2~12天,NO处理组果实木质素含量显著低于对照果实(P<0.05)。由此可见,使用NO处理采后莲雾果实,可显著抑制采后莲雾果实木质素含量积累。
3 讨论
苯丙烷类代谢途径是植物重要的次生代谢途径之一,此途径以苯丙氨酸为底物,在一系列酶的催化作用下,合成黄酮、木质素、香豆素等多种次生代谢产物[19]。木质素是植物细胞壁的主要成分,与纤维素一起参与植物根茎的生长以及影响一些水果的软化[13]。其他次生代谢产物如黄酮醇、花青素、异黄酮以及其他类黄酮物质在植物生长、抗病性和抗应激性中发挥重要作用[19]。C4H是植物苯丙烷代谢通路中第1个单氧化酶,该酶在植物细胞中的含量可以影响木质素等多种次生代谢物质的合成[1]。因此,在不同植物中鉴定出C4H将对促进经济作物生产或调控果蔬品质发挥关键作用。C4H已在多种植物中被鉴定,但在莲雾果实中还未有报道,本研究采用qRT-PCR技术从莲雾果实中获得C4H基因。
C4H蛋白质含有细胞色素P450和反式肉桂酸-4-单加氧酶结构域[2,20]。这两个特征域在莲雾果实C4H蛋白质中均被预测到,表明克隆得到的基因为莲雾果实的C4H基因。莲雾C4H蛋白质中鉴定出5个特殊的底物结合区域(见图1),是此蛋白质的功能区域。C端的SRS5、SRS6和SRS4是以芳香环为底物的结合位点,N端的SRS4、SRS1和SRS2是以脂肪链为底物的关键结合区域[22]。莲雾果实C4H所含的结构域表明,它是具有催化功能的C4H/CYP73A5家族成员。细胞内蛋白质磷酸化与信号转导密切相关,其磷酸化部位主要包括丝氨酸、苏氨酸和酪氨酸结合位点[23]。磷酸化后可改变蛋白质的活性,这种改变在植物生理生化应答反应过程中起重要作用[24]。在莲雾果实C4H蛋白质中观察到15个磷酸化位点,这些预测的位点在催化活性中起关键作用。莲雾果实C4H蛋白质与已研究的橄榄、梨、芒果、银杏C4H蛋白质具有较高的相似性,说明C4H蛋白在植物间具有较高的保守性以及推测这些蛋白质的功能也具有相似性。
已有研究[25]表明,木质素的积累量与C4H的表达水平有着密切的关系,如刺梨木质素含量的变化趋势和C4H的变化趋势相同,两者表现出显著正相关关系;Wang等[26]发现C4H表达水平的上调抑制苹果中木质素的合成。在采后莲雾果实贮藏期间,C4H的表达水平和木质素积累量逐渐增加,相关性分析显示,莲雾果实C4H表达水平与木质素含量相关性达0.972,呈极显著正相关,表明莲雾C4H与木质素合成密切相关。适宜浓度的NO能够抑制细胞壁代谢相关酶活性,延缓了果实软化与衰老,从而维持采后果蔬的贮藏品质[27]。本研究中10 μL·L-1NO显著抑制了莲雾果实C4H的表达水平和木质素含量(P<0.05)。由此可见,外源NO处理可能是通过抑制C4H的转录水平来抑制木质素的合成速度,从而延缓莲雾果实中心絮状绵软的进程,为将NO处理用于采后莲雾果实品质保持提供理论依据,也为揭示C4H基因调控莲雾果实木质素合成机理奠定了理论基础。

