鳗鲡源创伤弧菌的间接ELISA快速检测
肖益群,翟少伟,郭松林
(1.集美大学水产学院,福建 厦门 361021;2.鳗鲡现代产业技术教育部工程研究中心,福建 厦门 361021)
0 引言
鳗鲡是我国重要的养殖经济品种。随着养殖生产集约化程度提高和水域环境影响,鳗鲡病害日益严重,对鳗鲡养殖业的健康持续发展造成了威胁,尤以细菌性疾病最为严重。创伤弧菌(V.vulnificus)是弧菌属第5群细菌,革兰氏染色阴性,为嗜盐型海洋菌[1]。同时,创伤弧菌还是兼性厌氧型细菌,在有氧和无氧条件下均能生长,最适生长温度为28℃。根据生化反应、遗传特性、血清学试验的差异和宿主范围的不同,将其分为3种生物型[2],其中生物2型菌株是鳗鲡的重要病原菌,是导致鳗鲡出血性败血症、烂鳃病、烂尾病等的原发性致病菌[3-5]。创伤弧菌表面的外膜蛋白(OMPs)和胞外产物中的外毒素在细菌的致病过程中起着十分重要的作用[6-7]。创伤弧菌对鳗鲡有较强的感染性,若能建立起快速而又准确的检测方法,将能有效防治和控制鳗鲡细菌病害的发生,减少养殖业的经济损失。酶联免疫吸附法(ELISA)是一种利用抗原抗体之间的特异性反应与酶分子的高效催化作用,使降解底物产生颜色反应,可定性定量检测抗原或抗体的方法[8]。该方法有着操作简便、所需时间短、特异性强、灵敏度高、结果直观和实用性强等优点[9-10]。纵观已经报道的细菌鉴定试剂盒研究,基本局限于细菌培养后的实验室检测,能够用于养殖发病现场的细菌检测试剂盒很少,且一般均存在严重的非特异性反应。本研究以实验室近20年分离的创伤弧菌和其他37株鳗鲡致病菌为材料,拟初步建立特异性的创伤弧菌的ELISA现场快速检测方法,以期能够特异性检出病鳗脏器内的创伤弧菌。
1 材料与方法
1.1 菌株、血清和酶标抗体
试验采用的38株菌取自集美大学水产学院鳗鱼病原菌库,其编号与鉴定结果详见表1。创伤弧菌兔抗血清由本实验室制备,羊抗兔酶标抗体购自Thermo公司。

表1 试验所用菌株名称及编号
1.2 试验鳗鲡和菌液制备
30尾健康美洲鳗鲡(Auguillarostrata)取自集美大学水产学院海水养殖场,饲养于水簇箱中,保持充气。用1×108cfu/mL创伤弧菌、迟缓爱德华氏菌(Edwardsiellaanguillarum)和嗜水气单胞菌(Aeromonashydrophila)分别腹腔注射健康鳗鲡10尾,收集不同时间濒死或刚刚死亡的鳗鲡脏器,样品经匀浆后保存于-80 ℃备用。将创伤弧菌采用划平板法接种于含有0.5%NaCl的胰蛋白胨大豆琼脂(TSA)培养基上,在生化培养箱中30 ℃培养24 h,无菌操作下挑取平板分离培养出的单菌落接种于胰蛋白胨大豆肉汤(TSB),于摇床培养箱中30 ℃振荡培养约16 h。将肉汤倒入灭菌后的离心管,配平质量,于高速冷冻离心机上4 ℃、7 000 r/min离心4 min,然后弃上清液,用PBS重悬沉淀,经同条件下离心和PBS洗涤3次后,再用少量包被液重悬沉淀,边加包被液边测A595,待A595=0.1时,即得到浓度为1×108cfu/mL的创伤弧菌菌液。按此方法分离培养其他37株菌株并制备菌液。
1.3 创伤弧菌兔抗血清效价的测定
用包被液稀释1.2制得的浓度为1×108cfu/mL的创伤弧菌菌液,并调整至最佳工作浓度(1×106cfu/mL),用排枪以100 μL/孔包被于酶标板上,置恒温培养箱中45 ℃包被过夜直至干燥。用PBST洗涤酶标板3次,200 μL/孔,5 min/次。加入封闭液(1 %BSA/PBST)200 μL/孔,恒温培养箱中37 ℃孵育2 h。PBST洗涤液又洗板3次,5 min/次。加入PBST稀释的创伤弧菌兔抗血清(用PBST按1∶8 000,1∶16 000,1∶32 000,1∶64 000,1∶128 000,1∶256 000,1∶512 000,1∶1024 000进行倍比稀释,每个稀释度做2孔平行)100 μL/孔,阴性对照孔加入相同稀释度的等量阴性兔血清,30 ℃孵育1 h。PBST再洗板3次,5 min/次。用PBST按1∶20 000稀释的羊抗兔酶标抗体100 μL/孔加入酶标板中,37 ℃孵育30 min。继续用PBST洗板4次,5 min/次。加入OPD底物溶液(按照每10 mL OPD底物溶液临用前加入30 μL的30%H2O2)50 μL/孔,显色10 min。最后加入2 mol/L的H2SO4终止显色,50 μL/孔,酶标仪上测A492。间接ELISA检测法测定。以S/N值≥2的最高稀释倍数为该样品的血清效价(S为样品的A492,N为阴性对照的A492)。
1.4 创伤弧菌兔抗血清与鳗鲡病原菌的交叉ELISA试验
以创伤弧菌为例,将制得的A595=0.1的创伤弧菌菌液用包被液稀释100倍后得到约1×106cfu/mL的菌悬液,按100 μL/孔加入96孔酶标板中,于干燥箱中45 ℃包被过夜直至干燥。同法包被其他37株菌株的菌液,每株菌包被2孔。创伤弧菌兔抗血清用PBST分别按1∶256 000、1∶128 000进行稀释,根据1.3的间接ELISA检测法进行试验。当样品A492<阳性对照A492×50%时且其S/N值小于2判定为不交叉,当阳性对照A492×50%≤样品A492<阳性对照A492×80%时且其S/N值小于2判定为交叉菌,当样品A492≥阳性对照A492×80%且其S/N值大于2时判定为创伤弧菌。
1.5 攻毒死亡后鳗鲡不同组织悬液的检测
用ELISA方法检测创伤弧菌、迟缓爱德华氏菌和嗜水气单胞菌分别攻毒死亡后的鳗鲡的肝脏、肾脏、鳃。样品采集方法如下:解剖鳗鲡并取出各脏器,分别先用剪刀剪碎,再用研钵进行粗研磨,用离心管称取0.1 g,加入1 mL PBS混匀,离心5 s取上清液,用PBS进行倍比稀释,即质量浓度分别为0.1,0.05,0.025,0.012 5,0.006 25,0.003 125g/mL,每个质量浓度做2孔平行,100 μL/孔包被于酶标板上,恒温培养箱中45 ℃包被过夜至干燥,同时做阳性、阴性和空白对照,阴、阳性对照的创伤弧菌液包被浓度均为1×106cfu/mL,阴性对照以兔阴性血清代替抗血清。以样品A492≥阳性对照A492×80%且P/N值≥2(P为阳性对照A492)判定为检出。创伤弧菌兔抗血清用PBST分别按1∶128 000、1∶64 000、1∶32 000进行稀释,据1.3的间接ELISA检测法进行试验。
2 结果
2.1 兔抗创伤弧菌血清效价
本研究在检测创伤弧菌抗血清效价时采用了3个细菌的包被浓度,分别为1×105,1×106,1×107cfu/mL,结果发现1×106cfu/mL的包被效果最好。以1×106cfu/mL的抗原菌液包被ELISA板,不同稀释倍数的兔抗创伤弧菌血清ELISA检测结果如表2所示。由表2可知,当血清稀释倍数为1∶512 000时,S/N值>2,故该兔抗血清的效价为1∶512 000。

表2 兔抗创伤弧菌血清ELISA效价的测定结果
2.2 兔抗创伤弧菌血清与其他病原菌的交叉试验结果
用兔抗创伤弧菌血清与38株细菌进行ELISA交叉实验,当兔抗创伤弧菌血清稀释度为1∶256 000或1∶128 000,菌液包被浓度为1.0×106cfu/mL时,除创伤弧菌外,其他37株菌的A492均小于阳性对照的一半,且其S/N值均小于2(见表3、表4)。表明这37菌株鳗鲡病原菌均不与兔抗创伤弧菌血清产生明显的ELISA交叉反应。
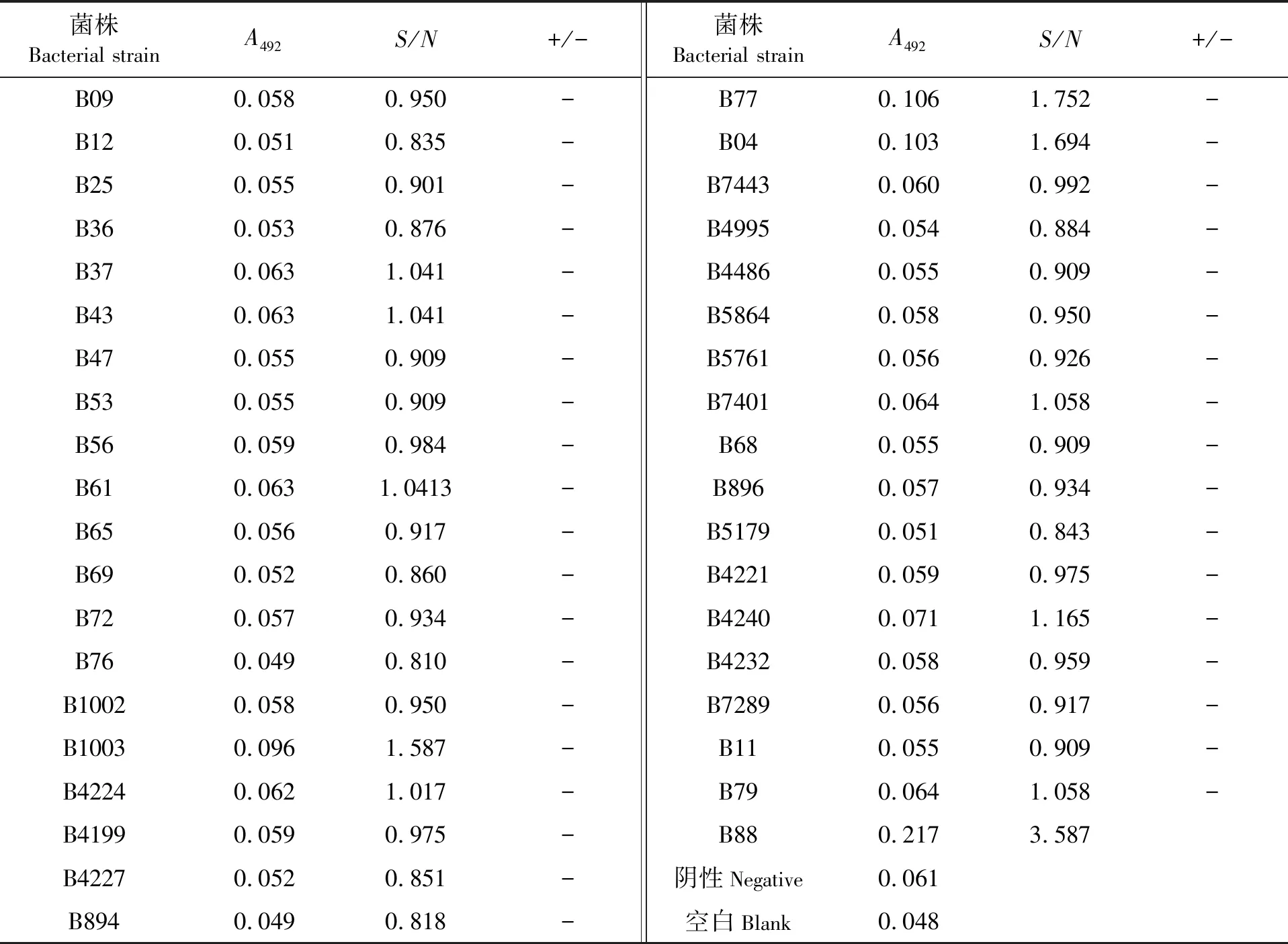
表3 兔抗创伤弧菌血清(1∶256 000)的交叉试验结果

表4 兔抗创伤弧菌血清(1∶128 000)稀释时的交叉试验结果
2.3 攻毒死亡鳗鲡不同组织悬液检测结果
分别采集创伤弧菌、迟缓爱德华氏菌和嗜水气单胞菌攻毒死亡后的鳗鲡肝脏、肾脏、鳃等组织悬液,经ELISA板包被后采用兔抗创伤弧菌血清进行检测。由表5、表6可知,将兔抗创伤弧菌血清1∶64 000稀释时,鳃包被质量浓度为0.025~0.1 g/mL条件下可检出创伤弧菌;而当血清1∶32 000稀释时,鳃包被质量浓度为0.025~0.05 g/mL和肾脏包被浓度为0.0125 g/mL条件下均可检出创伤弧菌。

表5 细菌攻毒死亡鳗鲡检测结果平均值(血清1∶64 000稀释)

表6 攻毒死亡鳗鲡检测结果平均值(血清1∶32 000稀释)
3 讨论
提高ELISA检测法准确性的最重要因素是采用高效价的特异性兔抗血清,高倍稀释的兔抗血清可以降低抗原抗体反应中的非特异吸附水平,增强抗原抗体的特异性反应,进而提高检测方法的灵敏度和准确性[11]。本试验检测的兔抗创伤弧菌血清效价高达1∶512 000(见表2),表明该血清为高效价的特异性血清,可用于特异性检测创伤弧菌。为确保该法能特异性检出鳗鲡体内的致病性创伤弧菌,本研究采用实验室分离的另37株病原菌(见表1)进行交叉试验。结果表明,高倍稀释后的兔抗创伤弧菌血清与其他37株菌均未发生明显的交叉反应(见表3、表4)。因此,用该血清检测发病或死亡鳗鲡体内的创伤弧菌将具有良好的特异性和准确的检测效果[12]。
本研究用稀释度为1∶64 000和1∶32 000的兔抗创伤弧菌血清时均能特异性检测出创伤弧菌。当血清1∶64 000稀释时鳃组织包被质量浓度的范围较广(0.025~0.1 g/mL);而1∶32 000稀释时,鳃包被质量浓度稍窄(0.025~0.05 g/mL),但同时可从0.0125 g/mL的肾脏组织中检出创伤弧菌(见表5、表6)。文献[13-14]研究表明,组织包被质量浓度过高或过低均可影响检测效果,过低可能因菌量太少而达不到最低检测限,过高可能受组织中非特异性物质的干扰。本研究未在肝脏中检测到创伤弧菌,这可能与该菌感染后的定植位置相关。本试验在血清稀释度为1∶128 000时也进行了感染死亡鳗鲡的检测,但未检测到创伤弧菌,可能与血清检测菌体(见表3、表4)和检测组织所要求的抗体浓度不同有关(见表5、表6)。另外,本研究仅检测了鳗鲡常见的3种病原菌(创伤弧菌、嗜水气单胞菌和鳗鲡爱德华氏菌)感染死亡后的脏器,有必要用其他鳗鲡病原菌进行攻毒和检测,以进一步验证该抗血清的检测效果。
由于攻毒或自然感染后病原菌在脏器中的含菌量往往可以达到1×106cfu/g组织以上,故本次检测采用1×106cfu/mL的病原菌作为阳性对照,但若组织中达不到此含菌量,则可能无法被本次建立的方法检出[15]。由于直接用组织悬液包被在ELISA板上进行抗原吸附的效果易受组织蛋白的干扰,余俊红等[13]在检测鳗弧菌时对组织悬液进行了100 ℃煮沸5~10 min的前处理,可降低组织蛋白的干扰,增加抗原样品的吸附能力;王艳等[16]采用dot-ELISA代替间接ELISA方法进行试验并较好地改善了蛋白干扰的问题。
综上所述,本研究获得的兔抗创伤弧菌高效价血清对该菌的菌体检测特异性好,其对该菌攻毒感染死亡的鳗鲡也有较高的检出率,拟在鳗鲡养殖实践中取发病鳗鲡的鳃(0.025~0.1 g/mL)和肾脏组织(0.0125 g/mL)采用1∶32 000稀释的抗体进行快速检测。同时,本研究结果为创伤弧菌病快速检测试剂盒的研制建立了条件。

