11例1型发作性睡病睡眠结构的多导睡眠图分析
吴美娜, 林 芳, 王小勇, 陈海泓, 季晓林, 严金柱
发作性睡病是一种常见于儿童的睡眠-觉醒周期紊乱性疾病,其临床表现包括白天反复发作的无法遏制的睡眠、猝倒发作、夜间睡眠障碍等,其中夜间睡眠障碍包括睡眠中断、觉醒次数和时间增多、睡眠效率下降、睡眠瘫痪、入睡前幻觉等[1]。本研究采用夜间多导睡眠监测(nocturnal polysomnogram,nPSG),回顾性研究2007年1月-2017年12月就诊的11例1型发作性睡病患者的临床资料,探讨其夜间睡眠结构的变化情况,报道如下。
1 对象与方法
1.1对象 11例中,男性7例,女性4例,年龄(10.09±2.70)岁(7~14岁)。诊断标准按照国际睡眠障碍分类-第3版(International Classification of Sleep Disorders,3rd edition,ICSD-3),即患者存在白天难以遏制的困倦和睡眠发作,症状持续>3月,并满足以下1项或2项条件:(1)有猝倒发作(符合定义的基本特征),经过标准的多次小睡潜伏期试验(multiple sleep latency test,MSLT)检查平均睡眠潜伏期≤8 min,且出现≥2次睡眠始发快速眼球运动睡眠现象(sleep onset rapid eye movement periods,SOREMP)。MSLT前夜进行nPSG检查,nPSG出现SOREMP可以替代1次白天MSLT中的SOREMP。(2)免疫反应法检测脑脊液中下丘脑外侧区分泌素-1(hypocretin,Hcrt-1)浓度≤110 pg/mL或<正常参考值的1/3[1]。所有病例组均为首次就诊患者,均未服用药物治疗。
选取同期就诊的20例有日间嗜睡主诉的儿童作为对照组,男性13例,女性7例,年龄(10.240±2.94)岁(5~16岁),均排除睡眠相关疾病及神经系统疾病。两组患儿的年龄、性别相匹配,均排除睡眠呼吸暂停低通气综合征、特发性睡眠增多、睡眠不足综合征、癫痫等睡眠及神经系统相关疾病。
1.2方法
1.2.1监测方法 两组患儿均使用多导睡眠监测仪(N7000 60导,美国Rembrandt Embla公司)进行nPSG及次日MSLT监测,并采用Analysis Manager软件进行分析。所有受检者均进行整夜(>7 h)连续包括16导脑电图的视频PSG,并于次日进行5次MSLT监测。MSLT安排在nPSG后进行,卧床后观察20 min,若入睡,继续观察15 min,之后保持清醒至下次检测,如此反复进行5次小睡,分别于9:00,11:00,13:00,15:00和17:00进行描记[2]。监测内容包括16导脑电图、心电图、眼动电图、下肢肌电图等,同步红外线视频录像监测受检者有无夜间睡眠行为异常。
1.2.2监测参数 入睡后觉醒时间(wake time after sleep onset,WASO)占总卧床时间的百分比(WASO%)、睡眠效率、各期睡眠所占百分比[包括:非快速眼球运动(non rapid eye movement,NREM)睡眠1,2,3期的比例(N1%,N2%,N3%)、快速眼球运动(rapid eye movement,REM)睡眠期比例(R%)]、入睡潜伏期、REM睡眠潜伏期、醒觉指数、周期性腿动指数、呼吸暂停低通气指数(apnea hypopnea index, AHI)。上述参数均由系统自动分析后再进行人工校正,最后算出相关数值。

2 结 果
2.1夜间睡眠各参数比较 与对照组比较,病例组的WASO%及N1%增加,入睡潜伏期及REM入睡潜伏期缩短,N3%减少,两组差别有统计学意义(P<0.05,表1)。两组在睡眠效率、N2%、R%、醒觉指数、周期性腿动指数及AHI等方面差别无统计学意义(P>0.05,表1)。
2.21型发作性睡病患儿夜间视频动态脑电图 两组在16导脑电图的视频PSG及MSLT过程中均未发现痫样放电(图1)。
表1 1型发作性睡病组和对照组夜间睡眠各参数比较
Tab 1 Comparison of night sleep parameters between type 1 narcolepsy and control group
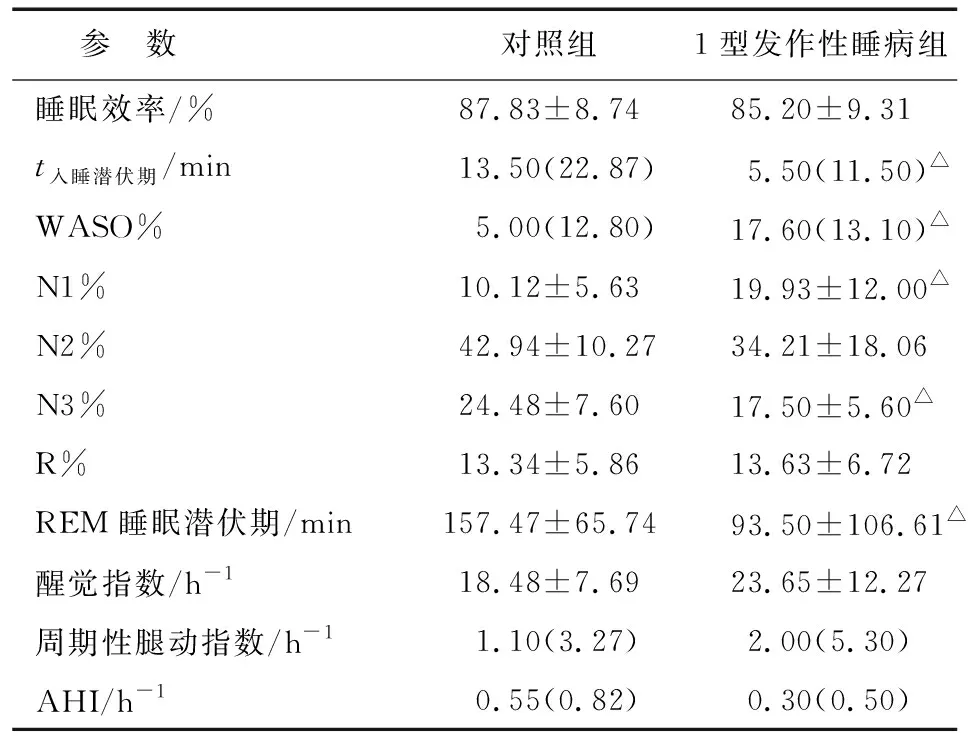
参 数对照组1型发作性睡病组睡眠效率/%87.83±8.7485.20±9.31t入睡潜伏期/min13.50(22.87)5.50(11.50)△WASO%5.00(12.80)17.60(13.10)△N1%10.12±5.6319.93±12.00△N2%42.94±10.2734.21±18.06N3%24.48±7.6017.50±5.60△R%13.34±5.8613.63±6.72REM睡眠潜伏期/min157.47±65.7493.50±106.61△醒觉指数/h-118.48±7.6923.65±12.27周期性腿动指数/h-11.10(3.27)2.00(5.30)AHI/h-10.55(0.82)0.30(0.50)
WASO%:入睡后觉醒时间占总卧床时间的百分比;N1%,N2%,N3%:非快速眼球运动睡眠1,2,3期比例;R%:快速眼球运动睡眠期比例;AHI:呼吸暂停低通气指数. 与对照组比较,△:P<0.05.
3 讨 论
发作性睡病在我国的患病率为0.033%[3],其发病高峰期为8~12岁,男女均可患病,男性略高于女性[4]。发作性睡病患者夜间容易入睡,但睡眠质量差。Thomas等研究发现,33%~81%的发作性睡病患者有夜间多次觉醒主诉[5]。多达80%的发作性睡病患者存在夜间睡眠片段化的现象,睡眠主观满意度调查也显示,发作性睡病患者对睡眠的主观感觉正常的为17.5%、感觉满意和非常满意的分别为15%和0,而对照组则分别为22.5%,50%和15%(P<0.001)。
研究认为,1型发作性睡病的特征性病理改变是Hcrt神经元特异性缺失。Hcrt又称Orexin,是1998年发现的具有促醒作用的肽类物质,分为Hcrt-1和Hcrt-2。Hcrt神经元通过投射到蓝斑、中缝背核、结节乳头核等神经核,产生去甲肾上腺素、5-羟色胺、组胺等递质,而起到促进觉醒和抑制REM睡眠的作用[6]。Hcrt的缺乏可导致睡眠-觉醒转化机制不稳定,并导致夜间睡眠维持困难、睡眠结构紊乱。
发作性睡病患者的睡眠结构存在以下变化:入睡潜伏期缩短、入睡后觉醒增加、睡眠效率下降、觉醒次数增加、N1%增加、N3%减少等[1]。本研究结果提示,与对照组比较,1型发作性睡病组患者的入睡潜伏期及REM潜伏期缩短、N1%增加、N3%减少,与李秀娥等的研究相符,但在Reiter等的研究中并未见N3%减少[7-8];Pizza等对52例1型发作性睡病患者进行夜间PSG及次日MSLT研究,结果均提示1型发作性睡病组N1%增加、N2%减少[9-10]。提示1型发作性睡病患者存在夜间睡眠结构紊乱。近期较多的观点认为,发作性睡病的夜间睡眠结构紊乱与Hcrt神经元缺失有关。1型发作性睡病患者Hcrt神经元特异性丧失达85%~95%[11]。有学者对发作性睡病患者采用核磁共振弥散张量成像进行研究,结果提示患者下丘脑的扩散性增加,这是发作性睡病患者Hcrt神经元缺失的标志[12]。
睡眠片段化是睡眠的连续性遭到破坏,可表现为觉醒次数增多、浅睡眠增多等。WASO%、N1%、醒觉指数等指标可作为反映睡眠片段化的参数。Thomas等的研究提示,1型发作性睡病组的WASO%及N1%增加,醒觉指数升高[5,8,10]。本研究也发现,1型发作性睡病组的WASO%、N1%增加,为睡眠片段化提供了客观依据。这些睡眠参数的改变,除了反应1型发作性睡病睡眠片段化外,亦可能作为本病临床药物治疗研究的客观评估参数。Roth等通过对1型发作性睡病组和对照组的比较,对服药前及服药8周后的睡眠结构进行评估,发现羟丁酸钠(odium oxybate,SXB)可以减少1型发作性睡病患者的N1%及WASO%,增加慢波睡眠,起到改善睡眠片段化的作用,且上述睡眠参数的改变与SXB的剂量呈正相关[13]。
本研究中,1型发作性睡病组与对照组比较,N1%增加,N3%减少,WASO%增多等,但睡眠效率、醒觉指数、周期性腿动指数、AHI等参数差别并无统计学意义,与文献报道存在差异,考虑与以下影响因素有关:(1)病例数。本研究中入组病例为11例,病例数较少,可能影响结果。(2)病程长短。本研究中入组病例病程从3月到6年不等,而Lopez等研究发现,1型发作性睡病患者随着时间的变化脑脊液中的Hcrt-1浓度水平也在不断变化[14]。病程长短是否影响夜间睡眠结构,有待进一步研究。(3)Hcrt浓度。由于实际条件限制,所有入组病例均为临床诊断,未能进行脑脊液Hcrt浓度测定,Hcrt浓度差异也可能影响研究结果。Hansen等对109例发作性睡病(1型发作性睡病67例,2型发作性睡病42例)进行回顾性研究,发现脑脊液中Hcrt-1浓度水平最低患者的夜间睡眠状态最为不稳定,Hcrt-1浓度水平越低,醒觉和睡眠之间的转换越频繁[15]。
猝倒发作表现为清醒期突然发生的双侧骨骼肌肌张力下降而意识相对保留,通常由大笑、高兴等积极的情绪诱发[1],它的特征是保持意识,阵发性高同步θ节律很可能是猝倒发作初始阶段的特征性脑电图改变[16]。本研究中,视频PSG+16导脑电图监测过程中,无患者猝倒发作,在监测过程中所有病例均未发现痫样放电。猝倒发作需与癫痫失张力发作鉴别,典型的失张力发作表现为部分或全身肌肉张力突然降低导致点头、张口或躯干失张力跌到或猝倒发作,意识障碍不明显,发作后立即清醒和站起,发作前无明显诱因,发作时脑电图提示多棘-慢波或低电位活动。临床表现及脑电图可作为二者的鉴别要点。总之,1型发作性睡病患者存在夜间睡眠结构紊乱、睡眠片段化现象。

