光交联丝素蛋白水凝胶的蓝光引发体系
孙广东, 黄 益, 邵建中, FAN Qinguo
(1. 浙江理工大学 生态染整技术教育部工程研究中心, 浙江 杭州 310018; 2. 麻省大学达特茅斯分校 生物工程系, 马萨诸塞州 北达特茅斯 02747)
蚕丝具有色泽光鲜、天然无毒、性能优异等特点,广泛应用于纺织、食品加工等领域。针对其组成和结构的研究已长达50年,其主要成分的研究近年来已较为成熟。蚕丝的主要成分是丝素蛋白(SF),约占蚕丝总成分的 75%~80%[1]。丝素蛋白是一种天然的高分子蛋白质,具有优异的生物相容性、可降解性等。得益于其良好的物化性能,丝素蛋白被广泛应用于纺织品、食品、化妆品等领域,并不断向生物医学等多个领域拓展[2-3]。目前生物医用蚕丝蛋白材料是指再生丝蛋白(RSF),是由蚕丝溶解获得的蛋白质。丝素蛋白水凝胶具有特定的有序结构,可调的力学性能,低免疫原性、生物降解性和类细胞外基质结构,是组织工程支架、医用纺织品、生物传感器等材料的良好选择[4]。
常规的丝素蛋白水凝胶主要是通过加入醇类、表面活性剂[5],改变温度、浓度、pH值、辐照条件、离子强度(包括钙离子、钾离子等)或者超声、剪切处理等[6-8]条件促进丝素蛋白分子发生构象转变[9-11],或通过加入化学交联剂[12-14](如戊二醛、酪氨酸酶、京尼平等)实现丝素蛋白链与交联剂间的共价键交联,从而构建三维的高分子凝胶网络。然而上述方法往往难以同时满足丝素蛋白水凝胶对生物活性、凝胶效率及凝胶强度的要求,限制了其进一步的应用。如何高效、安全地制备高强度丝素蛋白水凝胶,对开发人造皮肤/器官等高端医用纺织品、新型组织工程支架等具有重要意义。
将光交联技术与丝素蛋白水凝胶相结合,可实现丝素蛋白水凝胶的高效可控制备。研究者通过化学改性制备了可光交联的丙烯酸酯化[15]或降冰片烯功能化[16]的丝素蛋白大分子,经自由基光聚合/巯基烯反应实现了丝素蛋白化学凝胶的高效制备。2003年,核黄素(维生素B2)在370 nm紫外线下与丝素蛋白光偶合交联(二酪氨酸)制备胶原蛋白水凝胶,并首次应用于圆锥角膜的治疗[17],该研究工作无需对丝素蛋白进行化学改性。Applegate等[18]以核黄素为光引发剂在紫外光/可见光下实现透明、有弹性的丝蛋白水凝胶的制备,并用于圆锥角膜的修复,有望实现无风险的视力矫正,以减轻永久性手术并发症;但该方法制备的丝素蛋白水凝胶普遍存在凝胶时间(>30 min)长、凝胶强度(<100 Pa)低等问题,存在极大的局限性。此外,高能量紫外光易使具有生物活性的复合物质(细胞、DNA、蛋白质等)失活,同时存在固化深度浅、辐射和臭氧污染等问题,因此,有必要开发能量较高、温和的丝素蛋白水凝胶的可见光交联技术。
相较于紫外光和其他可见光,诞生于20世纪90年代的蓝光LED是一种较安全、高能的低温光源,具有安全和能量利用率高的显著优势。作为一种新型的可见光聚合技术,蓝光聚合最早应用于齿科填充领域。目前在生物医药、数码印花、3D打印等[19-21]领域均有应用。为实现高强度丝素蛋白水凝胶的快速安全制备,本文以4种生物相容性良好的光引发剂(樟脑醌(CQ)、核黄素磷酸钠(FMN)、曙红Y(EY)及姜黄素(CC))以及光敏增效剂(二苯基碘鎓六氟磷酸盐(DPI))为研究对象,对其光谱吸收特性及蓝光引发性能进行研究,在此基础上探明蓝光引发丝素蛋白光交联反应的机制,并高效、安全地制备再生丝素蛋白水凝胶。
1 实验部分
1.1 实验试剂
樟脑醌、核黄素磷酸钠、曙红Y、姜黄素、二苯基碘鎓六氟磷酸盐、丙烯酰胺(AM),分析纯,美国Sigma Aldrich公司;生丝坯布,面密度为65 g/m2,杭州万事利丝绸文化股份有限公司;纤维素透析袋,36 mm,截留分子质量为8 000~14 000 u,上海联硕生物科技有限公司。
1.2 实验仪器
Lambda-950型紫外-可见分光光度计(美国Perkinelmer公司);Q2000型Photo-DSC光量热系统(美国TA公司);MCR52型旋转流变仪(奥地利Anton Paar公司);蓝光LED(100 W,实验室自制)。
1.3 实验方法
1.3.1 丝素蛋白的溶解与浓缩
首先将生丝(已脱胶)坯布剪碎,分批加入CaCl2-CH3CH2OH-H2O三元体系(量比为1∶2∶8)中,浴比为1∶20,升温至70 ℃,振荡搅拌溶解约 3 h。将上述溶解体系冷却至室温后,转移至纤维素透析袋中,置于去离子水中透析处理3~4 d(第1天时每2 h换一次水)。将上述透析液进行离心处理(10 000 u, 20 min,25 ℃),即得到质量分数为2.5%的丝素蛋白溶液。
将丝素蛋白溶液置于纤维素透析袋中,转移至质量分数为30%的聚乙烯吡咯烷酮(分子质量为 10 000 u)溶液中进行透析浓缩处理约24 h,即可得到质量分数为8.5%的丝素蛋白溶液。
1.3.2 光交联丝素蛋白水凝胶的制备
准确称取一定质量分数(与丝素蛋白相比)的光引发剂(光敏增效剂),然后加入丝素蛋白溶液后避光搅拌至均匀溶解,得到丝素蛋白前驱液。将上述前驱液转移至模具内,在氮气氛围内于467 nm蓝光LED的照射下反应一定时间,即得到丝素蛋白水凝胶。
1.4 性能测试与表征
1.4.1 光引发剂的蓝光聚合性能测试
首先配置质量分数为30%的丙烯酰胺溶液,然后分别称取质量分数为0.5%的光引发剂(相对于丙烯酰胺质量),经超声溶解至均一后,即得到可蓝光聚合的丙烯酰胺前驱体。
采用Photo-DSC光量热系统在恒温(25 ℃)模式下对不同前驱体的蓝光聚合反应热流变化进行实时记录。准确称取7~8 mg的水凝胶聚合前驱液于敞口Tzero铝盘中,同时放置空盘作为参比样。通过400~500 nm的带通滤光片和10%衰减滤光片对200 W水银弧光灯光源进行过滤,得到一定强度的蓝光辐照光源,并通过2路光纤导入DSC炉内作为引发光源(19 mW/cm2)。为避免氧阻聚现象的发生,在辐照前5 min通入流速为50 mL/min的超纯氮气以隔绝空气。根据下式可计算光聚合速率Rp和双键转化率C[22]。
式中:ΔHt为t时刻内的聚合反应热焓,kJ/mol;ΔHm为完全反应的理论热焓,对于丙烯酸类单体双键,ΔHm=86 kJ/mol。
1.4.2 蓝光引发剂及光交联丝素蛋白光谱吸收特性
采用紫外-可见分光光度计测试4种不同的光引发剂及光交联丝素蛋白的光谱吸收特性。
分别将4种光引发剂溶解于无水乙醇中,配制成1×10-5mol/L核黄素磷酸钠、姜黄素及曙红Y的乙醇溶液与1.5×10-2mol/L樟脑醌的乙醇溶液。测试上述光引发剂溶液在200~600 nm内的光谱吸收特性。
分别配制丝素蛋白溶液(质量分数1%)、丝素蛋白(质量分数1%)-曙红Y溶液(浓度为 2 mmol/L) 2种样品,测试上述体系在200~800 nm内的光谱吸收特性。将上述丝素蛋白-曙红Y溶液置于467 nm蓝光LED的照射下分别反应20、40 min 后,测试其光谱吸收特性。
1.4.3 水凝胶聚合前驱液的蓝光流变行为测试
采用旋转流变仪与光量热单元(PCA)组成光流变系统,在振荡模式下对丝素蛋白前驱液蓝光聚合过程中的动态模量进行测试。选用CP50锥平板在 0.1 mm 间距、10%振幅及10 Hz频率的条件下,对水凝胶聚合前驱液进行扫描,在30 s避光扫描后启动蓝光辐照(19.0 mW/cm2)。由于丝素蛋白发生凝胶化反应时,随着光照的进行,其储能模量G′经历了一个较大幅度的上升过程,而损耗模量G″变化不大,损耗因子tanδ呈下降趋势,故定义凝胶点及凝胶时间tgel为储能模量G′与损耗模量G″交叉点及其出现的时间。
2 结果与讨论
2.1 光引发剂的光谱吸收特性
CQ、FMN、CC、EY这4种化合物在生物、医学、化工、食品等领域均具有广泛应用。从分子结构上看,4种化合物分子中存在共轭双键,具有刚性的平面构造和发生氧化还原反应的位点,所以具有很好的光化学活性,共轭双键的n-π*跃迁使之对蓝光具有选择性的吸收。4种光引发剂在200~600 nm区域内的光谱吸收特性如图1所示。可知,CQ、FMN、CC以及EY的乙醇溶液在可见光区域均存在吸收,其最大可见光吸收波长分别为465、446、426及515 nm。本文实验采用的蓝光光源为最大发射光波长为467 nm的蓝光LED,几种光引发剂在蓝光区域(400~450 nm)均有吸收,且均与蓝光LED的发射光波区域有重叠。

图1 4种蓝光引发剂的光谱特性Fig.1 Spectral characteristics of four blue light. (a) UV-Vis absorption spectra of FMN, CC and EY in ethanol; (b) UV-Vis absorption spectra of CQ in ethanol
与此同时,4种化合物还具有光敏特性,是重要的光敏化试剂,在光照条件下可发生光致化学反应。为验证该光敏特性,对4种溶液进行蓝光辐照实验,并测试辐照后的紫外-可见吸收光谱,结果如图2 所示。可知,樟脑醌乙醇溶液在455 nm处的光谱吸收峰随蓝光辐照后发生明显下降,而在288 nm处产生新峰并不断升高。这是因为光引发剂的共轭结构会在光解反应过程中遭到破坏,使其在可见光区的吸收不断降低,同时在紫外区产生的新光解产物的吸收峰,在宏观上表现出“光漂”现象[23]。4种化合物均出现了光漂现象,其中曙红Y最为明显。
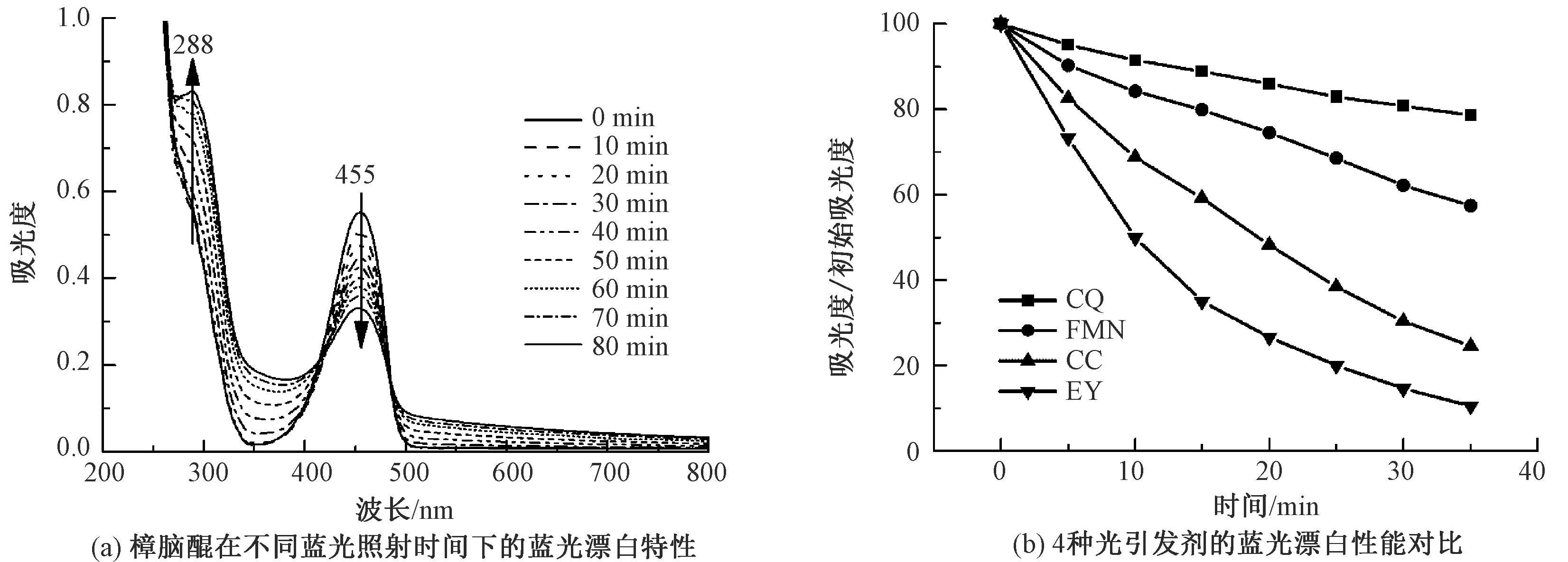
图2 蓝光引发剂的光敏特性Fig.2 Photosensitivity of blue light. (a) UV-Vis absorption spectra of camphorquinone under different blue light irradiation time; (b) Blue light bleaching properties of four photoinitiators
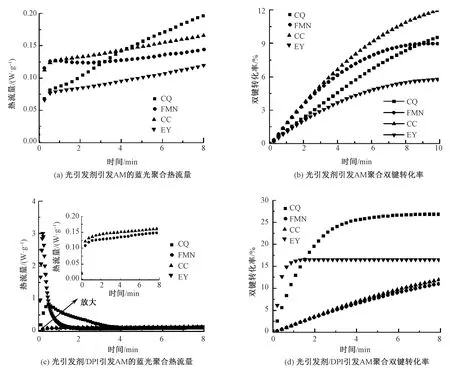
图3 不同光引发体系引发AM聚合的蓝光聚合效率Fig.3 Blue photopolymerization efficiency of AM initiated by different photoinitiation systems. (a) Heat flow of AM photopolymerized by different photoinitiators; (b) Double bond conversion of AM photopolymerized by different photoinitiators; (c) Heat flow of AM photopolymerized by photoinitiator/DPI system; (d) Double bond conversion of AM photopolymerized by photoinitiator/DPI system
2.2 光引发剂的蓝光聚合性能
根据4种化合物的光化学特性,研究者将其作为紫外光或可见光引发剂用于光固化树脂涂层、感光胶、临床应用等方面,并取得了一定研究成果[24-26]。除樟脑醌外,其他光引发剂作为蓝光引发剂的研究还较少。为进一步研究上述光引发剂的蓝光引发效率,以质量分数为30%的丙烯酰胺(AM)为水溶性活性单体,以光聚合速率、双键转化率为考察指标,测试不同光引发剂的蓝光引发效率,结果如图3所示。
由图3(a)、(b)可知,4种光引发剂均可引发AM光聚合反应,但蓝光引发速率(< 0.5 W/g)、双键转化率(< 20%)均普遍较低,即4种光引发剂在水溶液中单独引发活性单体光聚合反应的效率极低,难以满足实验要求,需要开发提高蓝光聚合效率的新方法。
有研究报道将芳基碘(/硫)鎓盐作为光敏增效剂引入樟脑醌/胺体系组成三组分蓝光引发体系,可显著提升蓝光聚合效率。在本文研究中,选用二苯基碘鎓六氟磷酸盐(DPI)作为光敏增效剂与光引发剂组成二组分蓝光引发体系改善其光引发效率。由图3(c)可知,引入DPI后,EY、CQ这2种光引发剂的聚合速率得到明显提高,尤其EY蓝光引发速率提高了40倍以上,而FMN和CC体系的引发效率无明显变化。上述现象表明:光敏增效剂DPI的加入可有效提高部分光引发剂的蓝光引发效率。由图3(d)双键转化率可知,当存在DPI时,EY、CQ的最终转化率高于FMN、CC体系,且可在短时间达到最终转化率,其中EY达到最终转化率的时间为 65 s 左右,此时的转化率约为16%。
CQ/DPI光引发体系的光引发机制如图4所示。作为Norrish II型(夺氢型)自由基聚合光引发剂,CQ吸收光能后,可由基态转化为激发态CQ*,该激发态CQ*难以单独引发单体聚合反应。DPI可通过将激发态CQ*还原成自由基CQ·的同时产生活性苯基自由基,从而引发单体光聚合反应,显著提升自由基光聚合效率。

图4 CQ/DPI双组分光引发体系的引发机制Fig.4 Photoinitiation mechanism of CQ/DPI initiation system
2.3 丝素蛋白水凝胶的蓝光交联机制
上述蓝光引发体系可用于光交联丝素蛋白水凝胶的制备。采用紫外-可见光谱对曙红Y引发丝素蛋白光交联反应的机制进行研究,其对应的紫外-可见光谱曲线如图5所示。在SF/EY体系中,由于曙红Y的存在,在517 nm处出现了特征吸收峰,随着光照的进行,丝素蛋白溶液颜色发生明显变化,且517 nm处曙红Y特征吸收峰消失,表明其发生了光化学反应。与此同时,在313 nm处出现了双酪氨酸结构的特征吸收峰。结合其他相关研究推断,丝素蛋白光交联结构主要是通过相邻酪氨酸残基间的偶合作用生成双酪氨酸结构实现的。
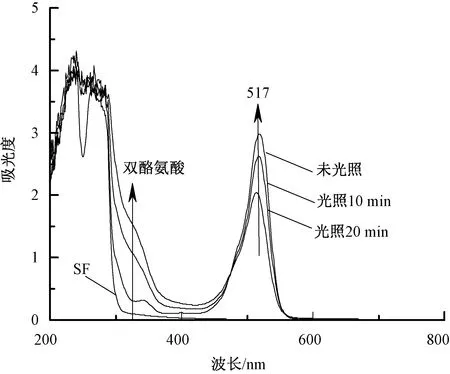
图5 曙红Y光交联丝素蛋白体系的 紫外-可见光谱曲线Fig.5 UV-Vis spectra of EY photocrosslinked silk fibroin
丝素蛋白水凝胶可能的光交联机制如图6所示。可知,光引发剂在蓝光的激发下形成分子激发态,与酪氨酸残基酚羟基邻位氢原子间发生电子转移形成自由基,相邻酪氨酸残基自由基经偶合生成双酪氨酸结构,从而实现丝素蛋白大分子链间的化学交联。

图6 丝素蛋白光交联反应及交联机制Fig.6 Photocrosslinking reaction and mechanism for silk fibroin
2.4 蓝光交联丝素蛋白水凝胶的凝胶特性
丝蛋白水凝胶的流变行为和力学性能是决定其应用的重要性能指标。在探明上述丝素蛋白光交联机制的基础上,深入探究光引发体系对丝素蛋白水凝胶光流变性能的影响,测试结果如图7所示。

图7 不同光引发体系下光交联丝素蛋白水凝胶的弹性模量、凝胶时间及损耗因子测试结果Fig.7 Storage modulus, gel time and loss factor of photocrosslinked fibroin hydrogels under different photoinitiator systems. (a) Storage modulus without DPI; (b) Loss factor without DPI; (c) Storage modulus with DPI; (d) Loss factor with DPI; (e) Gel time
丝素蛋白的凝胶化反应表现为由黏性液态向弹性凝胶态转变,凝胶点为该过程的转变点,可用于描述光交联丝素蛋白凝胶化进程。由图7(a)、(b)可知,相同质量分数的光引发剂下光交联丝素蛋白水凝胶的储能模量(<100 Pa)普遍较低,且相差不大,凝胶点出现的时间均较长,分别为:tgel(CQ)= 1 312 s,tgel(CC)=1 058 s,tgel(EY)=870 s,tgel(RF)=733 s,tgel(FMN)=333 s。表明光引发剂单独引发交联丝素蛋白的效率较低。
由2.3节已知,通过引入光敏增效剂DPI可大幅度提高光引发剂的蓝光聚合效率,因此,通过研究光引发剂/光敏增效剂双组分光引发体系引发丝素蛋白光交联反应的效率。由图7(c)~(e)可知,DPI对光交联丝素蛋白水凝胶的储能模量影响较大,在500 s光照后,CQ、EY体系均表现出较高的凝胶强度(>100 Pa),凝胶点出现时间大幅缩短(tgel(CC)=786 s,tgel(FMN)=429 s,tgel(CQ)=200 s,tgel(EY)=97 s,其中EY/DPI体系的凝胶点出现的时间最短,约为97 s。
图8示出光交联丝素蛋白水凝胶的制备过程。可知:在无DPI存在的情况下,丝素蛋白前驱液经蓝光辐照40 min后表现出凝胶现象, 但凝胶强度较低,难以形成稳定的结构。

注:(a)、(b)、(c)样品中含有的光引发剂从右向左依次为无引发剂、樟脑醌、核黄素磷酸钠、姜黄素、曙红Y。图8 光交联丝素蛋白水凝胶的制备过程Fig.8 Preparation process of photocrosslinked silk fibroin hydrogel. (a) Silk fibroin precursor before illumination; (b) Without DPI by illuminating blue light for 40 min; (c) With DPI by illuminating blue light for 10 min; (d) Silk fibroin hydrogel photoinitiated by photoinitiators for 10 min
由图8(c)可知,当DPI存在时,丝素蛋白前驱液只需光照10 min即可得到较稳定的丝素蛋白水凝胶结构,其中以EY/DPI、CQ/DPI为蓝光引发体系可制得具有较高力学强度的完整水凝胶样品,表明该蓝光引发体系的光交联性能更高。
在上述体系中,基于DPI对丝素蛋白的光交联反应具有明显的增效作用,提出了二组分光引发体系引发丝素蛋白光交联反应可能的机制。激发态光引发剂(PI*)从丝素蛋白分子上的酪氨酸残基(TH)中提取H原子并形成酪氨酸自由基(T·)和光引发剂自由基(PI-·),2个相邻的酪氨酸自由基经偶合作用形成双酪氨酸结构实现共价交联。与此同时,光引发剂自由基(PI-·)还会与DPI反应生成光引发剂分子和其他活性自由基(苯基自由基),从而减缓了光引发剂的消耗,同时还提高了活性自由基的含量,具体方式如下:
PI*+TH→PI-·+T·+H·
PI-·+DPI→PI+X·
T·+T·→T-T
3 结 论
本文研究了4种光引发剂的蓝光引发机制、引发性能及引发丝素蛋白光交联反应的可能机制,在此基础上提出了一种丝素蛋白水凝胶的安全高效制备方法。
1)与其他光引发剂相比,樟脑醌和曙红Y表现出更佳的蓝光聚合性能,与二芳基六氟磷酸碘鎓盐(DPI)组成双引发体系可大幅提升光引发聚合效率,可作为引发丝素蛋白光交联反应的蓝光引发剂。
2)通过蓝光激发光引发剂引发丝素蛋白分子链上形成酪氨酸自由基,进而在相邻链上偶合成双酪氨酸结构,从而实现丝素蛋白分子的共价交联。
3)相比于单一体系光引发剂,光引发剂/DPI二组分体系通过提高光引发剂与活性自由基的含量,可大幅提高光交联反应的效率,从而缩短光交联丝素蛋白水凝胶的凝胶时间(约97 s),同时提高丝素蛋白凝胶强度。

