男性乳腺癌的诊治进展
金菊,乔恩奇
(中国科学院大学附属肿瘤医院 浙江省肿瘤医院 a.病理科,b.乳腺外科,杭州 310022)
男性乳腺癌(male breast carcinoma,MBC)约占所有乳腺癌的1%,在男性癌症中占比不足1%[1]。MBC发病率因地区和种族不同存在很大差异,非洲最高,其次是北美洲及欧洲,亚洲最低[1]。MBC的发病率逐年上升,并随年龄增长而升高[2]。由于MBC发病率极低,因此难以开展前瞻性的临床随机对照研究。与女性乳腺癌相比,MBC存在许多鲜明特征,医护人员对MBC的认识不足,对MBC的诊治缺乏理论指导及实践经验,不能做出恰当的治疗决策,这也是MBC相对女性乳腺癌预后不佳的原因之一。目前尚无诊断MBC的临床规范或治疗指南,MBC的诊治多参照女性乳腺癌,尽管男性与绝经后女性体内激素环境相似,但仍有本质区别,完全沿袭女性乳腺癌的治疗方案来治疗MBC仍存在较大争议。男性对乳腺关注度低,多数发现早期症状未能及时就诊,进而延误病情。为改善MBC患者的预后,临床医师应加强学习,尽可能做到早期诊断,对患者病情进行全面充分的评估,采取最安全有效的个体化和综合性的治疗措施。现就MBC的流行病学、临床及病理诊断、治疗、预后予以综述。
1 流行病学和风险因素
MBC在流行病学和风险因素等方面存在诸多差异,见表1[3-12]。在美国,2018年有约2 500名男性被诊断为乳腺癌,约有500名男性死于该疾病[13]。SEER数据库中MBC的年龄校正发生率由1975年的0.85/10万增加至2011年的1.43/10万[14]。男性终生罹患乳腺癌风险为1∶1 000,女性为1∶8[3]。MBC发病随年龄增加而稳定增加,平均诊断年龄高于女性[6]。黑人男性发病风险高于非西班牙白人男性[14-15]。一级亲属罹患乳腺癌者发病风险增加1倍[16]。
乳腺癌耐药蛋白(breast cancer resistance protein,BRCA)突变是MBC最明确的风险因素,5%~10%的女性乳腺癌有突变,有此类基因改变的女性70岁时累计发生乳腺癌的风险为45%~65%[4]。在70岁的男性中,BRCA1突变携带者的累积风险约为1.2%,而BRCA2突变携带者则为6.8%[5]。美国国立综合癌症网络指南推荐男性携带BRCA突变者应行乳腺自检训练,每年一次乳腺临床检查,BRCA1突变者筛查从35岁开始,BRCA2突变者筛查从45岁开始[11]。
另有几个基因与MBC发生风险增加相关。细胞周期检测点激酶2编码细胞周期检查点激酶,参与DNA修复,其截断突变(细胞周期检测点激酶2*1000delC)使MBC风险增加10倍[17]。然而,也有病例研究的结果并不一致[18-19]。乳腺癌易感基因2编码一种BRCA2相互作用蛋白,可增加女性乳腺癌发生风险[20]。MBC中乳腺癌易感基因2突变发生率为1%~2%[21]。CYP17和RAD51B单核苷酸多态性、染色体2q35、5p12、6q25.1、10q26.13、16q12.1改变均增加MBC风险[22-24]。人第10号染色体缺失的磷酸酶及张力蛋白同源的基因和雌激素受体(estrogen receptor,ER)突变也与MBC相关[25-26]。
放射线暴露是MBC的风险因素[27]。最有力的证据来自对日本原子弹爆炸幸存者的研究,1958—1998年跟踪的45 880名日本MBC的发病率呈升高趋势,证明辐射与MBC有关[28-29]。雄激素水平与MBC发病风险无相关性,而与雌激素水平有关[30]。雌激素水平增加的情况也与MBC有关,包括男性乳房发育症、肝脏疾病、睾丸异常和肥胖等[31-32]。
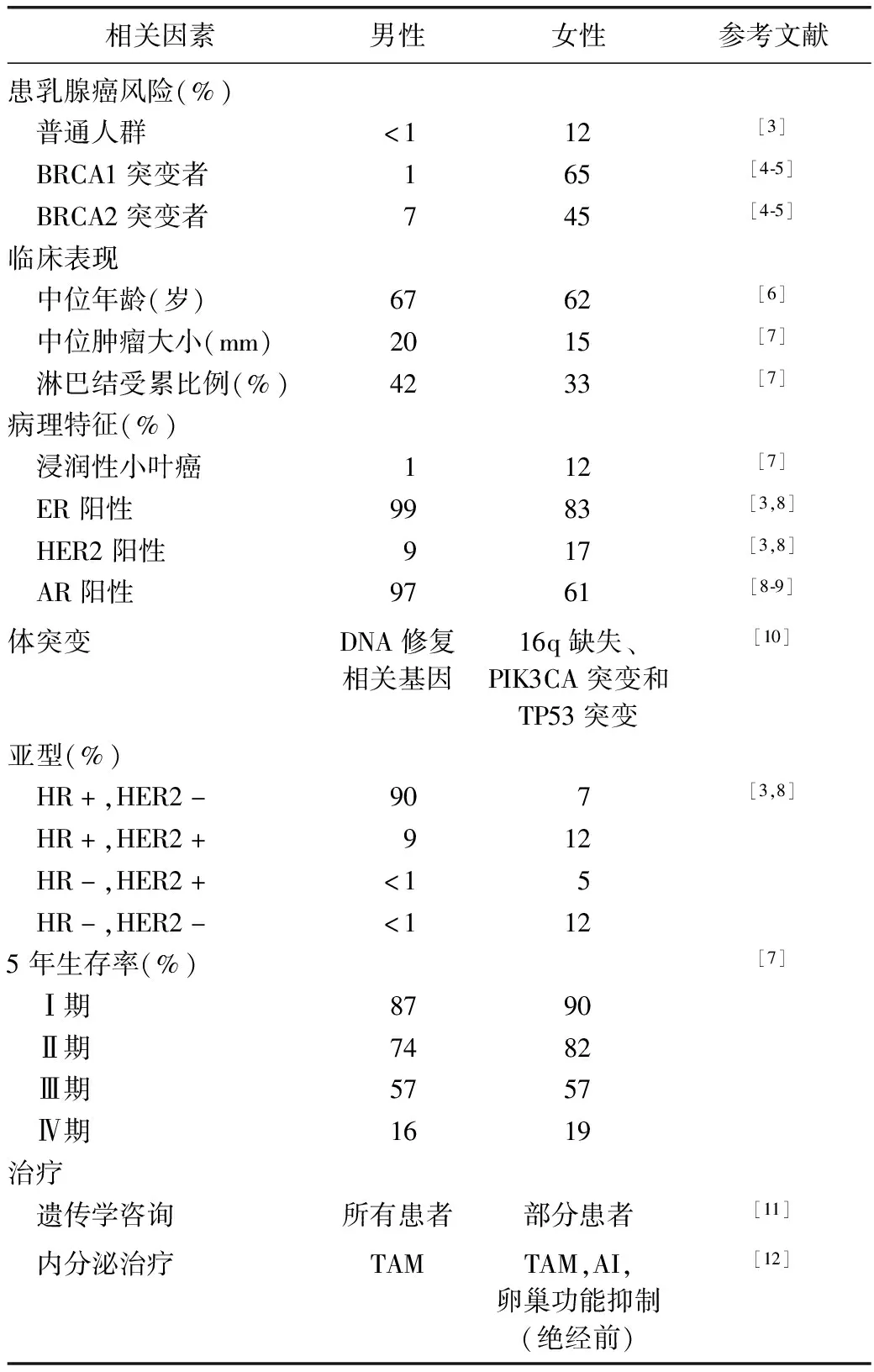
表1 男性和女性乳腺癌的主要差异
BRCA:乳腺癌耐药蛋白;ER:雌激素受体;HER2:人表皮生长因子受体2;AR:雄激素受体;HR:激素受体;TAM:他莫昔芬;AI:芳香化酶抑制剂;PIK3CA:磷脂酰肌醇激酶-3催化亚基α基因;TP53:肿瘤蛋白p53基因
2 临床及病理诊断
多数MBC表现为无痛性乳晕后肿块,其他临床表现包括乳头回缩、出血、皮肤溃疡和腋窝淋巴结肿大[33]。最需鉴别的是男性乳房发育,这也是最为普遍的疾病。如怀疑癌症应进行乳房成像。影像学有助于鉴别诊断,美国放射学会推荐年龄<25岁男性发现性质不明乳腺肿物时应行超声初检,年龄≥25岁男性推荐钼靶初检,如钼靶不能明确或提示癌症可能时推荐进一步超声检查[34]。MBC钼靶下多表现为乳晕后偏心性肿块,边缘不规则或针刺状[35]。怀疑乳腺癌时应进一步行空心针活检明确诊断。由于公众健康意识较低和缺乏筛查项目,通常诊断时MBC的肿瘤体积更大,也更易发生区域淋巴结转移[7]。MBC分期与女性相同,无性别差异[12]。由于MBC与BRCA突变有很强的相关性,与女性乳腺癌患者不同,男性患者应由癌症遗传学专家讨论遗传学检查[11]。
由于一般男性人群不推荐乳腺X摄片筛查,因此导管原位癌极为少见,仅约10%的MBC为原位导管癌[6]。原位小叶癌较罕见,因为在男性乳房中通常不会出现典型的末端小叶。大多数MBC为浸润性癌,浸润性导管癌最多见,较少见的组织学类型包括乳头状癌(2%~3%)和黏液性癌(1%~2%)[6,36]。尽管小叶癌在女性乳腺癌中约占12%,但在MBC中仅有1%~2%[6,36]。
MBC ER阳性、人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性的比例高于女性,与绝经后、高龄女性相似[6,37-38]。在国际MBC计划研究中,对1 483例患有乳腺癌的男性肿瘤样本进行了病理复审,结果显示,99%的肿瘤ER阳性,82%孕激素受体阳性,97%雄激素受体阳性,仅9%的HER2阳性,42%为Luminal A型,49%为Luminal B型(HER2阴性),9%为HER2阳性,三阴性乳腺癌不足1%[38]。其他对MBC进行基因组分析的研究表明,大多数病例是Luminal A型或Luminal B型[10]。
虽然MBC的某些体细胞突变与女性ER阳性乳腺癌相似,但突变频度不同,男性肿瘤较少发生16q缺失、磷脂酰肌醇-3-激酶催化亚基α基因突变、肿瘤蛋白p53基因突变和影响磷脂酰肌醇-3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白通路的基因突变,而更易发生影响DNA修复的基因体突变[10]。一项采用聚类法基因表达的研究显示,MBC存在两种独特亚型:M1和M2,两者不同于女性乳腺癌的固有亚型[39]。这说明MBC与女性存在明显的生物学差异,有潜在的临床意义。
3 治 疗
目前尚无涉及MBC局部治疗的临床随机对照研究,现有治疗方法多借鉴女性乳腺癌。新诊断女性乳腺癌患者常行保乳手术(即保乳+全乳放疗),但大多数MBC行乳房切除联合腋窝淋巴结清扫或前哨淋巴结活组织检查[38]。虽然不常规采用,但观察性研究显示男性保乳手术患者的生存与乳腺切除手术患者的生存相似,且美容效果和功能更佳,提示女性外科手术的数据可以安全地应用于男性[40-42]。前哨淋巴结活组织检查是临床腋下淋巴结阴性女性乳腺癌的标准术式,该方法对MBC同样是可行和准确的[43]。
根据女性乳腺癌指南,MBC也应行术后辅助放疗。临床实践中,MBC辅助放疗常应用不足。SEER数据(1988—2012年)显示仅42%的Ⅰ期MBC患者接受了保乳术后放疗[40]。国际上,与上述情况相似,在1990—2010年,几乎一半的MBC保乳术后未接受放疗[38]。目前还没有随机研究评估男性全乳切除后放疗的作用,但观察性研究显示放疗对淋巴结阳性MBC有获益[44-45]。
与女性相似,复发风险高的MBC应给予化疗以及抗HER2治疗[12]。1974—1988年,美国国家癌症研究所开展了一项旨在评估MBC辅助化疗的前瞻性研究,入组了31例伴淋巴结转移的Ⅱ期MBC患者,所有患者行全乳切除加12周期环磷酰胺+丝裂霉素+5-氟尿嘧啶化疗,随访5年、10年和20年生存率分别为80%、65%和42%,优于历史对照[46]。观察性队列研究提示MBC辅助化疗能改善患者生存期[47-48]。因为男性患者诊断年龄偏大,预期寿命较女性短,临床医师应充分权衡MBC化疗的潜在风险与获益[6]。
Oncotype DX 21基因与MammaPrint等基因检测的应用正在增加,用于评估女性乳腺癌预后以及预测化疗是否获益。几项Oncotype DX 21基因应用于MBC的研究结果表明,MBC与ER、增殖和侵袭相关的基因平均表达评分高于女性,平均复发评分与女性相似,但复发评分≥31分和<11分的患者明显高于女性(12%比7%,34%比22%)[49-50]。SEER数据库登记的322例MBC复发评分数据结果支持Oncotype DX 21基因检测对MBC预后预测的价值[49]。复发风险<18的男性患者5年乳腺癌特异性生存率达99.0%,18≤复发风险<30者为95.9%,复发风险≥31者为81.0%,女性则分别为99.5%、98.6%和94.9%[49]。上述数据表明,男性高复发评分患者预后较女性差。
大多数MBC激素受体阳性,内分泌治疗是癌症管理的重要组成部分。由于男女激素产生的途径不同导致内分泌治疗疗效的差异。激素受体阳性MBC的标准辅助内分泌治疗是5~10年的他莫昔芬。与女性乳腺癌相同,治疗时长需个体化,应权衡复发风险和药物不良反应[12]。他莫昔芬在MBC的转移治疗中已明确有生存获益,辅助他莫昔芬治疗的观察性研究也已提示生存获益[33,51]。他莫昔芬的不良反应包括静脉血栓、白内障、性功能异常、情绪变化、潮热和腿痛性痉挛。很少有研究专门评估男性和女性之间不良反应的差异[52]。
芳香化酶抑制剂(aromatase inhibitor,AI)对MBC的疗效仍不明确,可能低于女性。以人群为基础的系列研究显示AI辅助治疗的生存率较他莫昔芬低[53-54]。研究显示,健康男性使用阿那曲唑后体内雌二醇水平下降50%,睾酮水平增加60%,黄体生成素和卵泡刺激素水平增高[55]。健康男性使用阿那曲唑后雌二醇水平仅抑制到14.1 pg/mL(52 pmol/L)[56],而绝经后女性阿那曲唑可将雌二醇水平抑制到1 pg/mL(3.7 pmol/L)以下[57]。AI无法完全抑制男性体内雌二醇的原因可能与下丘脑和垂体回路有关,联合使用促性腺激素释放激素(gonadotrophin releasing hormone,GnRH)类似物可解决这一问题。对不适合他莫昔芬治疗的男性,如有血栓病史患者,可考虑GnRH类似物±AI辅助内分泌治疗,单药AI不被作为MBC标准辅助治疗途径。
男性转移性乳腺癌的内分泌治疗途径包括治疗药物与女性类似,包括他莫昔芬、AI和氟维司群。无论单药AI还是与GnRH类似物联合均有治疗反应,但后者疗效可能更优[58-60]。氟维司群,一种选择ER下调剂,对激素受体阳性男性转移性乳腺癌也有积极的治疗作用。一项纳入23例MBC患者的汇总分析显示,氟维司群单药治疗可使26%的患者部分缓解,48%疾病稳定,总体反应率与女性患者相似[61]。但目前对比氟维司群单药与氟维司群联合GnRH类似物疗效的研究较少见。与单独内分泌治疗相比,周期蛋白依赖性激素抑制剂或哺乳动物雷帕霉素靶蛋白抑制剂联合内分泌治疗可明显改善女性乳腺癌预后[62]。美国国立综合癌症网络指南推荐男性转移性乳腺癌的治疗与绝经后女性一致,AI单药治疗的有效性可能不及AI与GnRH类似物的联合治疗[12]。因此,周期蛋白依赖性激素抑制剂或哺乳动物雷帕霉素靶蛋白抑制剂作为联合内分泌治疗的一部分治疗男性转移性乳腺癌是一种合理选择。
4 预 后
研究显示MBC的预期生存期与总生存率低于女性,主要与MBC诊断时分期较晚、年龄较大有关,而且男性比女性的预期寿命短[7,63]。欧亚的研究显示,校正分析前MBC的5年生存率低于女性乳腺癌,但通过人口统计学特征、疾病分期和治疗校正后生存率高于女性[63]。诊断时年龄较大、疾病分期晚以及三阴性乳腺癌的MBC相比年龄较小、疾病分期早以及非三阴性乳腺癌生存率低[64]。MBC患者患第二原发癌风险是增加的,再次患乳腺癌的风险接近2%[65-66],而且MBC患者黑色素瘤、小肠癌、直肠癌、胰腺癌、前列腺癌和淋巴血液系统肿瘤发生风险也会增加[66-67]。虽然男性和女性乳腺癌生存率均在不断改善,但MBC生存率的改善较女性差。目前尚不清楚上述风险的增加是否与BRCA的基因突变、患者更关注健康检查或其他因素有关。
5 展 望
目前关于MBC仍有许多问题不明确,应深入研究MBC的生物学特征,特别是与女性乳腺癌的差异,以确定这种差异是否对治疗有帮助。国际MBC项目收集了1 400多例MBC样本进行分析,包括RNA测序等均在进行中[8]。这项国际多中心研究的最终目标是开展MBC治疗的临床试验。既往大部分临床研究仅限女性乳腺癌,但目前许多临床研究男女患者均可入组[68-70]。只要切实可行,有关乳腺癌治疗的研究都应放宽对患者性别的限制,以建立MBC治疗的证据基础。上述研究证明了MBC治疗的临床试验是可行的,继续致力于此类研究对提高MBC的治疗标准至关重要。

