锂离子电池正极材料的研究现状
刘金玉 焦连升 王 艳 刘晓辉
(河北民族师范学院 化学化工学院,河北 承德 067000)
据统计,我国70%的能源来自化石燃料的燃烧产生,化石燃料为不可再生能源,其大量使用既造成了能源危机,也污染了环境。近年来,全国各地雾霾天气全年占比逐年增加,温室效应也日趋严重。因此,可再生能源如太阳能、风能、地热能、潮汐能等一度成为人们关注的焦点,但这些能源是周期性和间断的,需要对产生的能量进行存储。而锂离子电池由于具有较高的能量密度和优异的循环性能,是当前最具前景的储能技术。
1 锂离子电池正极材料研究现状
目前商用的正极材料仍以锂嵌入材料为主,如图1所示。锂的电化学嵌入和脱嵌反应中,宿主材料的晶格原子只发生位移而不产生扩散性重组,因此晶体结构没有大的变化,保证了材料较长的使用寿命。固体电极的氧化还原反应中包括电子的传输和与之同步进行的离子的嵌入和脱嵌,因此电极材料应该有良好的电子和离子传输性能。锂离子的传输通道有一维(TiS3),二维(LiMO2)和三维(LiMn2O4)[1]。目前对正极材料的研究主要分为两大类:一是锂的过渡金属酸盐LixMyOz,其中M=Co、Ni、Mn、V等过渡金属,包括层状化合物、尖晶石型化合物等;另一类是聚阴离子型化合物,即:含有四面体或八面体阴离子结构单元(XOm)n-,其中X=P、S、As、Si、Mo等的化合物。
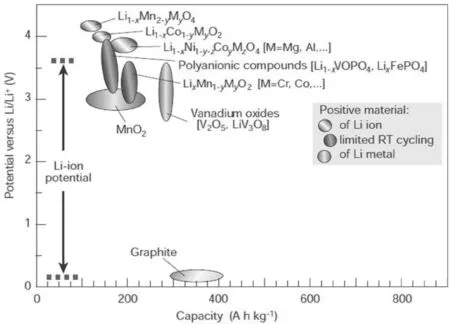
图1 主要正极材料电势与比容量的比较[2]
1.1 层状结构的正极材料
层状结构的LiCoO2在上世纪九十年代就被作为,第一支商品化的锂离子电池正极材料得到应用。LiCoO2的层状结构是α-NaFeO2型的,属岩盐型面心立方结构。如图2所示,Li+与Co3+半径有差异(分别为0.70和0.52Å),Li-O是离子键而Co-O是共价键,这诱导了在111方向连续面上的阳离子有序,从而引起晶格的轻微畸变[3],空间群为R-3m。钴酸锂只有在嵌锂态才是热力学稳定的,化学计量态下则是电子绝缘体。早在1980年,J.B. Goodenough首先提出将LiCoO2作为锂离子电池的正极材料,循环过程中可以观察到一系列的可逆相变,这可能是由于电子跃迁和锂离子/空穴有序引起的[4]。钴酸锂的可逆嵌入脱嵌电压为4.2V vs.Li+/Li,比容量约130-140mAhg-1。制备层状LiCoO2的方法包括喷雾干燥法、固相法、溶胶-凝胶法、水热法、沉降法和喷雾分解法等,制备方法、Li/Co摩尔比以及热处理时间都对材料的电化学性能有显著的影响。但是钴的价格昂贵,特别是钴酸锂在充电态时的稳定性不理想,这些限制了该材料在动力汽车方面的应用。
LiNiO2与LiCoO2结构相同,充电后期更稳定,且价格较低。但很快研究人员发现化学计量比的镍酸锂很难合成,实际的组成往往是Li1-zNi1+zO2(z>0,Li/Ni<1)。由于间晶片空间被锂离子和额外的镍离子占据,层状结构不理想。多余的镍离子使得脱嵌时间晶片空间局部坍塌导致锂离子的扩散更加困难,这对材料的电化学性能的影响是致命的。为了优化其组成和结构以增加可逆性,部分取代镍离子改变其组成为LiNi1-yMyO2可以有效修饰过渡金属周围的晶体场[6],典型的例子是用钴和铝部分取代镍。对于钴取代物LiNi1-yMyO2(0≤y≤1),固溶体行为的出现说明结构中Li位置没有多余的Ni2+,从而稳定了层状结构,这是因为Co3+的离子半径较小,使Ni位置的晶体场得到了加强所致。Al3+的离子半径虽然与钴相似,但是组成中y的含量只有0.15左右,而y超过0.25时相分离发生之前就观察到阳离子的分离[7]。这两个体系稳定性的差异可以用不同离子间电负性的区别予以解释。钴取代后材料的循环性能和首效都获得较大的提高,充电时因为过渡金属离子处于不稳定的高价氧化态,材料处于亚稳态。高温下充电态的材料发生降解,金属离子还原引发与电解液溶剂的放热反应,同时伴有气体产生,这些不可逆相变使得晶体结构畸变为尖晶石型从而使循环性能下降。铝取代后,一方面过渡金属周围的晶体场得到增强,稳定了高价氧化态金属离子;另一方面,Al3+被稳定在四面体空穴后阻止了阳离子从晶片向间晶片位置的移动,材料的相变得到延缓,在充电时的热稳定性能大幅提高,从而提高了使用的安全性。Guilmard等[8]结合钴和铝的优点,制备v了Li(Ni1-y-zCoyAlz)O2材料。在3.7V(vs Li+/Li)下的可逆容量为185mAhg-1,已经在运输和航天领域得到商业化应用。
从2000年开始,富锰铬的层状材料如Li[Li0.2Mn0.4Cr0.4]O2方面的研究工作为层状材料家族注入了新鲜血液。人们又重新开始考虑Dan等人[9]1992年提出的LiNi1-yMnyO2体系。Ohzuku等[10]制备了LiNi1/2Mn1/2O和LiNi1/3Mn1/3Co1/3O2材料,使得三元材料LiNi1/2-yMn1/2-yCo2yO2迅速得到商业化应用。三元材料中钴是三价,镍是二价,锰是四价的。这些材料的结构比较复杂,晶片间的阳离子有序减小了较小的Mn4+、Co3+与大的Ni2+之间的应力。三元材料商用的主要原因在于其热稳定性比钴酸锂等层状材料有很大的改善,同时保持了较高的电化学性能(3.7V下的可逆容量为170mAhg-1)。充放电过程中,只有钴和少量的镍具有电化学活性,锰离子即使在高温下也始终保持不变,这是热稳定性好的主要原因。

图2 层状LiCoO2结构示意图[5]
三元材料的合成主要采用共沉淀法,其中也包括具有浓度梯度的三元材料。图3即为典型浓度梯度三元材料的结构示意图。中心富镍的LiNi0.86Co0.10Mn0.04O2确保材料的高容量,表面富锰的LiNi0.70Co0.10Mn0.20O2保证了材料的热稳定性,从而产生了协同效应。另外一种富锂、富锰的层状材料(1-y)Li2MnO3·yLiMO2(M=Mn,Co,Ni)(Li/M>1)也是当前研究的一个热点,原因在于其有较高的可逆容量(>230mAhg-1),储量丰富的廉价锰也符合社会的要求,但是放电过程中电压的衰减将使得能量密度降低,还要做大量研究工作以达到实用化水平。

图3 三元浓度梯度层状材料结构图[11]
1.2 尖晶石结构的正极材料
尖晶石结构的锰酸锂LiMn2O4早在上世纪八十年代就开始研究用于锂离子电池的正极材料,九十年代开始考虑替代钴酸锂,因为锰酸锂的放电电压3.95-4.1V,容量148mAhg-1,与钴酸锂很接近同时锰的储量和价格也符合经济和生态要求。LiMn2O4也是致密的面心立方结构,空间群Fd-3m。与α-NaFeO2型结构晶体的主要区别在于阳离子在阴离子骨架中的分布不同。
如图4所示,锰离子占据一半的八面体空穴(16d),锂离子占据八分之一的四面体空穴(8a),从而产生了三维立体结构而不再是层状的。这种材料的倍率性能良好,充电态的热稳定性也好。但是,充放电循环过程中电解液降解产生的HF会使得锰发生溶解,从而使容量发生衰减。改善的方法包括阴阳离子取代和表面修饰。
LiNi0.5Mn1.5O4是LiMn2O4的一个有趣的衍生物,镍是二价而锰是四价,电势为4.7V,可逆容量148mAhg-1。氧化还原过程在Ni2+/Ni3+和Ni3+/Ni4+间发生,与Mn3+/Mn4+无关,这使得材料对锰的溶解不敏感。研究最多的是它的非化学计量形式LiNi0.5Mn1.5O4-δ和LiNixMn2-xO4(x <0.5),特别是前者具有更优良的电化学性能。但是这些高电压材料受限于当前的电解液体系(一般不超过4.5V),容量衰减很快,因此开发出新的溶剂或添加剂来扩大电解质溶液的稳定电势窗口对这些材料的应用显得尤为重要。
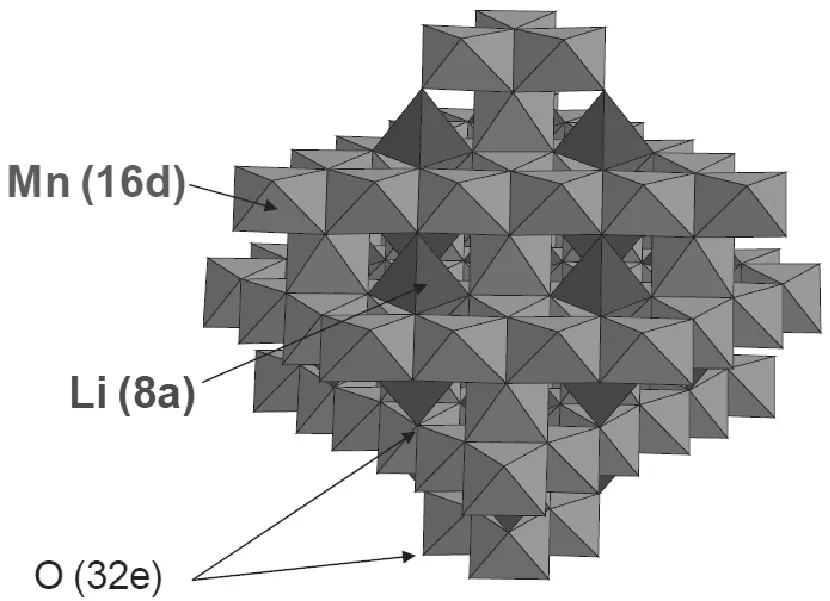
图4 尖晶石锰酸锂的空间群结构[12]
1.3 橄榄石结构的聚阴离子型LiMPO4(M=Fe,Mn,Co,Ni)正极材料
如上图5,LiFePO4的橄榄石结构由FeO6八面体和PO4四面体通过边角连接而成,空间群为Pnma。这种3D结构划定了b和c方向的通道,锂离子位于八面体空穴。锂的扩散优先沿着b轴进行,LiO6八面体通过共享bc面的边形成直线链。
LiFePO4放电电压3.45V,由于橄榄石环境中(PO4)3-聚阴离子的诱导效应导致Fe3+/Fe2+能量降低,比已知的铁基正极材料的电压要高。理论比容量170mAhg-1,能量密度约为586Whkg-1,略高于钴酸锂。其循环性能和充电态的热稳定性都十分优良,前驱体材料来源丰富而且毒性小。因此LiFePO4一直是开发环境友好、低成本、性能优良的正极材料中的研究热点。
LiFePO4脱锂时是LiFePO4和FePO4的两相反应过程,电压3.45V。尽管这两相的电子导电性和离子导电性都不好,但是反应的动力学速度却比较高。LiFePO4/FePO4界面高浓度的载荷子(电子和锂空穴)、电子和锂离子的耦合传输、LiFePO4和FePO4体积变化导致的局部变形都使得界面的嵌锂动力学速度很高[14]。锂的脱/嵌行为被描述为两相沿着晶体a向与bc面平行的快速移动。但是机理十分复杂,如图6所示,比如充放电曲线,会随着粒径的大小以及倍率而变化。与体积变化(8%)导致的形变有关的相界面表面能,在粒径小于50nm时会迅速增加,这导致两相区减少,相应的缩短了充放电曲线的3.45V电压平台[15]。同时,LiFePO4的电子导电和离子导电性都不好,如果要达到170mAh g-1的容量性能,要同步改善电子和离子导电性能。导电性能的改善可以通过减小一次颗粒的粒径(几十纳米)来实现,随着粒径减小,缩短了锂离子扩散路径,也改善了电子流动性能。此外,通过有机化合物裂解在颗粒表面包覆碳和金属粒子,可以有效改善电极内部的电子导电性。
过去十几年对LiFePO4的基础研究一方面说明了其机理的复杂性,另一方面也展示了理论与实验相结合在研究复杂体系时的力量,并最终使LiFePO4获得了市场应用。容量接近理论容量170mAh g-1,即使在高倍率下也具有非常好的循环性能,充电态下的化学稳定性和热稳定性也十分优越。前面介绍的层状材料在300℃以下就开始放出氧气并与电解液溶剂发生放热反应,LixFePO4中Fe-O键能防止氧的释放,在350℃以上的化学性能也相当稳定。LiFePO4的主要不足是电压低,因此限制了其使用时的能量密度。

图5 LiFePO4空间结构示意图[13]
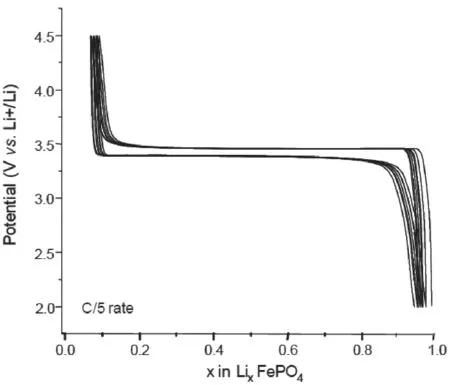
图6 LiFePO4充放电曲线
为了提高材料电压继而提高能量密度,与LiFePO4同步研究的橄榄石结构的化合物还有斜方晶系空间群也为Pnma的LiMnPO4、LiCoPO4和LiNiPO4,它们的电压分别为4.1V、4.8V和5.1V。但是即便是使用可以改善电极/电解液界面性质的添加剂,LiCoPO4和LiNiPO4的研究受传统电解液的影响受到很大的限制[16]。LiMnPO4研究工作较多,但是锰离子的八面体空穴受Jahn Teller效应以及嵌锂态和脱锂态体积变化的影响而畸变严重,反应动力学很慢。而且LiMnPO4的电子和离子导通能力比LiFePO4还差,改善的手段包括碳包覆、纳米化和用Mg或Fe部分取代Mn[17]。
1.4 其他聚阴离子型正极材料
鉴于橄榄石结构化合物如LiFePO4的优异性能,研究人们越来越多地把研究方向转移到其他聚阴离子型材料,以求获得比目前商业化的LiCoO2,NCA,NMC,LiMn2O4和LiFePO4材料具有更高能量密度的正极材料。其中包括LiVPO4F、LiFeSO4F、涉及多电子反应的Li2MIISiO4(M=Fe,Mn,Co)和具有NASCION结构的Li3V2(PO4)3。
LiVPO4F与矿物LiFePO4·OH(羟磷锂铁石)结构相同,三斜晶系,空间群P-1,PO4四面体和VO4F2八面体共同组成三维骨架。平均放电电压4.2V,材料优化后可逆容量可达155mAh g-1。LiVPO4F具有较高的离子导通能力但电子导电性差,这可以通过碳包覆得到改善。充电态下的热稳定性也优于LiFePO4,使其极具竞争力。
LiFeSO4F是新型锂离子电池正极材料,FeO4F2八面体与F键沿c轴共角连接成链,再与SO4四面体共角形成三维结构。羟磷锂铁石结构的LiFeSO4F平均放电平台3.6V,可逆容量130-140 mAh g-1,略低于LiFePO4,但是热稳定性比较高。氟磷铁锰矿结构的LiFeSO4F放电电压3.9V,但是电化学性能不如羟磷锂铁石结构的且容量衰减较快。
Li2MSiO4理论上每个单元可以脱/嵌两个锂离子,理论容量330 mAh g-1,几乎是橄榄石结构材料的2倍,但这类材料的离子和电子导电能力要比LiFePO4低几个数量级,要通过纳米化和碳包覆来解决。由于Fe和Si储量丰富且价格低廉使得Li2FeSiO4方面的研究工作最多,Li2FeSiO4是斜方晶系,空间群Pmn21。电化学结果表明,Li2FeSiO4的放电电压只有2.9V,稳定的可逆容量也只有140 mAh g-1。类似地,Li2MnSiO4的稳定可逆容量也只有85-100 mAh g-1。虽然理论上Li2CoSiO4电压可达5V,但由于缺乏相应的电解液以及Co的毒性和昂贵的价格限制了其研究。已有的研究结果表明其容量的衰减很快,首次不可逆容量损失也很大。
作为锂离子电池正极材料,NASCION结构的磷酸钒锂(Li3V2(PO4)3)被认为很有发展潜力。单斜的Li3V2(PO4)3属于P21/n空间群,FeO6八面体和PO4四面体通过共用氧原子形成三维网络结构,如图7所示。
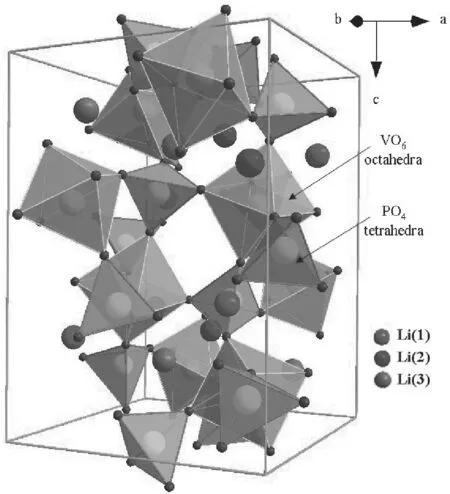
图7 Li3V2(PO4)3结构示意图[18]
单斜的Li3V2(PO4)3结构稳定,离子导电性优于橄榄石结构的LiFePO4。完全脱锂时理论比容量可达为197 mAh g-1,放电电压高,循环性能和热稳定性都比较好。采用碳包覆、纳米化[19]、金属离子掺杂可以改善其较低的电子电导率。
Li3V2(PO4)3充放电机理与充放电的电压区间有关。电压窗口为3.0-4.8V时(见图8),充电时锂离子的脱出是分步进行的,共有四个电压平台。第一个锂脱出过程中,由于存在一个稳定的Li2.5V2(PO4)3有序相,分Li3V2(PO4)3→Li2.5V2(PO4)3→Li2V2(PO4)3两步进行,对应的电压平台为3.6V和3.7V;第二个锂的脱出是一步完成的,Li2V2(PO4)3→Li1V2(PO4)3,对应4.1V的电压平台,此时理论容量133 mAh g-1。第三个锂的脱出动力学比较困难,Li1V2(PO4)3→V2(PO4)3,一步完成,对应4.56V的电压平台,理论容量197 mAh g-1。放电时锂离子嵌入,前两个Li嵌入时呈现固溶体行为,曲线出现S形,V2(PO4)3→Li2V2(PO4)3。最后一个Li分两步锂嵌入,Li3V2(PO4)3→Li2.5V2(PO4)3→Li3V2(PO4)3,出现3.65V和3.58V两个电压平台。
NASCION结构的Li3V2(PO4)3与LiCoO2等层状结构材料相比具有热稳定性和安全性能好的优点,与LiFePO4相比具有更高的离子电导和较高的电压和能量密度,极具应用前景,但是高电压(4.8V)下容量衰减较快,需要材料改性或寻找新的电解质溶液体系。
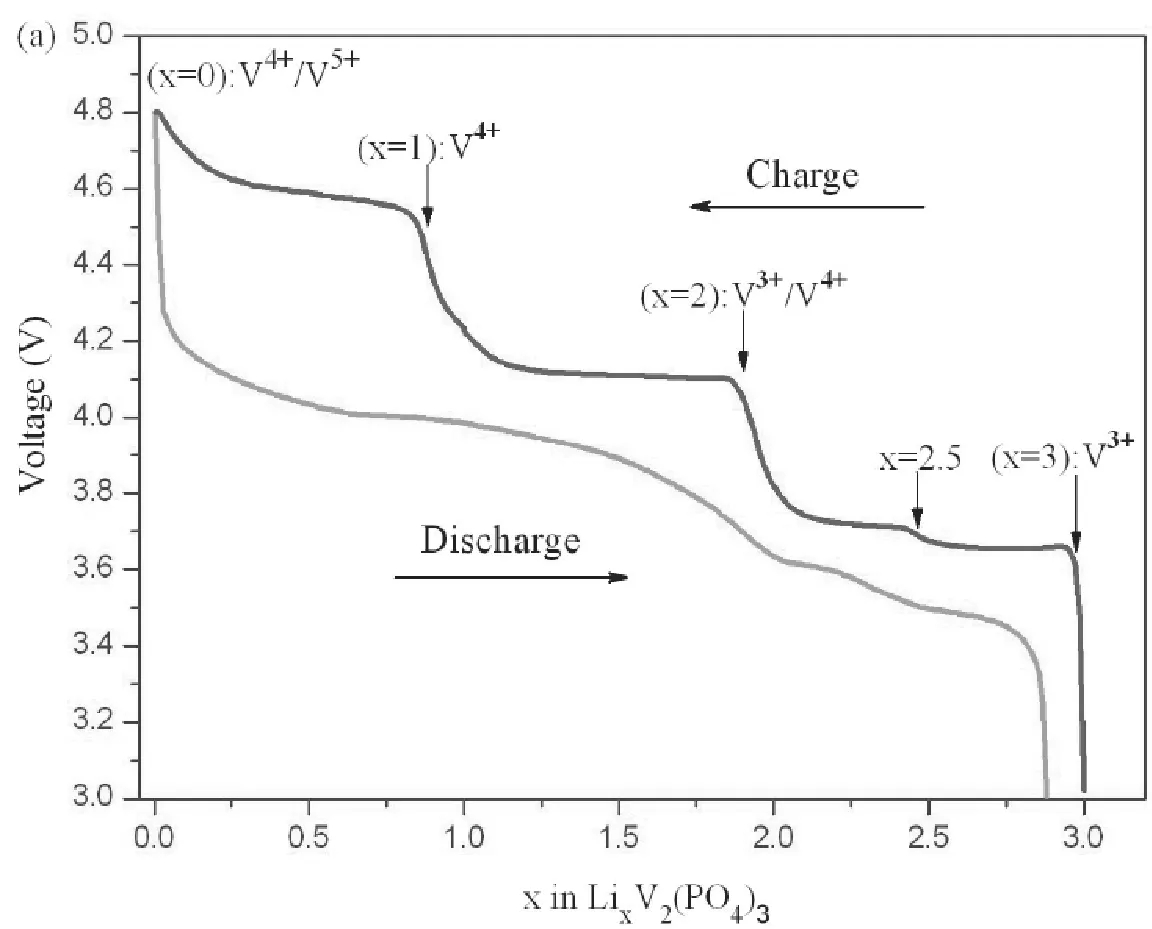
图8 Li3V2(PO4)3充放电曲线
2 结论
理想的锂离子电池正极材料必须具备以下几个方面的要求:
2.1 物理化学性质需稳定,不与电解液发生化学或物理的反应,保证电池良好的可逆循环性能。
2.2 具有较高的比容量大。
2.3 具有较高的体积能量密度和质量能量密度。
2.4 具有利于锂离子迁移的通道,和良好的电子导电性,以期提高电池的最大工作电流。
2.5 吉布斯自由能较大,具有提高电池的工作电压的潜力。
2.6 能够保证电池具有稳定的工作电压。
2.7 原料廉价易得、制备工艺简单以降低电池的生产成本、对环境无污染。
由上可知,不同种类的正极材料具有不同的应用特点。层状结构的LiCoO2电极材料由于在电压稳定性、可逆性、放电容量、充放电效率等方面具有优良的性能,但是钴的价格昂贵,特别是钴酸锂在充电态时的稳定性不理想,这些限制了该材料在动力汽车方面的应用。LiNiO2与LiCoO2结构相同,且价格低,充电后期更稳定,但层状结构不理想,锂离子的扩散困难,影响了材料的电化学性能。钴和铝部分取代镍的材料Li(Ni1-y-zCoyAlz)O2结合了钴和铝的优点,材料的循环性能和首效得到较大的提高,层状结构稳定性有所增强,充电时的热稳定性能提高,同时有效提升了使用的安全性。富锰铬的层状材料的热稳定性比钴酸锂等层状材料有了进一步的改善,但能量密度在放电时,随电压的衰减而减低,工业化的应用还需要进一步的研究。尖晶石结构的锰酸锂正极材料的倍率性能和热稳定性较好,但由于电解液原因容量有明显衰减。LiFePO4的循环性能,化学稳定性和热稳定性都十分优良,且具有成本优势,但能量密度受到低电压的限制。NASCION结构的Li3V2(PO4)3热稳定性和安全性优于过渡金属酸盐正极材料,同时离子电导能力和电压和能量密度也优于其他聚阴离子型正极材料,如能研发出抗高电压的电解液,使电解液的最高已占分子轨道(HOMO)能量低于Li3V2(PO4)3的电化学势,该材料将具有较好的应用前景。

