皖南地区HLA-Brs34933313基因多态性与肾综合征出血热的相关性分析
刘 淦,胡婷婷,陶东东,柳发虎,杨进孙,孙恩涛
肾综合征出血热(Hemorrhagic fever with renal syndrome,HFRS)是人兽共患传染性疾病,由汉坦病毒属(Hanta-viruses)各型病毒感染引起,主要是鼠类等啮齿动物通过排泄物、直接接触人体等途径传播致病[1-2]。在中国,HFRS是严重的公共卫生问题,每年发病人数约占据全球90%的比例,我国陕西、河北及山东地区等都是肾综合征出血热的多发疫区[3-6]。人类白细胞抗原(Human leukocyte antigen,HLA)基因复合体位于人类第6号染色体,经典HLA-I基因具有高度多态性,亦是参与机体免疫的候选基因组之一,通过抗原肽呈递CD8+T细胞参与免疫反应,在免疫识别病原体感染的细胞的基础上,诱导表位与宿主免疫系统之间的各种相互作用[7-8]。传染性和炎性疾病已在HLA中显示出很强的遗传关联,有研究表明,HFRS是由环境因素和遗传因素相互作用产生,且具有明显的遗传倾向,HLA基因与HFRS发病风险的关系在国内已有报道[9-10]。因此,研究疾病的同时还应需要考虑宿主HLA的遗传背景。
单核苷酸多态性(Single Nucleotide Polymorphisms,SNP)通常是最常见的基因组变异,目前已成为研究基因组区域遗传的理想选择,通过DNA中的遗传信息被转录为RNA,然后翻译为蛋白质负责确定人类之间的差异,SNP可分析基因型和表型信息之间的关系,因此遗传多态性间接影响免疫等生理活动[11]。李琦等[12]筛查河北省HFRS患者HLA功能性基因位点,采用病例对照方法分析HLA基因位点多态性,发现HLA-B基因rs34933313位点更易感染HFRS,但选择人群分布具有差异。本实验在此基础上,首次探讨HLA-B基因位点与皖南地区HFRS的关联,提供HFRS发病机制的科学依据,为临床前期筛查提供指导方向。
1 材料与方法
1.1材料收集 两组人群均来源于2018年9月1日至2019年9月1日安徽芜湖弋矶山医院。病例组:患者均根据国家统一标准诊断为肾综合征出血热[11],其中男性12例、女性2例, 年龄在27~74岁范围内,平均年龄(48.86±16.30)岁,且均为汉族人群。对照组:根据年龄、性别、职业等基线资料,从医院体检中心随机抽取不患目标疾病的人群作为健康对照,随机选取50名汉族地区正常人(无肾综合征出血热发病史、或接种相关疫苗),且各生化成分及各细胞含量均处于正常范围,其中男25例、女25例,年龄在27~74岁范围内,平均年龄(48.82±10.23)岁,且均为汉族人群,两组人群资料经皖南医学院附属弋矶山医院伦理委员会批准收集。两组各留取新鲜抗凝血24 h内操作,或置于—80 ℃冰箱内冰冻保存后续操作。
1.2试剂与设备 肾综合征出血热汉坦病毒IgG抗体(HV-IgG)ELISA定性检测试剂盒(南京帕尔斯生物科技有限公司),Epoch酶标仪(美国Biotek),小型磁力架(上海生工),磁珠法基因组血液DNA抽提试剂盒(上海生工),Taq多聚酶(上海生工),离心机(Eppendorf 5430/R),PCR仪(Eppendorf)EPS-100核酸电泳仪Power Supply(上海天能Tanon)、通用型化学发光、荧光和可见光成像系统FluorChem FC3(美国Protein Simple公司)。
1.3 方 法
1.3.1DNA提取 将采集的血液样本实验前进行ELISA试剂检测,以保证所得样本准确性,确诊后的样本留作DNA提取,采用磁珠法基因组DNA抽提试剂盒法提取白细胞基因组DNA,置于—20 ℃冰箱储存备用。
1.3.2引物的设计与合成 参照李琦等[12]针对HLA-B基因rs34933313位点的特异性碱基序列。引物:上游引物F1(5′-CACAGTGCAGCTCACTCAGC-3′)、上游引物F2(5′-CACAGTGCAGCTCACTCAGG-3′)和下游通用引物RP(5′-TGGTGGTCTACCCTTGGA-3′)。引物由上海生工生物工程股份有限公司合成。
1.3.3PCR扩增分型 采用ASP-PCR技术扩增HLA-B基因rs34933313位点的186 bp片段。反应体系为:基因组DNA3.5 μL,Taq酶0.4 μL(5 U/μL),dNTP0.1 μL(10 mmol/L),5×buffer (含Mg2+)4 μL,上下游引物各1 μL(10 μmol/ L),无酶dd H2O 10 μL。反应条件为:预变性94 ℃ 2 min;94 ℃变性30 s、59 ℃退火30 s、72 ℃延伸30 s,循环35次;72 ℃延伸7 min。
1.3.4PCR扩增结果检测 取5.0 μL PCR扩增产物,在电压100 V,35 min下用1%的琼脂糖凝胶电泳,在紫外灯下记录结果。
1.3.5电泳结果判断 若F1扩增出来,而引物F2没有,则此位点的等位基因W/W为纯合子。若F2扩增出来,而引物F1没有,则此位点的等位基因M/M为纯合子。若两个引物F1、F2都扩增出条带,则此位点的等位基因W/M为杂合子。
1.3.6统计学分析 采用SPSS 22.0软件进行统计分析,进行哈迪-温伯格(Hardy-Weinberg,H-W)遗传平衡检验,判断所选人群是否具有代表性。两组基因分布差异采用卡方检验或Fisher精确概率检验比较计数资料,使用logistic回归模型和95%可信区间(CI)评估两组数据的危险度(OR),并建立加性、隐性和显性遗传模式,所有统计过程均使用双侧检验,以α=0.05作为检验水准。
2 结 果
2.1ELISA试验 ELISA试验检测患者组样本均为阳性,对照组样本均为阴性,检测后样本进行DNA提取。
2.2基因位点分型 基因组DNA电泳出现的条带清晰,完整且无缺损,长度均超过2 000 bp。将其用于HLA-B基因rs34933313位点分型,规定从左向右开始计数条带泳道,起始为第1道,共25道电泳。
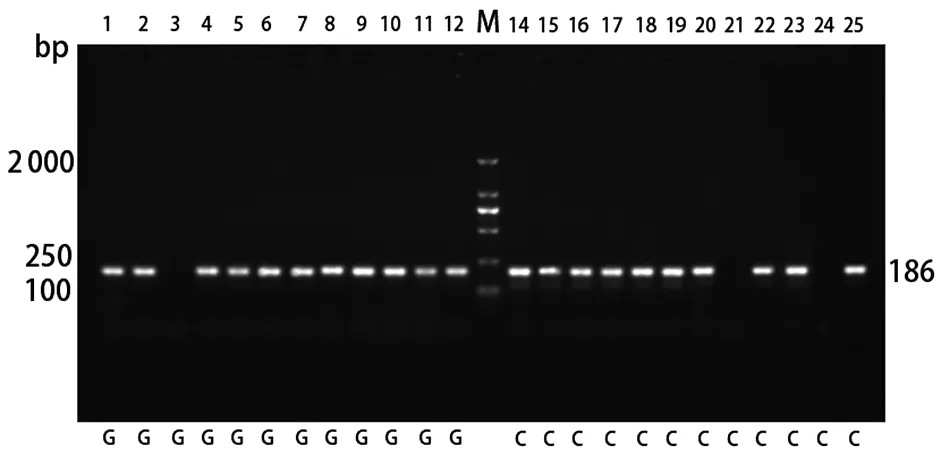
注:第1、2、3、4、5、6、7、8、9、10、11、12路径是G等位基因特异性引物PCR的结果;第14、15、16、17、18、19、20、21、22、23、24、25路径是C等位基因特异性引物PCR的结果;第1和14、2和15、3和16、4和17、5和18、6和19、7和20、8和21、9和22、10和23、11和24、12和25为同一基因样本;DNA标志物:2 000 bp Marker。图1 HLA-B基因rs34933313分型引物的电泳PCR产物Fig.1 Electrophoretic PCR products of HLA-B gene rs34933313 typing primers
2.3 数据分析
2.3.1哈德温伯格平衡检验 HLA-B基因rs3493331位点的等位基因为G/C两种形式,野生型为G、变异型为C,则可分为GG、CG、CC 3种基因型。利用哈温平衡定律HLA-B rs34933313位点的对照组观察人群检验,此位点实际人群分布基因型频率与预期人群分布频率比较,差异无统计学意义,表明对照组研究样本均都具有群体代表性,见表1。
表1 对照人群分布哈德温伯格平衡检验
Tab.1 Hadwinberg equilibrium test among Distribution of control population

对照人群分布SNPGGn(%)CGn(%)CCn(%)χ2值P值实际分布22(44.00)24(48.00)4(8.00)0.220.9预期分布23(46.00)22(44.00)5(10.00)
2.3.2HLA-B rs34933313位点与肾综合征出血热易感性分析 经过Hardy-Weinber平衡检验HLA-B rs34933313满足遗传平衡、具有群体代表性,得出等位基因频率在病例组和对照组中的差异有统计学意义(χ2=4.38,P<0.05),显示携带C等位基因可增加HFRS发病风险(OR=2.45,P<0.05)。HLA-B基因SNP rs34933313的基因型频率在病例组和对照组之间分布差异具有统计学意义(χ2=6.47,P<0.05)(见表2、3)。
表2 HLA-B基因rs34933313位点等位基因频率分布[例(%)]
Tab.2 Allele frequency distribution of HLA-B rs34933313 [cases (%)]
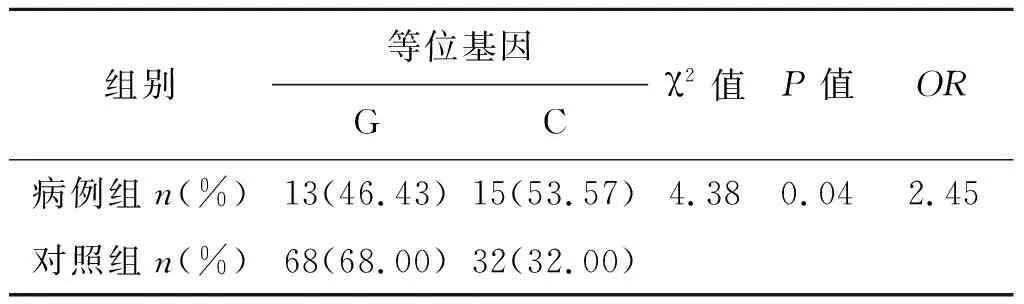
组别等位基因GCχ2值P值OR病例组n(%)13(46.43)15(53.57)4.380.042.45对照组n(%)68(68.00)32(32.00)
表3 HLA-B基因rs34933313位点基因型频率分布[例(%)]
Tab.3 Genotype frequency distribution of HLA-B rs34933313 locus [cases (%)]

组别基因型GGGCCCχ2值P值病例组n(%)1(7.14)11(78.57)2(14.29)6.470.04对照组n(%)22(48.00)24(8.00)4(11.00)
2.3.3不同遗传模型HLA-B基因rs34933313位点比较 对上述基因趋势P<0.05的SNP位点作进一步分析。从遗传模型分析(表4):加性模型:GG Vs CC、隐性模型:CC Vs GG+GC,显性模型:CC+GC Vs GG。HLA-B基因rs34933313位点基因型的加性模型(GG Vs CC)的OR值是11.00(95%CI=0.80~152.04),差异无统计学意义(P>0.05);隐性模型(CC Vs GG+GC)的OR值是1.91(95%CI=0.31~11.74),差异无统计学意义(P>0.05);显性模型(CC+GC VsGG)的OR值是10.21(95%CI=1.24~84.18),差异具有统计学意义(P<0.05)。
表4 HLA-B rs34933313位点基因型在不同遗传模型下的比较
Tab.4 Comparison of HLA-B rs34933313 genotypes in different genetic models
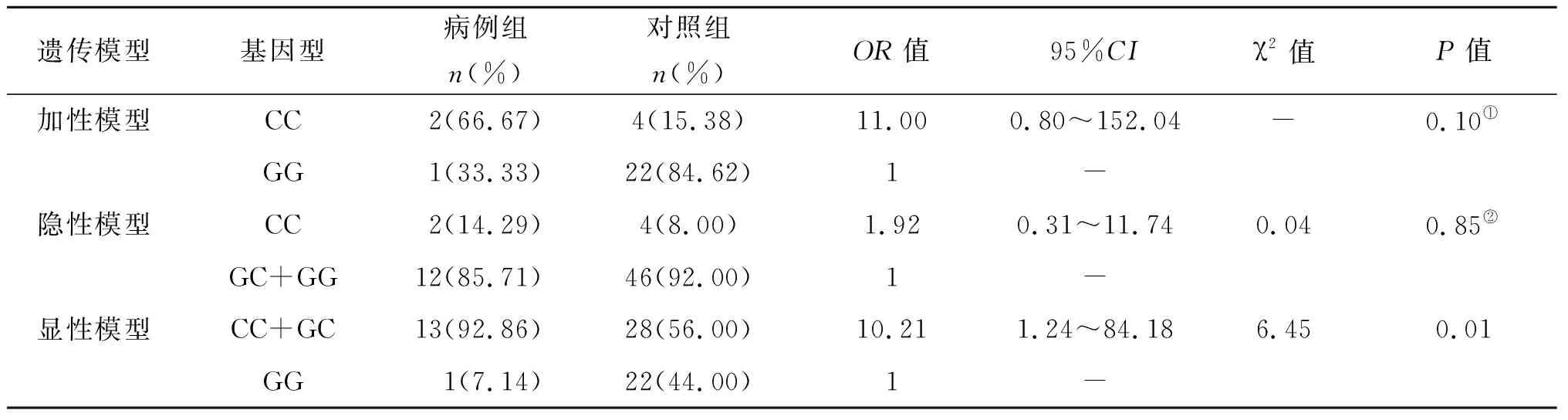
遗传模型基因型病例组n(%)对照组n(%)OR值95%CIχ2值P值加性模型CC2(66.67)4(15.38)11.000.80~152.04-0.10①GG1(33.33)22(84.62)1-隐性模型CC2(14.29)4(8.00)1.920.31~11.740.040.85②GC+GG12(85.71)46(92.00)1-显性模型CC+GC13(92.86)28(56.00)10.211.24~84.186.450.01GG1(7.14)22(44.00)1-
①Fisher精确概率法,②连续校正卡方检验
3 讨 论
HFRS是一种人兽共患性传染病,临床特征是发热、低血压休克、充血出血,随着时间的推移会严重损害肾脏等[13]。基因与环境因素共同作用和调控导致HFRS发生,其潜在机制亦与免疫反应有关[14]。研究发现免疫因子的释放可影响炎症期间细胞因子含量调节,影响汉坦病毒感染,另外HFRS诱发与宿主基因差异有关,提示应重视寄生宿主发病风险的本质[15]。单核苷酸多态性(Single Nucleotide Polymorphisms,SNP)是基因分型的常用方法,全外显子测序(Whole Exon Sequencing,WES)的应用可筛查突变基因位点,有助于更多传染性疾病的遗传因素的研究[16-17]。
HLA基因多态性与HFRS发病风险关联多有报道,显示出两者之间有紧密联系。秦娜琳等[18]发现HLA-A*3101、HLA-B*5801、HLA-DRB1*1602基因位点可增加发病风险,HLA-B*4001作为保护因素,但基因型携带的患者数量较少。CTL在HFRS过程发挥重要作用,保护性基因的表达产物介导CTL具有较强效应能力,抵抗疾病发生,反之易感性基因表达蛋白使抗原提呈不足等,使CTL功能减退或消失,导致免疫功能损伤使疾病易感[19]。HLA基因多态性与HFRS的易发风险及病程严重度有关,深入对HLA基因位点及单倍型的关系研究可协助临床早期筛查及诊断[20]。通过对汉坦病毒(Hantaan virus,HTNV)感染下的不同临床病程HFRS患者分析,发现HFRS严重临床进程与患者所携带的HLA-B*46基因位点、单倍型HLA-B*46-DRB1*09和HLA-B*51-DRB1*09有关,同时患有轻度临床进程的患者中HLA-DRB1*12等位基因出现频率较高,提示此位点可能是保护因素,说明了HLA基因与HFRS的易感性有显著相关性,为往后HLA基因多态性对HFRS研究开展提供新的理论方向[21-22]。
本研究结果显示HLA-B基因rs34933313位点病例组GC基因型频率明显高于对照组,提示HLA-B基因rs34933313位点GC基因型可能与HFRS相关。病例组C等位基因频率明显高于对照组,且携带C等位基因罹患HFRS的概率是G等位基因的2.45倍,会增加HFRS的发病风险,猜测在遗传信息表达过程中该位点G突变为C导致氨基酸替换或缺失,进而导致编码免疫蛋白的改变,从而产生对疾病的易感性。提示皖南地区汉族人群HLA-B基因rs34933313位点与HFRS患者发病风险存在相关性。但本研究筛选样本数量有限,并且覆盖人群仅在皖南地区,具有一定的局限性,下一步将扩大样本进行研究,并寻求更多HLA-B易感基因位点,深入对HFRS遗传易感性的相关机制的研究。
利益冲突:无

