hUC-MSCs移植联合肾脑复元汤干预对MCAO大鼠及HGF表达的影响∗
邹 婷 胡国恒 刘 侃 王瑾茜 王小菊
(湖南中医药大学第一附属医院,湖南 长沙 410007)
缺血性中风(CIS),又称缺血性脑卒中、脑梗死,属于中医学“中风”范畴,是指各种原因所致的局部脑组织区域血液供应障碍,导致脑组织缺血缺氧性病变坏死,进而产生神经功能缺损,出现相应的临床表现[1]。中风具有高发病率、高致残率、高死亡率的特点[2]。溶栓有严格治疗时间窗的限制、诸多禁忌证,且有易引起颅内出血的风险[3],而对症、保守治疗效果欠佳。大量研究证实了间充质干细胞能用来进行移植治疗脑损伤,有一定疗效且安全[4];前期研究表明[5-6]肾脑复元汤治疗缺血性中风不仅能降低卒中后致残率、死亡率,促进神经功能的修复,并对运动、感觉及语言等多项神经功能损伤的恢复有明显的修复作用。本研究拟制备局灶性脑缺血(MCAO)大鼠模型,观察肾脑复元汤和hUC-MSCs移植对模型大鼠缺血侧脑组织肝细胞生长因子(HGF)蛋白表达水平的影响,为缺血性脑卒中的治疗提供理论依据。
1 材料与方法
1.1 实验动物
SPF健康雄性SD大鼠,体质量(300±10)g,均由湖南中医药大学实验动物中心饲养[许可证号SYXK(湘)2009-0001],购于湖南省斯莱克景达动物实验有限公司[实验动物生产许可证号SYXK(湘)2011-0003]。大鼠饲养环境保持清洁、通风、恒温,定期更换垫料,消毒笼具,常规条件饲养,1周后造模。
1.2 人脐带间充质干细胞的分离、培养及鉴定
正常健康顺产婴儿脐带组织,来自湖南中医药大学第一附属医院,已与产妇签署知情同意书,实验已获医院伦理委员会批准。组织块法培养hUC-MSCs;流式细胞仪对其鉴定[9],按照间充质干细胞的鉴定标准(国际细胞疗法协会),要求CD73、CD105、CD90、CD29阳性表达率超过95%,CD45、CD34、CD14、CD79a/CD19和HLA-DR的表达率低于2%;台盼蓝染色检测细胞活率超过85%。参照Li等[10-11]的方法,将培养细胞鉴定具备分化成脂、成骨的能力。
1.3 试药与仪器
肾脑复元汤:熟地黄10 g,山药15 g,山茱萸肉10 g,黄芪30 g,牡丹皮10 g,红景天20 g,当归尾10 g,地龙10 g,赤芍10 g。药材经湖南中医药大学第一附属医院药剂科鉴定为道地药材,水煎浓缩至含生药2 g/mL,放置冰箱(4℃)冷藏备用。HGF抗体来自武汉BOSTER公司。主要试剂:兔抗大鼠HGF试剂盒(武汉博士德生物公司);通用pv9000试剂盒(上海瑞齐生物科技有限公司);水合氯醛(武汉市法迪斯公司)。主要仪器:精密电子天平(OHAUS),石蜡切片机(Reicher-thisto STAT),光学显微镜(Olympus),电子体温计。
1.4 分组与造模
大鼠随机分为5组:假手术组、模型组、中药组、干细胞组、联合组,假手术组只分离血管不插入线栓,其余各组均予右侧MCAO造模。造模前禁食24 h,术前称质量,腹腔注射10%水合氯醛溶液(0.350 g/kg)麻醉并保温,建立大鼠大脑中动脉内栓线阻断方法[7],必要时适当改进。缺血时间达到2 h后,拔除线栓即形成再灌注。再灌注2 h后按照Zea Longa法[8]的方法,1~3分纳入标本。
1.5 给药方法
各组于造模后24 h开始给药,联合组和干细胞组大鼠局灶性脑缺血2 h再灌注1 d后,经尾静脉注入1×106hUC-MSCs,模型组经尾静脉注入等体积蒸馏水。模型组及干细胞组分别灌胃等体积蒸馏水(10 mL/kg),联合组灌胃等体积肾脑复元汤。灌胃每日1次,直至处死。各组按处死时间点再随机分为给药后3、7、14 d 3个亚组,每个亚组保证有5只完成实验。
1.6 标本采集与检测
1.6.1 神经功能缺损严重程度评分量表(m-NSS)评分 各组分别在造模成功后3、14 d处死前1 h采用改良大鼠m-NSS[10],对大鼠各项生理功能(运动、感觉功能、平衡能力及生理反射)进行等级评分,正常记0分,异常者根据量表及严重程度记1~6分,总分为18分,无法完成以上某项测验则计1分。1~6分为轻度损伤,7~12分为中度损伤,13~18分为重度损伤。
1.6.2 脑组织HE染色 采用大鼠腹腔深麻醉(10%水合氯醛0.4 mL/100 g)的方式,将4%多聚甲醛缓冲液约300~400 mL灌注上肢及头脑,剔除颅骨取脑后,将脑冠状切开(视交叉平面前后2 mm),留取中间部分置入4%多聚甲醛内4℃下固定6 h,然后常规进行梯度乙醇脱水、二甲苯透明后石蜡包埋,保存备用。蜡块连续切片,厚5 μm,每隔5片取1张备用。
1.6.3 HGF检测 采用Western blotting检测脑组织中HGF蛋白的表达情况,以GAPDH为内参,采用IPP6.0软件对条带进行图像分析,以HGF产物与GAPDH产物条带灰度值的比值(即相对灰度值)作为HGF蛋白表达的指标,相对灰度值越高,说明HGF蛋白表达程度越高。
1.7 统计学处理
2 结果
2.1 各组大鼠不同时间点神经功能缺损评分比较
见表1。假手术组未见明显神经功能缺损症状。3 d后中药组与干细胞组、联合组比较差异有统计学意义(P<0.05);7 d后模型组与中药组、干细胞组、联合组比较差异有统计学意义(P<0.01),联合组与中药组、干细胞组比较差异有统计学意义(P<0.01或P<0.05);14 d后模型组与中药组、干细胞组、联合组比较差异有统计学意义(P<0.01),联合组与中药组、干细胞组比较差异有统计学意义(P<0.05或P<0.01)。随着用药时间延长神经功能评分逐渐减少,说明肾脑复元汤及hUC-MSCs移植对大鼠缺血性脑损伤均有一定的保护作用,具有促进神经功能恢复的功能。
表1 各组大鼠不同时间点神经功能缺损评分比较(分,±s)

表1 各组大鼠不同时间点神经功能缺损评分比较(分,±s)
与模型组同时间比较,∗P<0.05,∗∗P<0.01;与联合组同时间比较,○P<0.05,○○P<0.01;与干细胞组同时间比较,◆P<0.05。下同
组别假手术组模型组中药组干细胞组联合组n 5 5 5 5 5术后1 d 0.00±0.00**11.2±0.86 11.40±1.03 11.80±1.07 11.20±0.58术后3 d 0.00±0.00**9.40±0.75 9.00±0.71◆○7.20±0.66*6.80±0.58**术后7 d 0.00±0.00**8.00±0.71**5.80±0.66**○○5.60±0.51**○3.60±0.51**术后14 d 0.00±0.00**5.60±0.68 3.40±0.51**○3.80±0.37**○○1.80±0.37**
2.2 各组梗死区神经细胞观察
见图1。脑组织切片行HE染色后,高倍镜下(200倍)神经元细胞胞质呈桃红色,细胞核为蓝紫色。假手术组各时间点大鼠CA1区及DG区见神经细胞大小、形态正常,细胞结构完整,细胞排列整齐,细胞核大而圆,且居中,核仁清晰无异常表现。联合组3个时间点CA1区和DG区神经元与假手术组神经细胞大小、形态、结构、排列等相似,且随着用药时间的延长与假手术组的神经元相似度越接近,仅见少量神经细胞核变性。
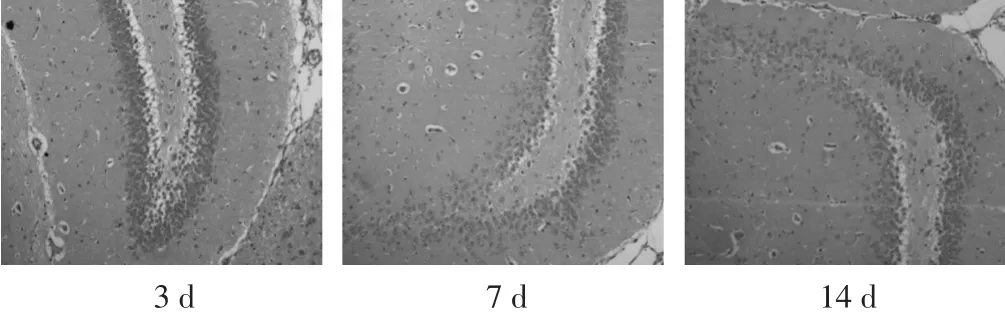
图1 联合组不同时间点脑梗死区神经细胞(HE染色,200倍)
2.3 各组脑组织HGF表达比较
见图2,表2。MCAO大鼠缺血侧脑组织HGF的表达在假手术组均无明显变化,而在其余各组3、7、14 d HGF的表达均有不同程度增高,但联合组表达最为明显;术后3 d,与模型组比较,中药组无明显变化(P>0.05),干细胞组差异有统计学意义(P<0.05),但联合组较各组均高(P<0.01);术后7、14 d,中药组、干细胞组、联合组HGF表达均增高,说明肾脑复原汤及hUCMSCs均可促进HGF蛋白的表达,但中药组与干细胞组无明显差异(P>0.05),联合组较中药组、干细胞组HGF表达均增高(P<0.01),说明二者联合效果更佳。
表2 各组大鼠不同时间点缺血侧脑组织内HGF表达比较(相对灰度值,±s)
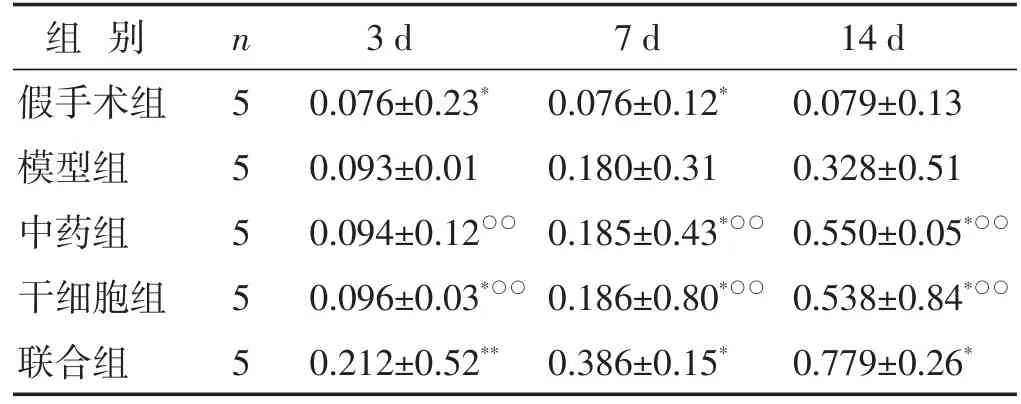
表2 各组大鼠不同时间点缺血侧脑组织内HGF表达比较(相对灰度值,±s)
组别假手术组模型组中药组干细胞组联合组n5 5 5 5 5 3 d 0.076±0.23*0.093±0.01 0.094±0.12○○0.096±0.03*○○0.212±0.52**7 d 0.076±0.12*0.180±0.31 0.185±0.43*○○0.186±0.80*○○0.386±0.15*14 d 0.079±0.13 0.328±0.51 0.550±0.05*○○0.538±0.84*○○0.779±0.26*
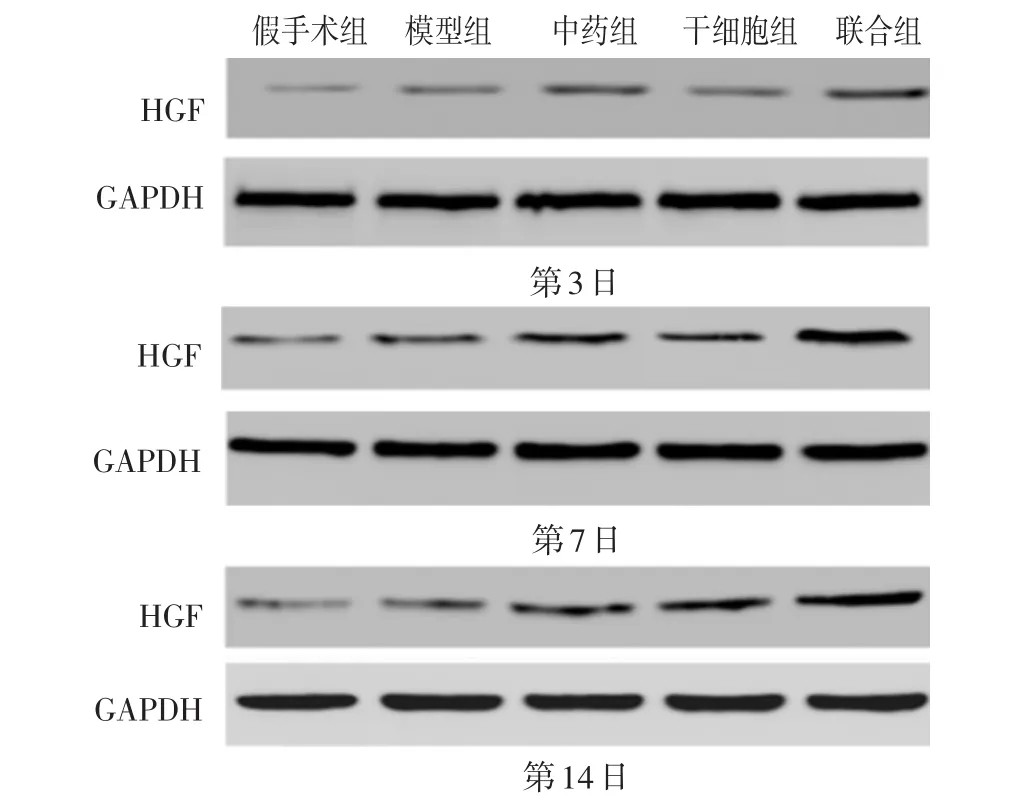
图2 各组脑组织中HGF蛋白的表达
3 讨论
HGF最初是于20世纪80年代由肝切除的大鼠血浆中分离提纯获得,并对肝损伤后再生起重要作用[12]。原位杂交、免疫组化等研究表明,HGF不仅在神经元细胞中有表达,且在非神经元细胞,如室管膜、脉络丛和松果体等处也有较高水平的表达。近年研究发现HGF具有多种生物学特性,通过与c-met受体结合,不仅可促进细胞有丝分裂、迁移运动和形态发生,而且还在中枢和外周神经系统的发育和形态维持中具有重要作用;另外,HGF还可通过与其受体结合直接作用于内皮细胞而起到生血管作用。研究表明在缺血损伤的组织中,HGF分泌增多、受体上调,可促进损伤血管内皮细胞的修复及增生,并促进侧支循环的形成。HGF对血管内皮细胞产生作用,血管密度的增加可明显减轻血脑屏障的破坏,保护血脑屏障的完整性[13],而不加重脑水肿[14]。HGF是嗜铬细胞瘤P12细胞、鼠胚胎运动神经元和胎鼠海马神经元的存活因子,能增强皮质轴突的生长和促进、脑多巴胺能神经元的存活[15]。它还可通过自分泌、旁分泌以及经典的轴突逆向转运方式,与特异性c-Met受体结合而起作用,其具体的作用机制尚不清楚,可能与cAMP介导的途径有关。研究表明,大多数HGF阳性细胞能分泌多种营养因子的反应性星形胶质细胞,因此HGF作为神经营养因子可能在脑缺血后的修复和重塑中起重要作用[16-17]。
中医学认为脑髓是由肾精化生而成,肾精是脑髓形成的物质基础。缺血性中风好发于中老年人,盖因中年之后肾精亏损,髓海空虚,脑络失养,遂致脑络血液凝涩不畅,发为中风。肾为一身之根本,髓海有病,其本在肾,所以治肾亦即治脑。故肾虚血瘀是缺血性中风发病的重要的病理机制之一。肾脑复元汤是根据从肾治脑、肾脑同治理论遣药组方而成,方中大量补益药与活血药相配,使气旺血行,活血不伤正,共奏补气活血通络之功,如此则精盛、髓满、脑充、瘀散、络畅、窍通,是经临床验证对治疗缺血性中风有良好疗效的方药,该方可明显改善脑卒中患者的神经功能,提高临床疗效,降低致残率,提高生活质量。
本实验研究显示,肾脑复元汤、hUC-MSCs均能促进缺血后神经功能的恢复、促进HGF的表达,减轻缺血脑损伤,恢复神经功能,肾脑复元汤主要在恢复期发挥其恢复神经功能的作用,hUC-MSCs在各期均可发挥作用,二者联合效果更佳。
此外,本实验中,肾脑复元汤联合HUC-MSCs移植治疗未见明显的不良反应,HE染色观察各组脑组织未产生明显肿瘤细胞及异形细胞的增生。因此本实验也从另一方面验证了肾脑复元汤联合HUC-MSCs移植治疗脑缺血再灌注损伤的安全性,而中药联合干细胞移植治疗脑缺血性损伤的远期疗效及致瘤性尚需进一步研究。

