PEG6000对姜黄素PLGA微丸型植入剂体外释放行为的影响
邓雪晴,刘杨佳,秦建秀,白瑞雪,叶田田*,王淑君*
PEG6000对姜黄素PLGA微丸型植入剂体外释放行为的影响
邓雪晴1,刘杨佳2,秦建秀1,白瑞雪2,叶田田2*,王淑君2*
(1. 沈阳药科大学 中药学院,辽宁 沈阳 110016;2. 沈阳药科大学 药学院,辽宁 沈阳 110016)
制备姜黄素-聚乳酸-羟基乙酸共聚物[poly(lactide-co-glycolide),PLGA]微丸型植入剂,探讨聚乙二醇6000[polyethylene glycol (molecular weight 6000),PEG 6000]对PLGA微丸型植入剂体外释放行为的影响。采用溶剂蒸发与挤出滚圆结合方法制备姜黄素PLGA微丸型植入剂,通过体外释放度、傅里叶红外光谱、差示扫描量热法和扫描电子显微镜等探究PEG对姜黄素微丸型植入剂释放的影响。制备得直径为1 mm、载药量达30%的PLGA微丸型植入剂。体外释放结果显示不含有PEG的PLGA微丸型植入剂呈双相释放,存在较长的迟滞期;加入质量分数5%PEG能够改善迟滞期,而加入质量分数10%PEG能够彻底消除迟滞期。物化表征结果显示姜黄素由结晶型转变为无定型状态而药物与载体没有发生化学反应,PEG能在微丸型植入剂释放和制备过程中形成孔道。姜黄素微丸型植入剂能够成功制备,载药量高且性质稳定,通过加入PEG能够消除微丸型植入剂的释放迟滞期,改变药物的释放速率与机制。
药剂学;微丸型植入剂;姜黄素;聚乳酸-羟基乙酸共聚物;聚乙二醇6000;体外释放
姜黄素(curcumin,CUR)是从姜黄属(L.)植物根茎中提取出来的一类天然多酚类化合物,具有抗炎、抗氧化、降血糖、抗肿瘤等广泛的药理活性[1];但由于姜黄素在水中溶解性差,在肠道中容易转化为葡糖苷醛酸和磺酸等复合物,代谢快、半衰期短[2],导致其给药剂量大与给药次数频繁,极大的限制了其临床应用。已有许多新型的药物递送系统,如纳米颗粒、胶束、微粒、脂质体、纳米乳剂和磷脂复合物等均研究用来提高姜黄素的口服生物利用度[3]。但用于局部长效缓释递送姜黄素的研究较少,且姜黄素治疗的绝大多数疾病需要长期服药,因此将姜黄素开发为植入长效缓释制剂尤为必要。聚乳酸-羟基乙酸共聚物(PLGA)因其具有宽范围的溶蚀时间,可生物降解特性和良好的可塑性成为缓释制剂给药领域最理想的材料[4]。在植入剂应用中,理想的释药速率是药物发挥疗效的关键,对于水难溶性药物而言,药物的释放主要由PLGA溶蚀控制通常表现出双相或三相的不均一释放[5]。迟滞期和快速释放期以及释药不完全均不利于制剂的安全性与有效性。为实现良好的释药性能,PLGA可根据制备方法的不同加工成片状、球型、棒状和薄膜等多种不同植入形状,或加入亲水性释放调节物质用以改变释药速率与释药机制。作者采用溶剂蒸发与挤出滚圆结合法制备PLGA微丸型植入剂,该方法制备简单,载药量高,通过亲水性PEG6000(PEG)对微丸型植入剂的释放进行调节,以期获得均一的植入释药体系,并采用傅里叶红外光谱、差示扫描量热法和扫描电子显微镜等探讨PEG对PLGA微丸型植入剂的释药机制的影响。以期实现姜黄素在植入部位持续释放药物,减少给药次数提高临床患者的依从性。
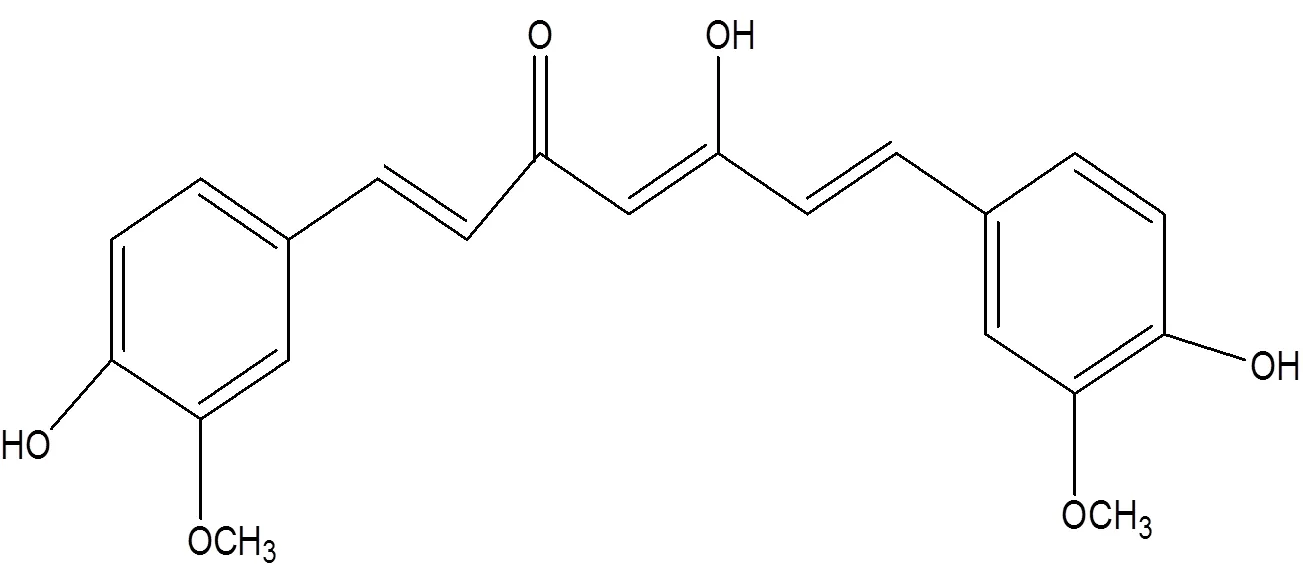
Fig. 1 Chemical structure of curcumin
1 仪器与材料
UV-5500PC紫外-可见分光光度仪(上海元析仪器有限公司),SCQ2201超声波清洗器(上海声彦超声波仪器有限公司),DF-101S集热式恒温磁力搅拌器(巩义英峪予华仪器厂),TG328A分析天平(海精密科学仪器有限公司),PT-104/35S分析天平(福州华志科学仪器有限公司),BXGXC滚圆机(杭州钱江干燥设备有限公司),pH计(上海仪电科学仪器股份有限公司),IN 12864DSC1(瑞士Mettler Toledo公司),S-3400N扫描电子显微镜(日本 Hitachi 公司),EQUINOX55傅里叶变换红外光谱仪(瑞士Bruker仪器公司)。
姜黄素原料药(含量质量分数≥98%,陕西锦泰生物科技有限公司),PLGA(乳酸与羟基乙酸的质量比75:25,北京汤普森生物科技有限公司,批号20180723),PEG6000(天津恒兴化学试剂制造有限公司),磷酸二氢钠、磷酸二氢钾、氯化钠、氢氧化钠(天津博迪化工有限公司),吐温80(南京威尔化工有限公司),二氯甲烷(分析纯,天津康科德公司),乙睛、甲醇、无水乙醇(色谱纯,山东禹王和天下新材料有限公司)。
2 方法与结果
2.1 微丸型植入剂的制备
采用溶剂蒸发[6]与挤出滚圆[7]结合法制备姜黄素PLGA微丸型植入剂。按表1处方百分比分别称取姜黄素、PLGA与PEG置50 mL圆底烧瓶中,加30 mL二氯甲烷使姜黄素、PLGA与PEG溶解,超声使混合均匀,置70 ℃温度水浴条件下旋转蒸发10~15 min使成黏稠半固体,将固体混合物通过0.85 mm直径的筛网挤出成颗粒,允许二氯甲烷在自然条件下挥发,手动取出挤出成粒的颗粒投入到滚圆盘直径为30 cm滚圆机内,滚圆频率为18 Hz,滚圆时间为10 min,滚圆的同时锅底鼓入热风进一步除去残留溶剂,植入小颗粒在离心力的作用下,碰撞逐渐磨平棱角,使其外观圆整,表面无明显裂痕,筛分得PLGA微丸直径为1 mm左右即可。
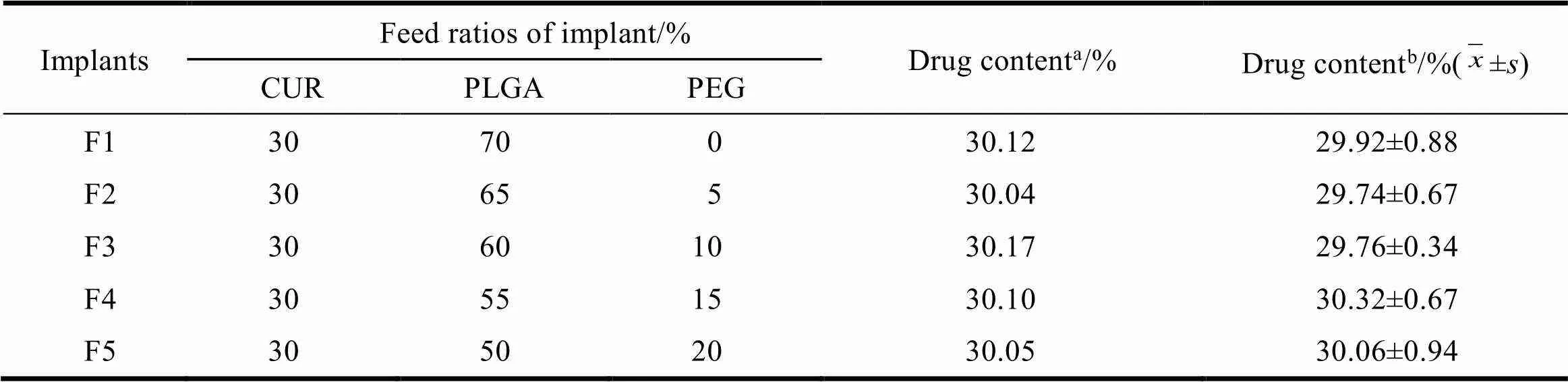
Table 1 Formulation composition and the measured drug loading efficiencies of implants(n=10)
a—Calculated by the feed ratios;b—Determined by UV
2.2 植入剂中姜黄素的分析方法
2.2.1 检测波长的确定
取姜黄素原料药适量,用甲醇溶解并稀释,配制成质量浓度为50 mg·L-1的溶液,选取甲醇溶液作为空白对照,进行紫外全波长扫描,波长范围为200~500 nm,结果显示姜黄素在425 nm处有最大吸收波长,故选择425 nm作为含量测定检测波长。
2.2.2 标准曲线的制备
精密称取姜黄素标准品10.00 mg置于10 mL棕色量瓶中,加甲醇溶解并定容为质量浓度1.00 g·L-1姜黄素的储备液,室温避光保存。精密量取该储备液配制成质量浓度为1.0、2.0、3.0、4.0、5.0、6.0 mg·L-1的姜黄素系列溶液。采用甲醇作为空白对照,在425 nm紫外检测波长条件下测定其吸光度(),以吸光度()对质量浓度()进行线性回归,得回归方程为=0.160 8-4.5×10-3(=0.999 9)。结果表明姜黄素质量浓度在1.0~6.0 mg·L-1内与吸光度线性关系良好。
2.2.3 精密度试验
取1.0、3.0和6.0 mg·L-1低、中、高三种质量浓度的标准溶液,在425 nm波长条件下测定吸光度。每个质量浓度平行测定5次,连续测定3 d,分别计算日内和日间精密度。紫外法测定姜黄素低、中、高三种质量浓度溶液日内精密度RSD分别为1.94%、1.04%和0.42%,日间精密度的RSD分别为1.40%、1.91%和1.00%,其结果均小于2%,证明精密度符合标准要求。
2.2.4 回收率实验
取1.0、3.0和6.0 mg·L-1低、中、高三种质量浓度的标准溶液,在425 nm波长条件下测定吸光度,计算姜黄素质量浓度和回收率。每个质量浓度平行测定5次,结果得姜黄素的低、中、高三种质量浓度的平均回收率分别为100.50%、99.44%和100.31%,其结果在98%~102%内,RSD均小于2%,符合方法学考察要求。
2.3 植入剂载药量测定
从制备的各处方植入微丸中随机选取10份植入剂样品,精密称重后,置10 mL棕色量瓶中,加2 mL乙腈溶解,随后加甲醇沉淀PLGA并定容至刻度,摇匀,取5 mL混悬液置于具塞离心管中,于13 000 r·min-1离心15 min,吸取2 mL上清液,加纯甲醇稀释后在425 nm波长下测定吸光度,计算姜黄素的含量。计算结果见表1,结果显示加入不同比例PEG的处方均能够成功制备并与理论值接近,表明制备工艺稳定可行。
2.4 植入剂稳定性考察
2.4.1 影响因素试验
取上述5个处方微丸型植入剂按下列条件进行检测,影响因素考察条件如下:
高温:置于(60±2)℃温度条件下放置;
高湿:置于相对湿度(90±5)%的条件下放置;
光照:置于光照度(4 500±500)lx条件下放置;
分别于0、5和10 d取样,分别观察植入剂外观并计算药物的相对百分含量。药物在不同时间点的相对百分含量计算公式如下:

由表2可知,由于高温条件高于聚合物的玻璃化转变温度,微丸型植入剂在高温下形状会发生改变,因此不宜在高温下保存,在高湿和光照条件下,随着时间的延长,药物的相对百分含量逐渐降低,说明高湿和光照会加速姜黄素的分解。以上三种影响因素条件均加速了主药和聚合物的性质改变,因此该微丸型植入剂适宜在低温和避光的条件下保存。
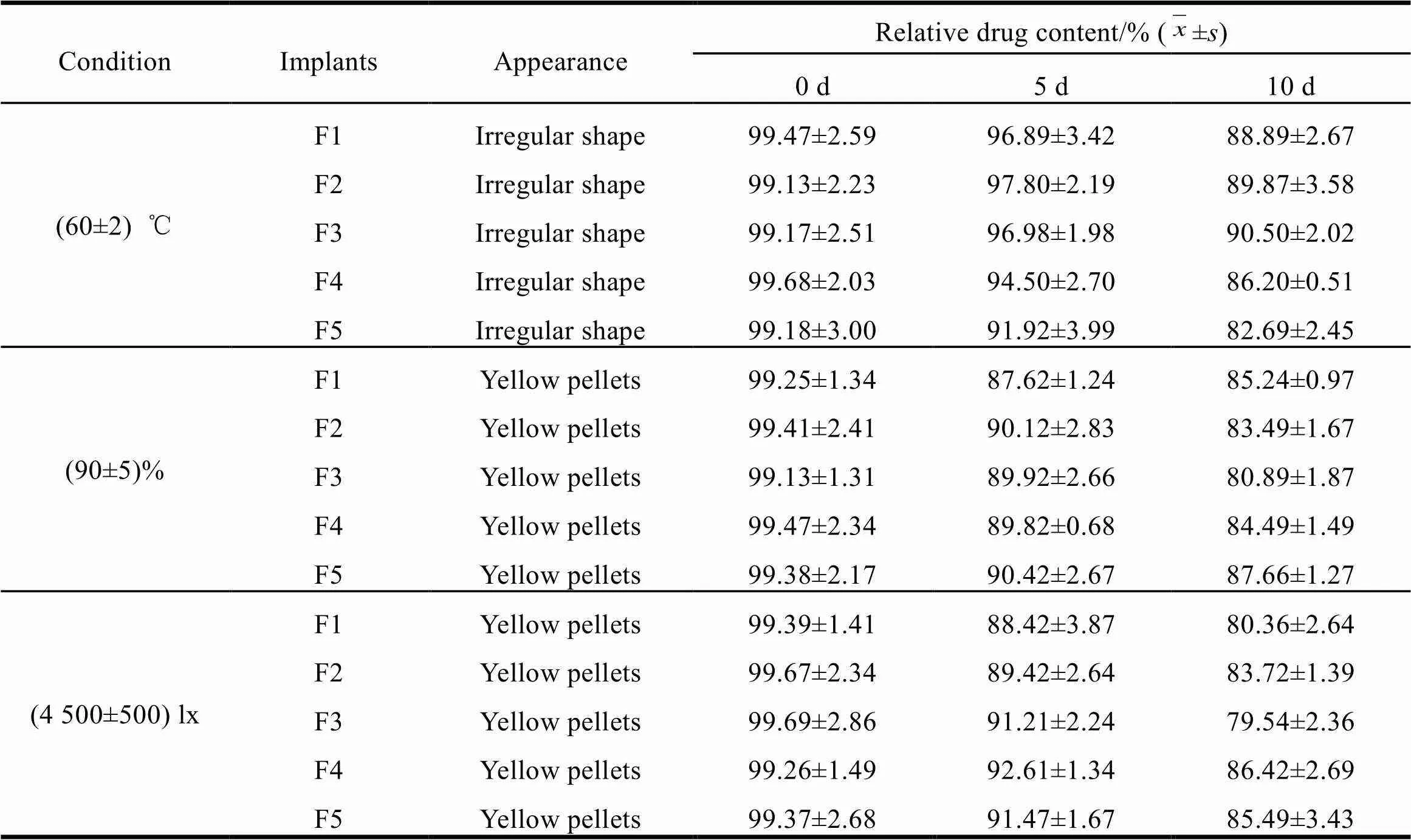
Table 2 Effects of influential factors on the stability of CUR implants
2.4.2 植入剂储存稳定性考察
将植入剂保存于4 ℃、环境湿度、避光条件下,于设定的时间间隔(0、3和6个月)从各批植入剂中随机选取3份样品,按照“2.3”条方法测定植入剂中的药物含量,并计算药物的相对百分含量,由图2可知,姜黄素植入剂在考察期内(6个月)相对含量没有显著性下降,表明该植入剂能够保证至少半年的稳定期。

—0 month;—3 month;—6 month
2.5 体外释放度测定
释放介质采用pH 7.4磷酸缓冲液用于模拟皮下生理环境,由于姜黄素在水中的溶解度小,无法研究姜黄素在释放介质中的释放情况,因此,通过加入表面活性剂吐温80,使姜黄素能够被检测。释放介质配制方法:磷酸二氢钾0.24 g,磷酸氢二钠(Na2HPO4•12H2O)1.44 g,氯化钠8.0 g加水溶解并稀释至1 000 mL,取上述释放介质加入质量分数为0.5%吐温80,搅拌充分溶解,用氢氧化钠调节pH至7.4。
参考颗粒状[8]和薄膜[9]PLGA植入剂相关文献,微丸型植入剂体外释放度测定采用洗脱法进行。通常以PLGA为基质的长效缓控释制剂体外释放可长达数周、数月、甚至数年。该方法能够更好的模拟体内皮下环境,体现出真实时间的药物释放规律与释放周期。取微丸型植入剂约20 mg,精密称定,置于10 mL具塞玻璃试管中,加释放介质4 mL,放入37 ℃的水浴条件下,避光,在预定时间点取出试管,取全部释放介质,同时补加相同体积释放介质4 mL。由于姜黄素含量测定方法学在甲醇溶液中测定,取出的释放介质加入纯甲醇进一步稀释后按“2.2”项下紫外检测方法测定介质中姜黄素含量,计算累积释放度,每个处方平行操作3份,释放曲线见图3。
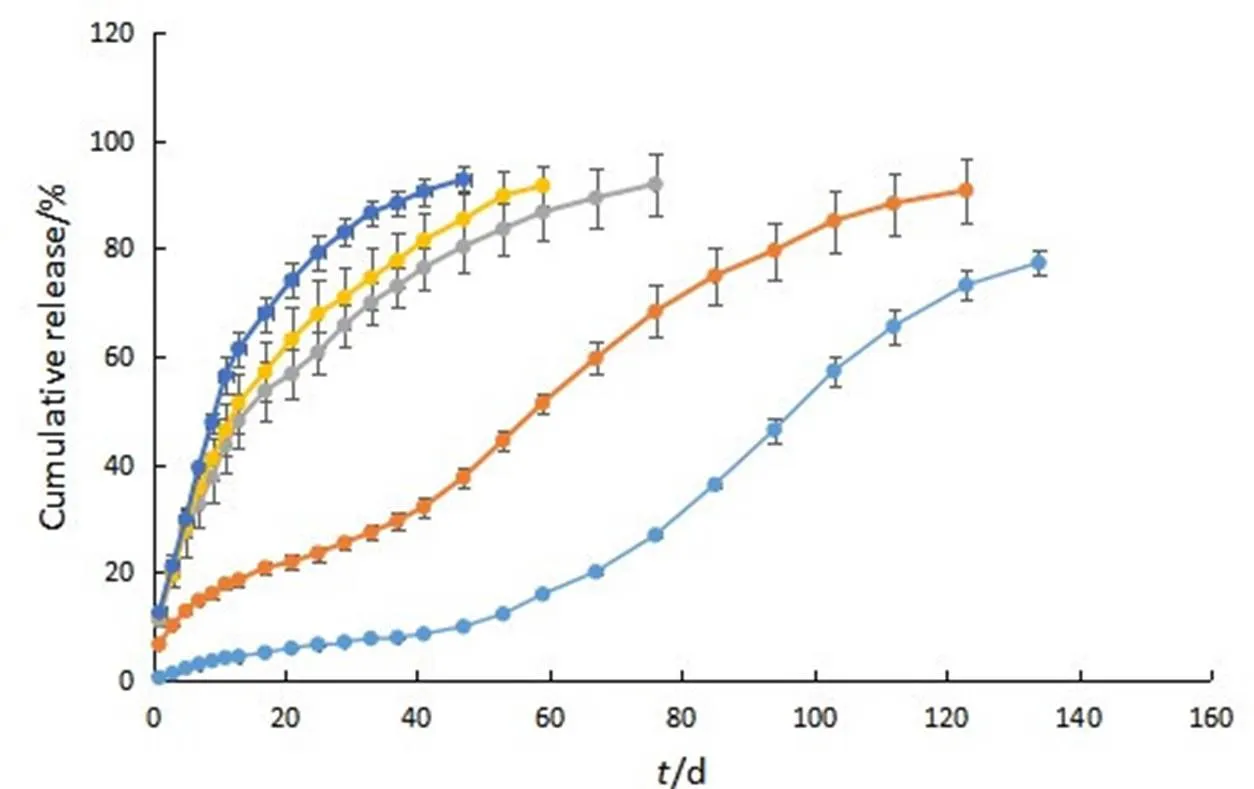
—0% PEG;—5% PEG;—10% PEG;—15% PEG;—20% PEG
未加入PEG的微丸型植入剂的释放曲线分为三相:姜黄素在41 d内累积释放量仅为8.53%,I相表现为迟滞期;从41 d起进入快速释放期,II相释放为快速释放期。145 d达到平台期,总释放量为83.55%,III相为平台期,此时植入剂中药物含量已较少,释放速率减慢。前期存在的迟滞期达不到临床实际用药所需的释放量,由此,通过加入亲水性PEG来改善释放迟滞期,由释放曲线可知,PEG的加入对微丸型植入剂的释药行为存在很大的影响,药物释放的速率与PEG的添加量成正比,添加量为20%的植入剂释放速率最快,添加量为5%的植入剂释放速率最慢,由表3可知:添加量为10%~20%时能够彻底消除迟滞期,但存在突释效应;而添加量为5%时,突释减少但伴随着5~37 d的迟滞期。同时,植入剂的释放周期随着PEG的添加量而减少,综合考虑释放周期与迟滞期,10%PEG的添加量能够消除迟滞期,体外释药周期长达76 d,药物释放完全高达91.93%。为了更好地理解PEG对释药行为的影响,对植入剂的热行为、结构及微观形貌进行分析。
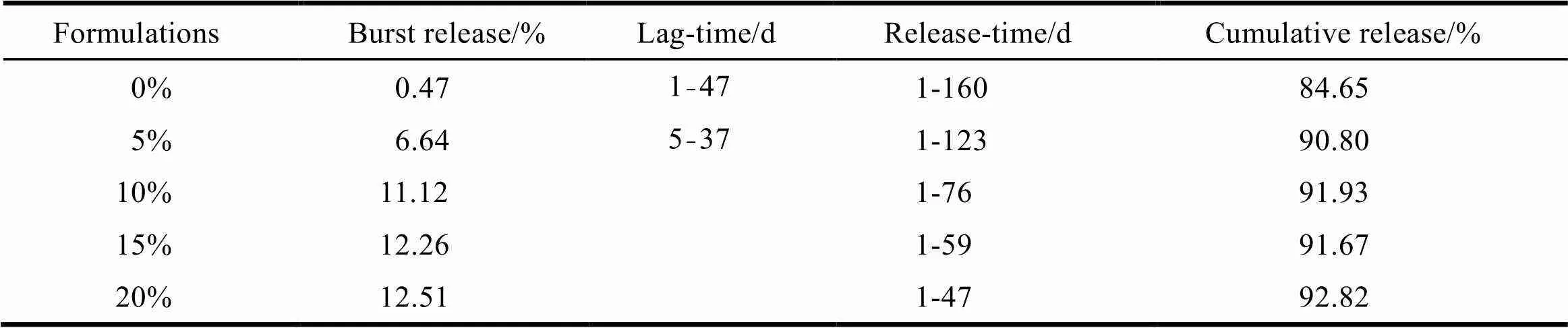
Table 3 Evaluation of drug release of different implant formulations
2.6 微丸型植入剂的表征
2.6.1 植入剂的DSC测定
为了进一步表征各成分在微丸型植入剂中的存在状态,采用差示扫描量热法(differential scanning calorimetry,DSC)分析各成分的热行为。将大约2.0~3.0 mg样品在密封铝盘中,精密称定。程序升温:初始温度为40 ℃,平衡2 min,以10 ℃·min-1的速率升温至200 ℃。由图4可知,姜黄素在环境温度下为黄色晶体,在加热过程中(10 ℃·min-1),这种结晶形式在183.07 ℃熔化,在DSC热谱图上产生向下的尖锐吸热峰,PLGA显示熔化过程位于47~57 ℃内,m=52.33 ℃,与结晶相相关。姜黄素在物理混合物中的结晶峰曲线与纯姜黄素相比变得更加平滑,并且在加热循环期间没有移动(m=180 ℃),而在不含PEG的姜黄素植入剂中则降低(m=160 ℃),表明微晶熔化所需的热量减少,这可能是由于药物和PLGA共混体系在制备过程中结晶完善程度降低,不规则微晶数量增加,微晶熔融需要的热量减少,导致开始熔化在较低的温度。
在添加PEG的情况下,由谱图可以看出PEG原料显示出明显的熔融峰,显示出PEG的结晶或半结晶性质。结晶姜黄素在姜黄素、PEG与PLGA三者的物理混合物中清晰可见(图4中向下的药物熔融峰)。而在含有PEG的植入剂中没有显示出药物熔融峰。这提示姜黄素可能从结晶状态完全转变为无定形状态,说明添加PEG能够影响姜黄素在聚合物基质中的分散状态。观察到在所研究的姜黄素植入剂中PEG的DSC热谱图熔融峰清晰可见,说明PEG在植入剂中以结晶形式存在。注意到在植入剂中没有观察到单独的PLGA熔融峰,可能是由于较大的结晶PEG熔融峰掩盖了较小的PLGA玻璃化转变峰。
综上,这些差异可能影响到用这些材料制备的微丸型植入剂各种关键性质,例如暴露于释放介质时的系统溶蚀和崩解动力学;此外,药物的分散状态也会影响药物的释放行为,药物在载体中的分散状态不同,对药物的溶出速率也有影响。
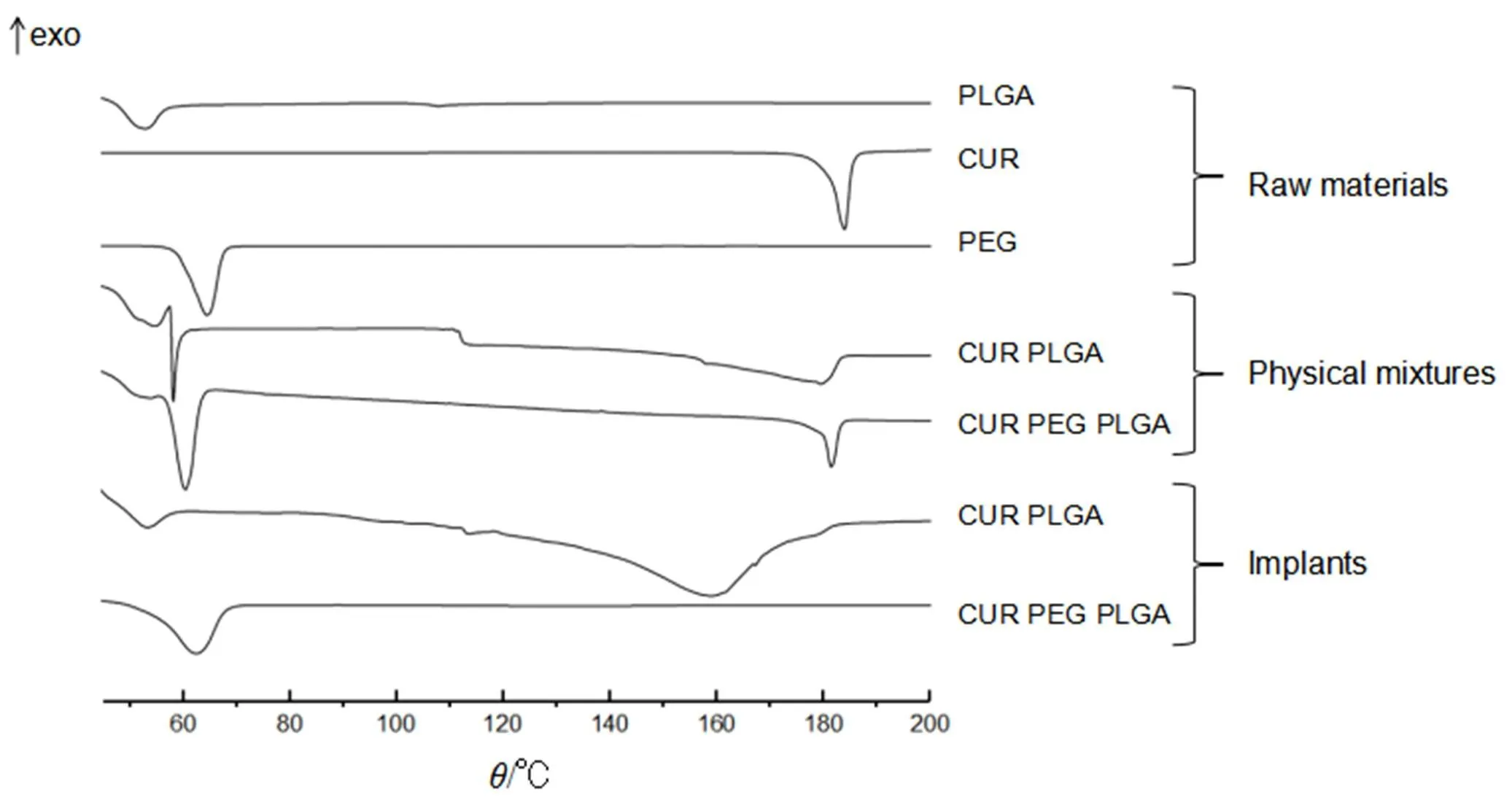
Fig. 4 DSC thermograms of the raw materials (as received), physical mixtures and implants .The drug content was 30%. The (optional) PEG content was 10%
2.6.2 植入剂的FTIR测定
通过傅里叶变换红外(Fourier Transform Infrared,FTIR)光谱检测姜黄素微丸型植入剂(含PEG与不含PEG),原辅料PLGA、PEG、姜黄素及其物理混合物的结构,以判断药物与聚合物之间的反应,红外扫描范围为4 000~500 cm-1。由图5可知:姜黄素在4 000~500 cm-1内显示了一系列特征峰,观察到的主要峰之一是约3 500 cm-1,最可能是由于分子间键合的OH基团的-OH振动。没有观察到1 700 cm-1处的二酮吸收峰,说明姜黄素以稳定的酮-烯醇形式存在,表现为在1 627 cm-1处存在着强特征吸收峰。姜黄素植入剂与其物理混合物具有相似的结构。并且植入剂中1 627cm-1处的峰没有发生移动,说明姜黄素与PLGA在制备过程中没有发生键的断裂和键合,这可能是由于酮-烯醇形式具有很强的分子内氢键能够稳定存在,不利于与其他分子间的化学反应[10-11],这表明姜黄素在PLGA植入剂中可能处于分散状态。
姜黄素植入剂添加PEG后,对比姜黄素、PEG原辅料和含PEG的植入剂,可以看到在含PEG的植入剂中,姜黄素在含PEG的植入剂中与在不含PEG的植入剂中结构非常相似,观察1 627 cm-1处的峰没有发生变化,表明此处姜黄素的结构主要以稳定的分子内氢键键合的酮-烯醇互变异构体存在。此外,-OH区域的变化可用于提供关于聚合物分子间氢键相互作用的信息,观察到PLGA在3 433 cm-1处表现为较强且宽的吸收峰以及PEG在3 429 cm-1处的吸收峰,可归属于羟基特征峰。而在姜黄素植入剂中向低波数移动至3 427 cm-1,表明两种聚合物可能存在着分子间的氢键作用。这些物理性质的改变可能会影响聚合物的亲水性质,从而影响药物的释放速率。
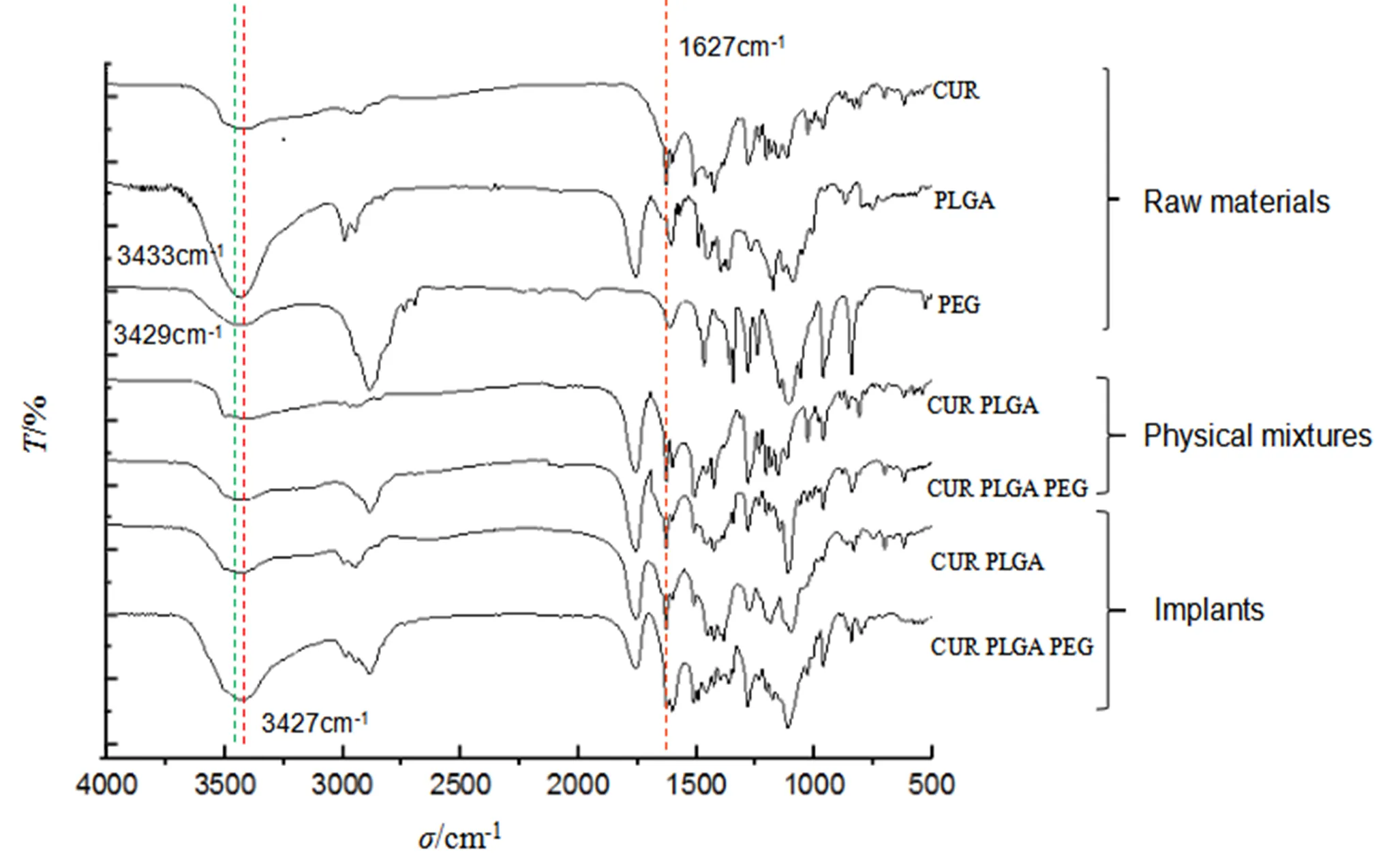
Fig. 5 FTIR spectra of the raw materials (as received), physical mixtures and implants. The drug content was 30%. The (optional) PEG content was 10%
2.6.3 扫描电子显微镜(scanning electron microscope,SEM)
取微丸型植入剂样品2份,分别对其表面和截面(手动掰断获得截面)进行观察,对样品进行喷金处理后,在扫描电镜下观察并拍照。图6观察了两种微丸型植入剂的表面与截面形态,由图可知,两种植入剂显示出不同的表面与截面形态,含有PEG的姜黄素植入剂表现出粗糙的表面,可以观察到许多小孔。相比之下,单独的PLGA植入剂具有更光滑的表面。两种植入剂的横截面形态的差异仍然可见,不含有PEG的植入剂具有致密的横截面,仅见手动掰断的截面裂痕,加入PEG的植入剂截面表现出多孔性质。可以推测加入PEG后形成的小孔会影响PLGA暴露在释放介质中的程度,从根本上加快药物的释放。

Fig. 6 SEM pictures(×150) of surface(A) and cross-section(C) of CUR implant contains 10% PEG; surface(B) and cross-section(D)of CUR implant contains 10% PEG. Both formulations contained 30% drug
3 结论与讨论
a. 作者采用溶剂蒸发与挤出滚圆结合法成功制备了姜黄素PLGA微丸型植入剂。该方法制备工艺简单,姜黄素载药量高达30%,通过筛网挤出粒度可控,在4 ℃、环境湿度、避光条件下各个处方植入剂能够稳定存放6个月。通过本实验可以发现,植入剂的制备过程中具有两个关键点:(1)药物与基质混合均匀,满足该条件是基于药物与基质材料能够溶于同种溶剂中,且溶剂易于除去;(2)植入剂成型性,满足该条件是由于PLGA在溶于溶剂和高于其玻璃化转化温度后,具有良好的可塑性,而溶剂挥发和温度降低后能够顺利成型。
b. 体外释放实验采用了药物洗脱法,模拟皮下释放介质进行体外释放实验,在未添加PEG的情况下,姜黄素的释放呈双相释放模式,前期存在较长的迟滞期,这可能是由于,对于姜黄素这种水溶性差的药物,药物的释放主要由PLGA的溶蚀与膨胀过程控制。加入PEG后,前期迟滞期得到明显改善,并且药物释放速率随PEG的增加而加快,并表现出前期突释,这可能是由于亲水性PEG的释放加速了药物的释放,同时还可能改善了脂质性PLGA的亲水性[12]。
c. 在红外、DSC、SEM的表征实验中,姜黄素、PEG与PLGA三者没有发生化学键的生成和断裂,处于各自分散存在的状态,说明在制备条件下,三者的结构保持稳定,但姜黄素的结晶行为在制备过程中发生变化,由规则的结晶状态转变为不规则微晶,在DSC图谱上表现出向低温方向移动,加入PEG后,药物的结晶峰消失,由结晶形式转变为无定型状态,说明PEG能够改变药物在聚合物基质中的分散状态,从而加快药物的释放速率。在SEM微观形貌的表征中,未添加PEG的微丸型植入剂表现出致密的表面与截面,这可能是释放存在着迟滞期的原因。而加入PEG为微丸型植入剂提供了多孔隙的表面和多孔洞的截面,药物通过多孔的通道扩散从根本上加速药物的释放。
[1] GUPTA S K, KUMAR B, NAG T C, et al. Curcumin prevents experimental diabetic retinopathy in rats through its hypoglycemic, antioxidant, and anti-Inflammatory mechanisms[J]. Journal of Ocular Pharmacology and Therapeutics, 2011, 27(2): 123-130.
[2] HUANG Y, CAO S, ZHANG Q, et al. Biological and pharmacological effects of hexahydrocurcumin, a metabolite of curcumin[J]. Archives of Biochemistry and Biophysics, 2018, 646: 31-37.
[3] ANIL K, ALKA A, JAVED A, et al. Conundrum and therapeutic potential of curcumin in drug delivery[J]. Critical Reviews in Therapeutic Drug Carrier Systems, 2010, 27(4): 279.
[4] FRANCISCA A, NEHA S, MOHAMMAD-ALI S, et al. Microfluidic assembly of a multifunctional tailorable composite system designed for site specific combined oral delivery of peptide-drugs[J]. ACS Nano, 2015, 9(8): 8291-8302.
[5] FREDENBERG S, WAHLGREN M, RESLOW M, et al. The mechanisms of drug release in poly(lactic-co-glycolic acid)- based drug delivery systems--a review [J]. Int J Pharm, 2011, 415(1/2): 34-52.
[6] SHYAM S B, HINA K, FARRUKH A, et al. Curcumin implants for continuous systemic delivery: safety and biocompatibility[J]. Drug Delivery and Translational Research, 2011, 1(4): 332-341.
[7] SINGH G, PAI R S, KUSUM DEVI V. Optimization of pellets containing solid dispersion prepared by extrusion/ spheronization using central composite design and desirability function[J]. Journal of Young Pharmacists, 2012, 4(3): 146-156.
[8] CHAO Y K, WEN Y W, LIU K S, et al. Biodegradable drug-eluting pellets provide steady and sustainable cisplatin release in the intrapleural cavity: In vivo and in vitro studies[J]. International Journal of Pharmaceutics, 2015, 484(1/2): 38-43.
[9] PAN C J, TANG J J, WENG Y J, et al. Preparation, characterization and anticoagulation of curcumin-eluting controlled biodegradable coating stents[J]. Journal of Controlled Release, 2006, 116(1): 42-49.
[10] PARIMITA S P, RAMSHANKAR Y V, SURESH S, et al. Redetermination of curcumin: (1E, 4Z, 6E)-5-hydroxy-1, 7-bis(4-hydroxy-3-methoxyphenyl)hepta-1, 4, 6-trien-3-one [J]. Crystallographic Communications, 2007, 63(2): 860-862.
[11] [11]WEGIEL L A, ZHAO Y, MAUER L J, et al. Curcumin amorphous solid dispersions: the influence of intra and intermolecular bonding on physical stability[J]. Pharmaceutical Development and Technology, 2014, 19(8): 976-986.
[12] [12]BANSAL S S, KAUSAR H, VADHANAM M V, et al. Controlled systemic delivery by polymeric implants enhances tissue and plasma curcumin levels compared with oral administration [J]. European Journal of Pharmaceutics & Biopharmaceutics, 2012, 80(3): 571-577.
Investigation on effect of PEG6000 onrelease behavior of curcumin PLGA micropellet implants
DENG Xueqing1,LIU Yangjia2,QIN Jianxiu1,BAI Ruixue2,YE Tiantian2*,WANG Shujun2*
(1.,,110016,; 2.,,110016,)
To develop a carrier system incorporating curcumin (CUR) with poly(lactic-co-glycolic acid)(PLGA)-based implants in micropellet geometry form, and to evaluate the impact of the addition of PEG6000(PEG) onrelease behavior.Micropellet implants were prepared by a combination of solvent evaporation and extrusion spheronization technique. The effect of PEG on the release behavior of CUR micropellet implants were explored by Fourier transform infrared spectroscopy (FTIR), differential scanning calorimetry (DSC) and scanning electron microscopy (SEM).PLGA micropellet implants with a diameter of 1 mm and a drug loading of 30% were prepared.release results show that PLGA micropellet implants with 0% PEG displayed in bi-phasic drug release profiles, characterized by a lag-time of several weeks with little drug release and finally a rapid drug release. PLGA micropellet implants with 5% PEG presence showed that a lag-time of release profile was improved. In 10%-20% PEG increments, the hysteresis period was completely eliminated. The results of physicochemical characterization showed that there was no chemical reaction between CUR and polymer, while drug changed from crystalline into amorphous state. PEG also provided a porous microstructure of implants.The CUR micropellet implant can be successfully prepared with a high drug loading and stable properties. By the addition of PEG, the release lag phase of the implant can be eliminated, and the release rate and mechanism of the drug can be changed.
pharmaceutics; micropellet implants; curcumin; poly(lactic-co-glycolic acid)(PLGA); PEG6000;study
R94
A
(2020)02–0101–11
10.14146/j.cnki.cjp.2020.02.003
2019-06-01
邓雪晴(1993-),女(汉族),湖北仙桃人,硕士研究生,E-mail 1194288403@qq.com;
王淑君(1972-),女(汉族),浙江舟山人,教授,博士,主要从事药物制剂及生物药剂学的研究工作,Tel. 13840248927,E-mail 1252116911@qq.com;叶田田(1985-),女(汉族),辽宁沈阳人,教授,博士后,主要从事药物制剂和生物药剂学的研究工作,Tel. 15040057385,E-mail 729587208@qq.com。
(本篇责任编辑:马丽丽)

