马来酸卡比沙明树脂复合物包衣缓释系统的制备工艺研究
李金龙,王甜甜,王艳娇,唐星
马来酸卡比沙明树脂复合物包衣缓释系统的制备工艺研究
李金龙,王甜甜,王艳娇*,唐星
(沈阳药科大学 药学院,辽宁 沈阳 110016)
制备马来酸卡比沙明缓释混悬制剂,并考察其体外释放。通过离子交换反应,制备马来酸卡比沙明树脂复合物,并通过流化床粉末包衣技术,制备缓释颗粒,最终加入基质溶液制备成缓释混悬液制剂。研究中考察了缓释颗粒的释药机制,并比较自制制剂和参比制剂的体外释放行为。制得的药物树脂复合物混悬液的释放度与参比制剂一致。包衣药物树脂复合物的释放过程受化学交换反应、药物及反离子的扩散,以及缓释层阻滞三者综合作用的影响。树脂复合物缓释制剂制备工艺的关键为树脂的微粉包衣过程,树脂中药物与反离子的交换作用与缓释衣膜的阻滞作用共同导致药物的缓释释放行为的发生。
药剂学;马来酸卡比沙明;树脂复合物;粉末包衣;液体缓释制剂
离子交换树脂是一类惰性高分子电解质,从20世纪50年代早期开始用于口服给药系统[1]。其高聚物骨架是一种立体的三维网状结构,高分子链之间相互联结并接有各种功能基团[2]。药物树脂复合物在胃肠道中与体内K+、H+、Cl-等内源性离子进行交换。由于胃液中具有较高的H+和Cl-离子浓度,阳离子药物和阴离子药物在胃中均有较完全的释放。肠液中的K+及Cl-离子继续与药物树脂交换,释放药物并吸收入体内,因而药物树脂在胃及肠道中可持续释药[3]。由于树脂具有惰性、载药量高、无副作用、易于灭菌等特点导致它们在药物递送系统中的应用越来越广泛。目前口服缓释制剂最为成熟且已经上市的均为离子交换树脂缓释混悬剂[4]。
马来酸卡比沙明(carbinoxamine maleate,CAM)是第一代乙醇胺类的抗组胺药,在20世纪50年代早期被批准并作为单一成分处方产品销售,用于儿童各种过敏性疾病的治疗和麻疹的对症治疗,并且胃肠道副作用低。当患者服用马来酸卡比沙明的普通片剂时,为保持其血药浓度和治疗效果,患者每天需服药3、4次,对于上学儿童的用药及其不便,依从性差。马来酸卡比沙明的缓释制剂能够保持平稳的血药浓度,减少服用次数。将缓释颗粒制备成液体口服缓释制剂时不仅能够提高病人的依从性[5],还能减少胃肠道局部刺激、减小个体差异,方便儿童、老人和吞咽困难病人的用药[6]。
目前马来酸卡比沙明缓释混悬剂已有上市品种,为美国Tris Pharma有限公司研制用于2岁及以上儿童的季节性和常年性过敏性鼻炎治疗的制剂,商品名为Karbinal ER,剂量为5 mL/4 mg,其对于上百万对第二代抗组胺药无应答和第一代抗组胺药给药方案效果不理想的过敏患者是一个有吸引力的治疗选择,为现有速释制剂的一种替代药物。本文作者以仿制与原研制剂效果相同的缓释制剂为目的而展开。
1 仪器与材料
Solidlab 1流化床(德国博世公司),Chromaster高效液相色谱仪(日本Hitachi公司),RC806D溶出实验仪、ZKT-18F真空脱气仪(天津天大天发科技有限公司),FA1104电子天平(上海民桥精密科学仪器有限公司),SU8010日立新型高分辨场发射扫描电镜(日本日立公司),D/MAX2400X射线荧光光谱仪(日本Rigaku公司)。
马来酸卡比沙明(北京诺康达医药科技有限公司),聚苯乙烯磺酸钠AMBERLITE IRP 69(陶氏化学公司),Kollicoat SR 30D(德国BASF公司),1, 2-丙二醇(湖南尔康制药股份有限公司),黄原胶(湖北葛店人福药用辅料有限公司),三醋酸甘油酯(天津市光复精细化工研究所),麦芽糊精(西王药业有限公司),蔗糖(湖南九典制药有限公司),甘油(浙江遂昌惠康药业有限公司),聚山梨酯80(威尔化工有限公司),PEG4000(天津大茂化学试剂厂),甲醇(色谱纯,天津康科德化学试剂有限公司)。
2 方法与结果
2.1 马来酸卡比沙明含量及释放度的测定
采用高效液相色谱法测定马来酸卡比沙明的含量。液相条件如下:以缓冲液(取4.4 g磷酸氢二钾,加水稀释至1 000 mL,加三乙胺1 mL,用磷酸调pH值至6.3)-甲醇(体积比55:45)为流动相;色谱柱为ShiSheido C18(250 mm × 4.6 mm,5 μm)柱;检测波长为225 nm;柱温为30 ℃,进样体积为50 μL。
释放度的测定:照《中华人民共和国药典》(2015年版)四部通则0932第二法溶出度与释放度测定方法(参照Karbinal ER在美国FDA 中的释放标准),取样品5 mL(相当于4 mg马来酸卡比沙明),以0.4 mol·L-1磷酸二氢钾溶液为溶出介质,介质体积为900 mL,温度(37±0.5)℃,溶出介质均经脱气处理,转速50 r·min-1,分别于0.5、1、2、3、4、6、8和12 h取样测定取续滤液进样50mL,记录峰面积。
药物树脂复合物载药量的测定:精密称取马来酸卡比沙明药物树脂复合物50 mg,置于 0.4 mol·L-1无水磷酸二氢钾溶液1 000 mL中,20 ℃搅拌6 h,取上清液用0.22 μm的微孔滤膜过滤,取续滤液用HPLC法测定,计算树脂载药量。
2.2 载药树脂的制备
按照药物与树脂质量比为1:2的比例称取药物和树脂,加入去离子水中,于37 ℃水浴条件下搅拌4 h;静置,弃去上清液;用适量去离子水清洗3次,40 ℃条件下干燥。
2.3 载药树脂的浸渍及抗溶胀研究
干燥的凝胶型树脂遇水后会因为树脂中的磺酸基的水合作用,产生强烈的溶胀现象,如果直接将干燥树脂包衣,会使包衣层崩裂。因此在包衣前需将药物树脂进行浸渍处理。
2.3.1 浸渍剂种类浓度的考察
根据常见的树脂抗溶胀浸渍剂和对原研处方的分析[7],以PEG4000和甘油作为浸渍剂,分别配制不同浓度的PEG4000/甘油水溶液(质量分数均为5%、10%、20%、40%),考察浸渍剂浓度对溶胀效果的影响。将空白树脂置于不同浓度的PEG4000/甘油水溶液中,搅拌30 min,静置弃去上清液,收集沉淀下的树脂,60 ℃干燥。
2.3.2 树脂溶胀程度的测定
取经浸渍处理过的树脂以及空白树脂,置于10 mL量筒中,振实,记录经不同浸渍剂浸渍处理,烘干后树脂的干态体积(1);分别加入适量去离子水,浸泡24 h,记录湿态体积为(2),比较浸泡前后树脂体积,利用下式计算溶胀度():=1/2。结果见图1。
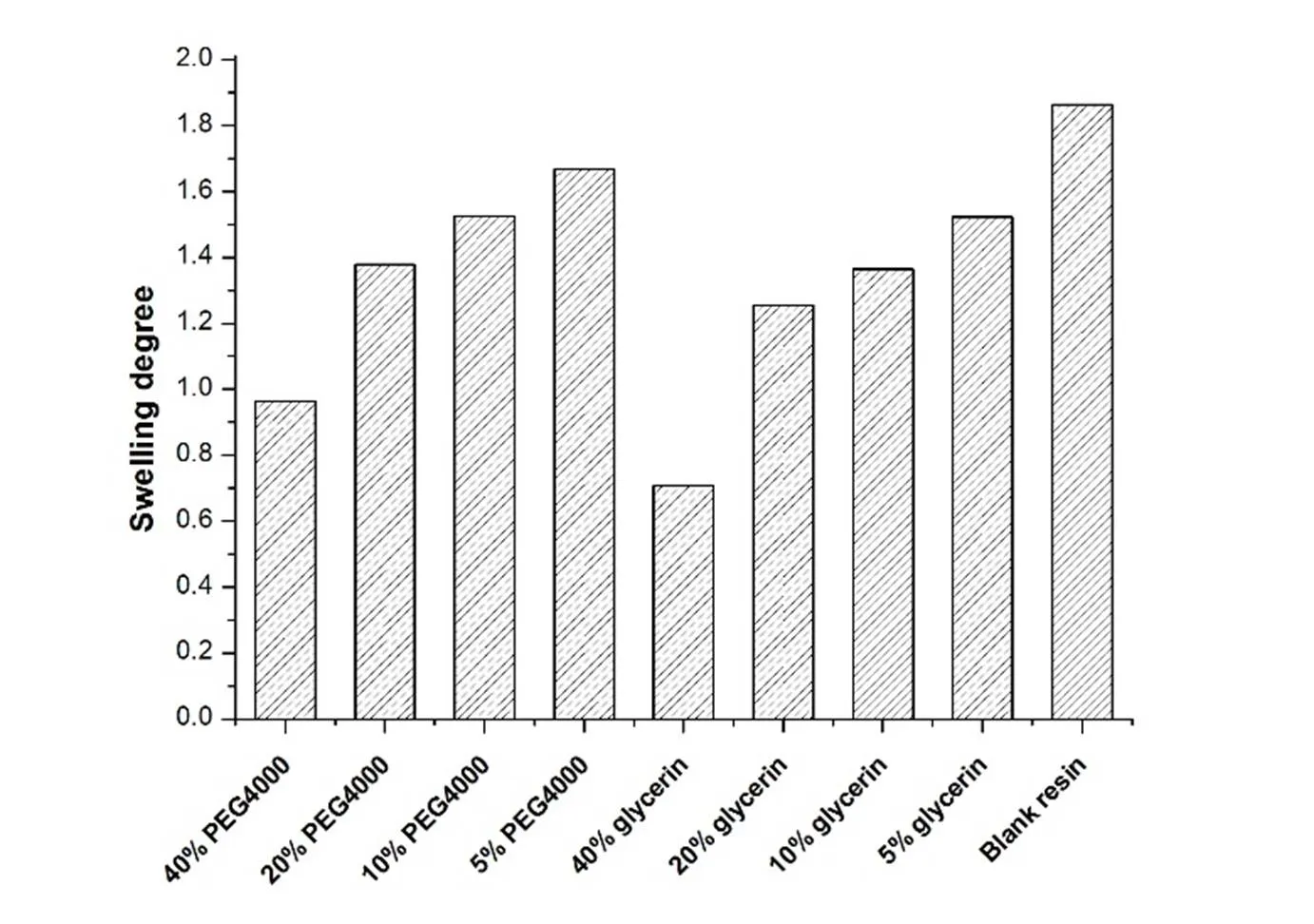
Fig. 1 Swelling degree of resin treated with different concentrations and different impregnants
从结果可知,浸渍剂的加入从表观上可以控制树脂的溶胀现象。浸渍剂的浓度越高,浸渍后树脂的溶胀程度越低。当浸渍剂PEG4000质量分数为40%时,树脂的溶胀程度接近1,因此在包衣前用质量分数40%PEG4000处理树脂。
2.4 缓释包衣树脂的制备
将缓释材料固含量为5%的增塑剂(醋酸三甘油酯/丙二醇)、3%抗黏剂(微粉硅胶)加入纯水中,搅拌均匀,将缓释包衣材料Kollicoat SR30D加入上述水溶液中,得到聚合物固体含量质量分数为15%的缓释包衣液,充分搅拌混合30 min。将100 g浸渍后的载药树脂置于流化床中,鼓风量10 m³·h-1,雾化压力0.5 bar,保护气压力200 mbar,进风温度70 ℃,物料温度28~32 ℃,进液流量3.0~4.0 g·min-1。喷液结束后继续流化30 min即得到载药树脂的包衣颗粒,分别过筛网孔径为125和180 μm(80~120目)筛,50 ℃干燥12 h。
2.5 混悬剂的制备
(1)50 mL的去离子水中,加入蔗糖,室温搅拌使溶解,继续加入麦芽糊精,使麦芽糊精完全溶解,此溶液为主溶液;(2)在另一容器中,加入甘油,在搅拌条件下,将黄原胶缓慢加入到溶液中,室温条件下,搅拌30 min,形成均匀的分散液,此溶液为胶质溶液;(3)将胶质溶液在搅拌的条件下加入到主溶液中得混合溶液。(4)在另一容器中,用适量去离子水将聚山梨酯80溶解后,加入不同包衣增重的马来酸卡比沙明-树脂复合物颗粒,搅拌分散均匀,加入混合溶液中,搅拌使包衣的药物-树脂复合物分散均匀,以去离子水稀释至终体积,混合均匀,即得混悬液。
2.6 马来酸卡比沙明药物树脂复合物体外释放的考察
2.6.1 介质离子浓度对释放的影响
取载药量33%的马来酸卡比沙明药物树脂复合物颗粒适量,分别加至900 mL去离子水,0.1、0.2和0.4 mol·L-1无水磷酸二氢钾溶液中,于37 ℃按“2.1”条释放度考察方法进行试验,考察离子浓度对释放的影响。结果见图2。
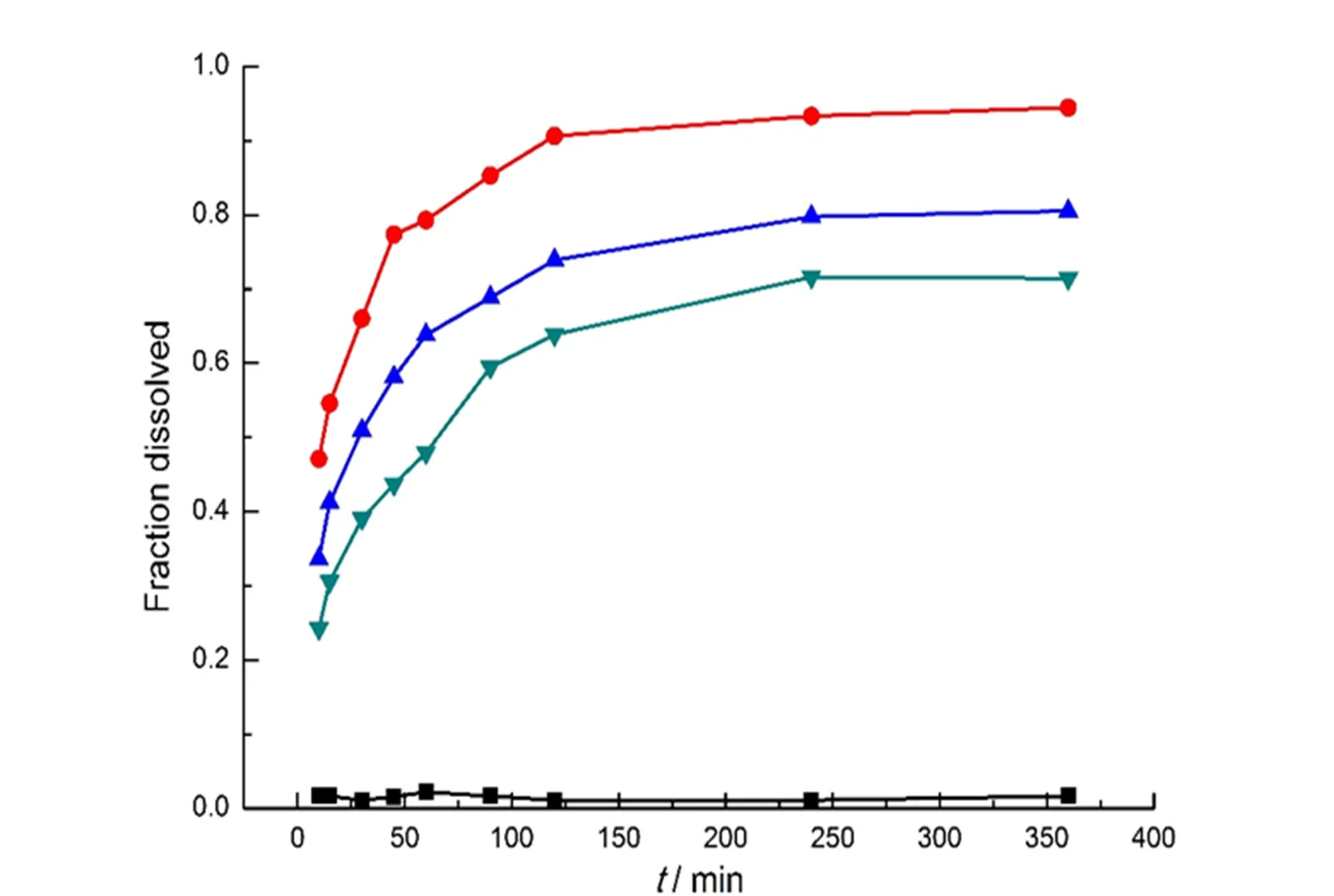
—Deionized water;—0.4 mol•L-1;—0.2 mol•L-1;—0.1 mol•L-1
从结果可知,溶出介质中的离子浓度与药物的释放行为关系密切。离子浓度大,药物释放速度加快,药物释放更完全。药物树脂复合物在水中几乎不释放,也能够证明药物是通过离子交换反应载到树脂中,而不是物理吸附。离子浓度为0.4 mol·L-1的无水磷酸二氢钾溶液在2 h能够将树脂中的药物全部置换出来。
2.6.2 药物树脂复合物载药量对释放的影响
取药物树脂比为1:1、1:2、1:5、1:10载药,即树脂颗粒载药量为47.6%、33.7%、16.7%、9.0%,粒径58~80 μm(180~250目)马来酸卡比沙明药物树脂复合物颗粒适量,分别加至0.4 mol·L-1无水磷酸二氢钾溶液900 mL中,于 37 ℃按“2.1”条释放度考察方法进行试验,考察载药量对释放的影响。结果见图3。从结果可知,在37 ℃,溶出介质为900 mL,0.4 mol·L-1无水磷酸二氢钾的溶出条件下,载药量对溶出行为没有造成显著影响。
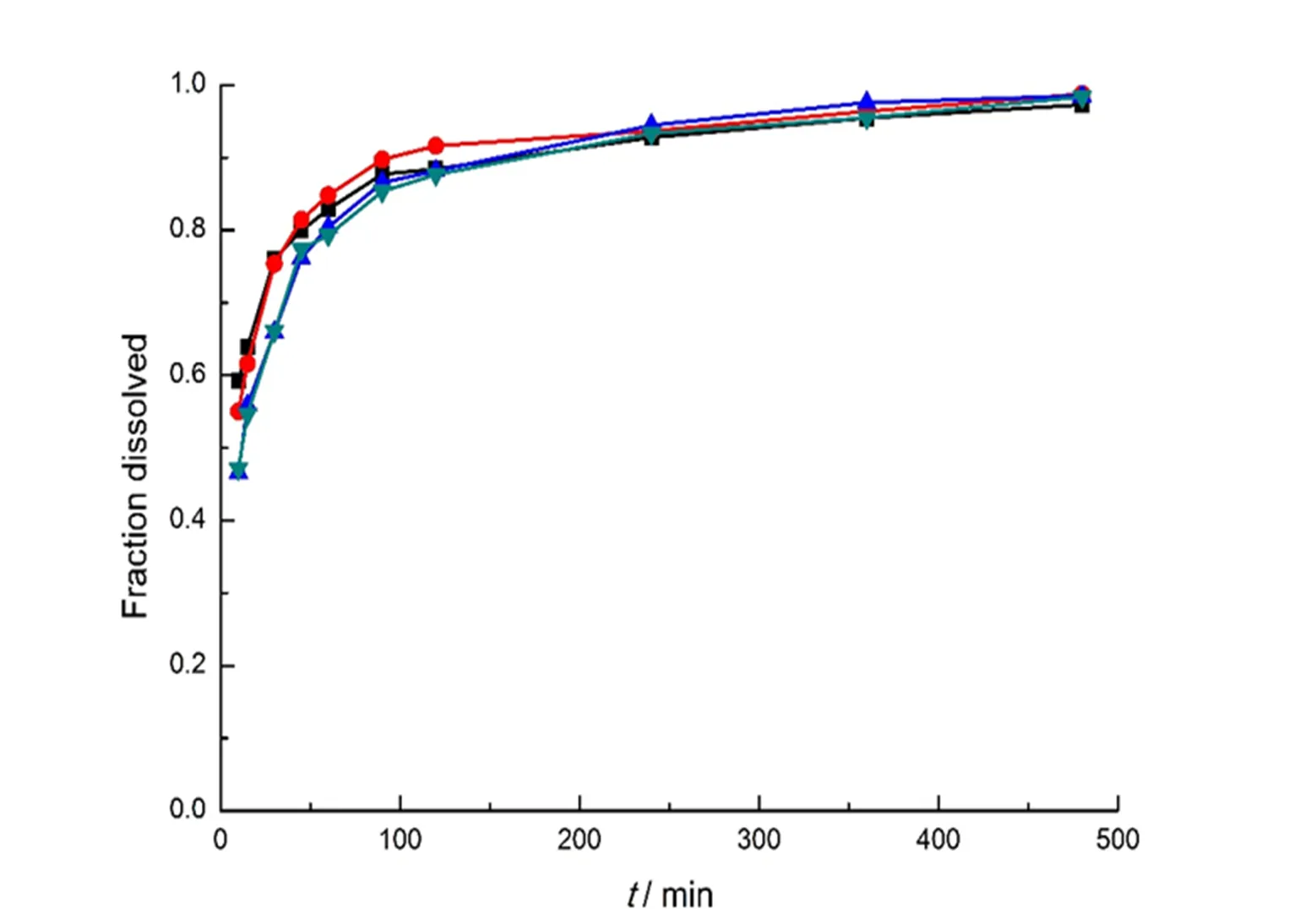
—47.6%;—33.7%;—16.7%;—9.0%
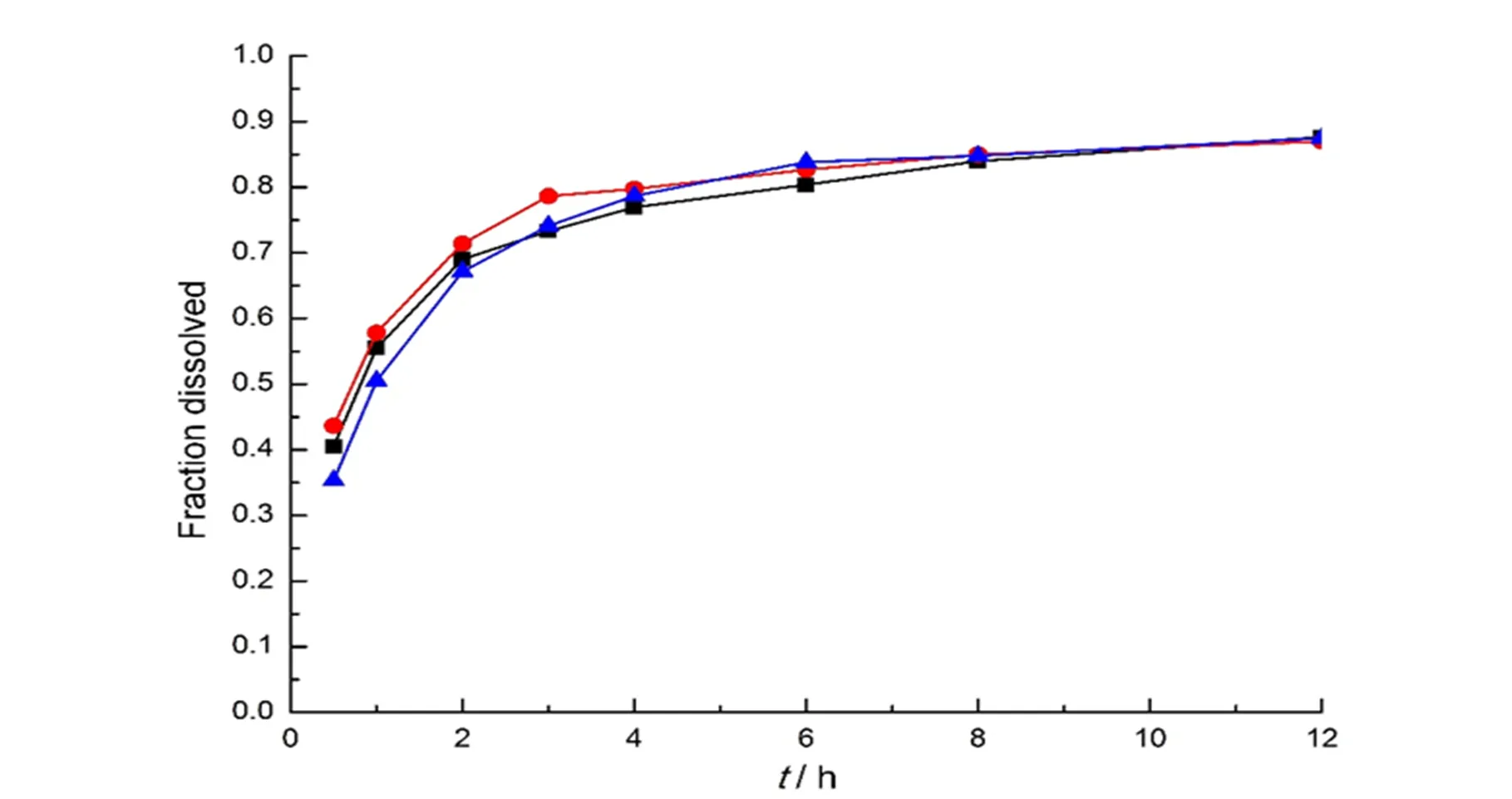
2.6.3 药物树脂复合物颗粒粒径对释放的影响

—58-80 μm;—Above 80 μm;—Below 58 μm
综合上述结果可知,在不同粒径、溶出介质、载药量下,未包衣树脂颗粒在2 h左右均释放完全,因此仅通过树脂对药物的保留作用无法达到缓释效果,对颗粒进行进一步包衣是必要的。
2.7 原研制剂处方研究
对于载药树脂的颗粒包衣工艺来说,其粒径、载药量与包衣增重为制剂的关键质量属性,因此对原研制剂的相关属性进行反向研究。
2.7.1 包衣增重以及载药量测定
取10 mL原研制剂,加入10 mL去离子水,振荡均匀,置于离心管中离心,弃去上清液,重复操作3次,收集离心管底部颗粒,加入1 mL无水甲醇、3 mL乙酸乙酯,涡旋10 min,离心,收集上清液。将上清液挥干,重复3次上述操作,减重法称定上清液中聚合物质量p。将沉淀置于60 ℃烘箱干燥过夜后精密称定。20 mL原研制剂未包衣树脂颗粒质量0,根据包衣增重=p/0,取适量原研除包衣药物树脂复合物,按照“2.1”条方法操作测定树脂复合物含量,计算载药量。测定结果表明,原研制剂的包衣增重约为30%,药物树脂复合物载药量约为9%。
本研究中药物树脂复合物按照药物树脂比为1:2制备,载药量为33%。因为在0.4 mol·L-1磷酸二氢钾溶液中,药物含量对药物树脂复合物的释放行为无显著影响,为提高药物利用率,选择载药量33%的药物树脂复合物颗粒进行后续研究。
2.7.2 包衣药物树脂复合物颗粒粒径的测定
通过激光散射粒度仪,采用湿法测定原研制剂中颗粒粒径,结果见图5。参比制剂的D10为8.042 μm、D50为136.2 μm、D90为245.5 μm,由于原研基质中有部分不溶性颗粒导致D10较小,因此选取D50、D90更能代表树脂颗粒真实值。

Fig. 5 Particle size distributions of coated drug-resin complex in reference formulation
2.8 马来酸卡比沙明混悬剂体外释放影响因素的考察
2.8.1 增塑剂种类和比例对释放的影响
表2所示为7个模拟工况下的数值计算结果, 在不改变其他条件的情况下, 讨论气液两相冲压发动机航行速度对其性能的影响. 从表中可以看出, 随着航行速度的增加, 发动机比冲呈现先增大后减小的趋势, 说明在通入气体质量流率一定的情况下, 存在一个最优速度使得发动机性能最佳.
选择三醋酸甘油酯和1, 2-丙二醇作为增塑剂,分别配制增塑剂质量分数为5%、10%和20% Kollicoat SR 30D固含量的包衣液,按颗粒增重35%对载药树脂进行包衣。经50 ℃老化12 h,测定体外释放,结果见图6。三醋酸甘油酯会极大的降低包衣材料的最低成膜温度,导致在包衣过程中出现粗头、堵枪和塌床现象,导致包衣过程不顺利,包衣增重不准确,收率仅为47.1%。而当丙二醇作为增塑剂时,没有出现聚集成大颗粒的现象,收率高达95%。不同浓度的丙二醇对释放的影响不明显,因此选择质量分数5%丙二醇作为增塑剂。
—5%;—10%;—15%
2.8.2 包衣颗粒粒径对释放的影响
包衣药物树脂复合物颗粒的粒径越大,颗粒的比表面积越小,药物扩散的面积、颗粒与外界环境中离子接触的概率越小,外界环境中离子与药物树脂复合物颗粒中药物置换速度相对较慢,反之,离子与药物的置换速度越快。因此需要进一步考察粒径对释放的影响。分别取180~270 μm(50~80目)、120~180 μm(80~120目)、小于120 μm(120目)的包衣药物—树脂复合物颗粒,照“2.5”条方法制备制剂,照“2.1”项下释放度的测定方法,考察样品粒度对释放的影响。
由图7可知,包衣药物树脂复合物颗粒的粒径会影响药物的释放,在所考察粒度范围内,粒径越大,药物的释放越慢。当浸渍的药物树脂复合物颗粒粒径为120~180 μm(80~120目)时,其混悬液的释放行为与原研最为接近。随着浸渍的药物树脂复合物颗粒粒径的减小,其释放速度加快。因此,药物树脂复合物颗粒粒度选择为120~180 μm(80~120目)。

—120-180 μm;—Below 120 μm;—180-270 μm
2.8.3 包衣增重对释放的影响
照“2. 3”项下的包衣液配方和包衣参数对同一批载药树脂进行包衣,取包衣增重25%、35%、50%和70%的包衣树脂颗粒,50 ℃老化12 h,分别过孔径为120 μm(80目)和180 μm(120目)筛测定体外释放度。结果见图8,可以看出,包衣增重在50%以下不能有效控制药物的释放,增重70%以上药物释放不完全,进一步将包衣增重调整为55%和60%,释放曲线见图8,增重55%的包衣树脂颗粒释放符合要求。
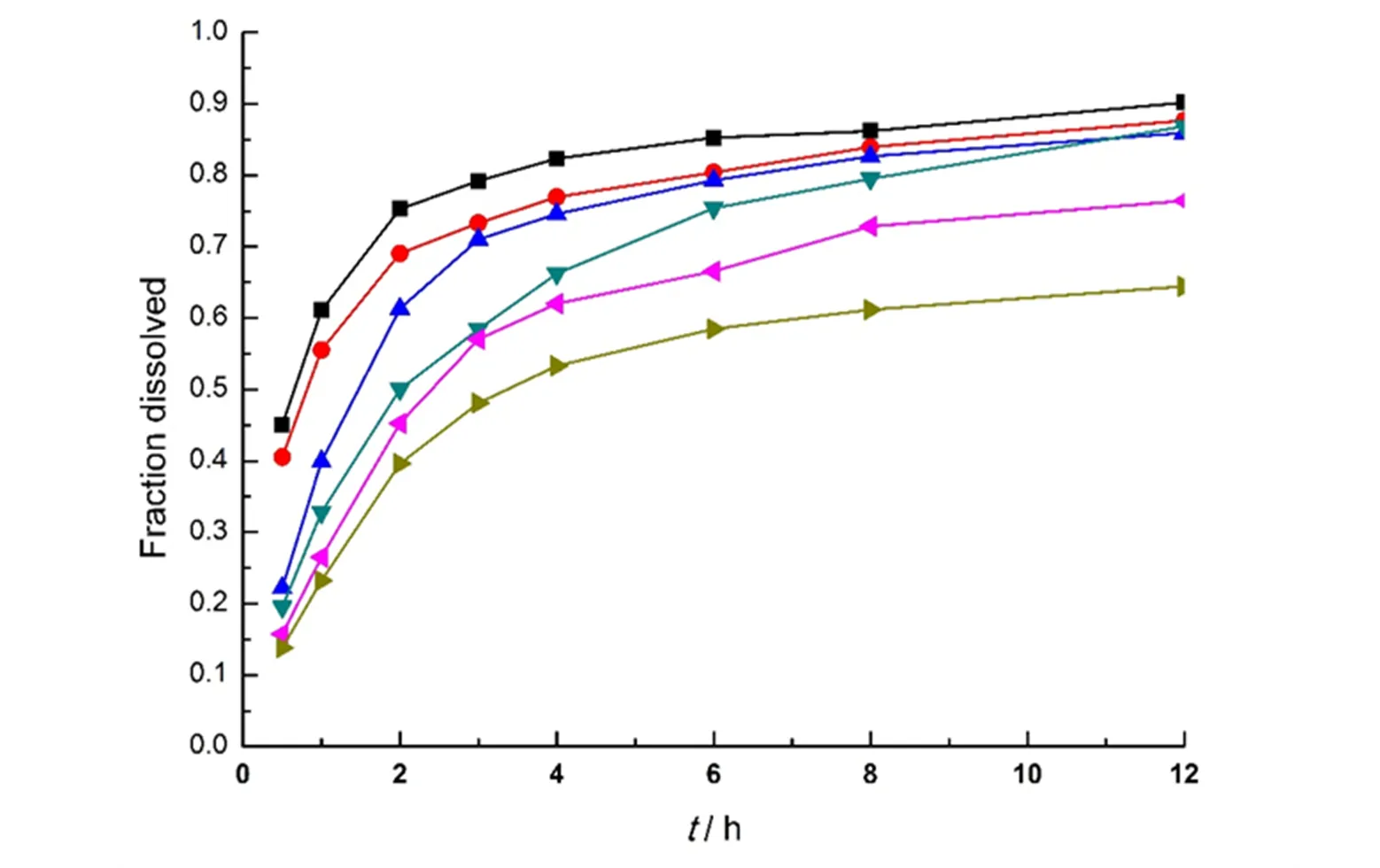
—25% coating levels;—35% coating levels;—50% coating levels;—55% coating levels;—60% coating levels;—70% coating levels
2.8.4 老化时间对释放的影响
将粒径为120~180 μm包衣树脂颗粒置于50 ℃烘箱中,分别考察老化时间0、12和24 h对树脂中药物释放的影响,结果见图9。老化后的包衣树脂相对于没老化的包衣树脂具有更好的控制药物释放效果,说明在老化过程中衣膜变得更致密和完整。而老化12 h和老化24 h的包衣树脂没有明显的差别,所以选择12 h为老化时间。
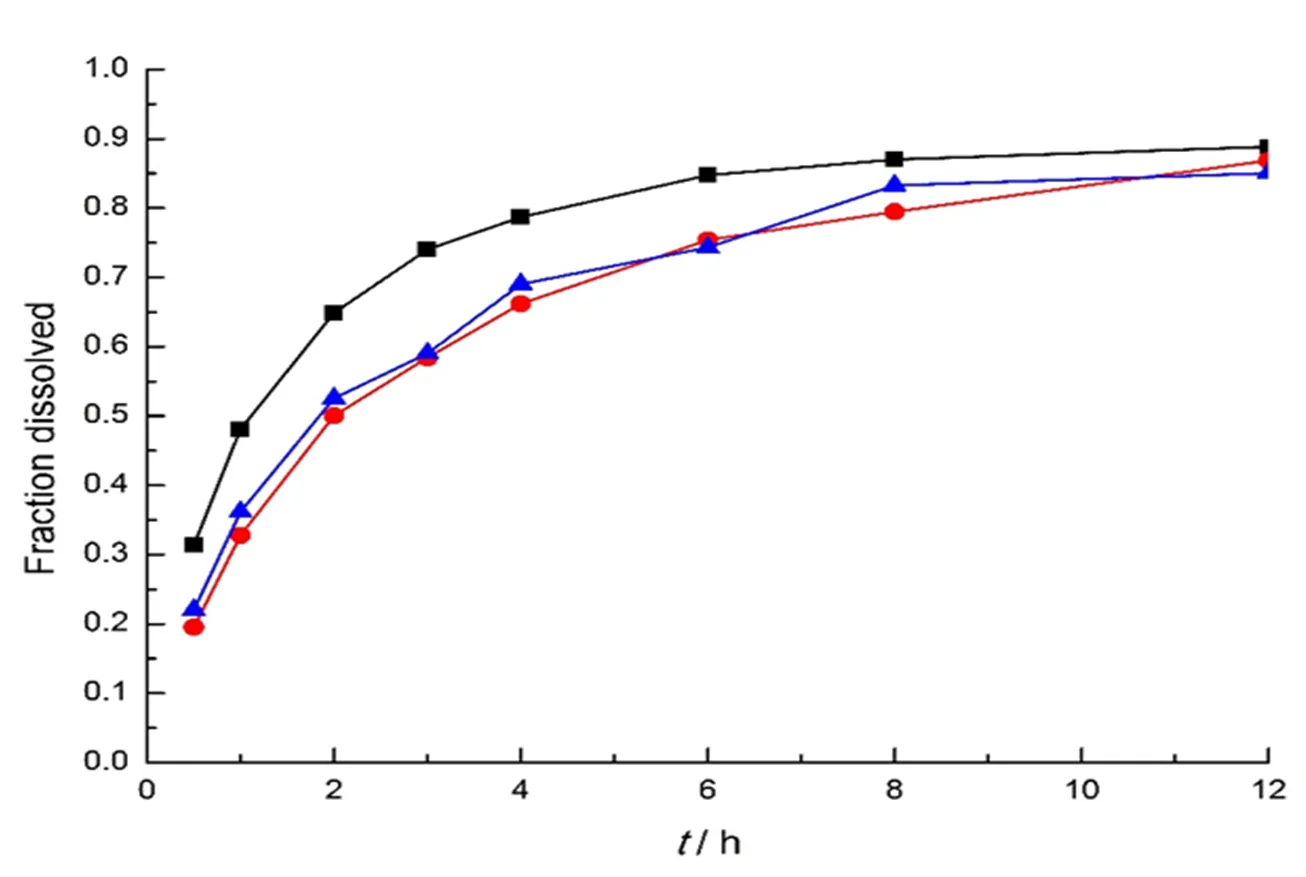
—0 h;—12 h;—24 h
2.8.5 自制制剂与原研制剂的对比
取粒径120~180 μm(80~120目),增重55%,老化12 h的包衣树脂颗粒分散于混悬剂基质中制备自制制剂。分别取5 mL自制与原研制剂进行溶出实验,结果见图10。2相似因子为78.92,证明自制制剂与原研制剂体外释放具有良好的一致性。

—Reference formulation;—Test formulation
2.9 药物树脂复合物与包衣颗粒的表征
2.9.1 树脂复合物粉末X射线衍射测定
取马来酸卡比沙明原料药、空白Amberlite IRP69 阳离子交换树脂,以及药脂比为1:2和1:10的载药树脂复合物和物理混合物适量,进行 X-射线衍射扫描,仪器工作条件为Cu-Ka靶石墨单色器衍射束单色比(56 kV,182 mA),扫描速率为 2°·min-1,2角度为5~60°,结果见图11。
从X射线衍射图谱中可以看到马来酸卡比沙明在2=9.8°、20.2°、23.3°和25.4°均发现较强的结晶衍射峰,证明马来酸卡比沙明具有晶体结构。而空白树脂谱图中只有一个大的单一衍射峰。物理混合物则是两者谱图的简单叠加。载药树脂的谱图中,马来酸卡比沙明的晶体衍射峰消失,据此推断药物通过离子交换反应以分子状态分布于树脂中,而不是简单的物理吸附。
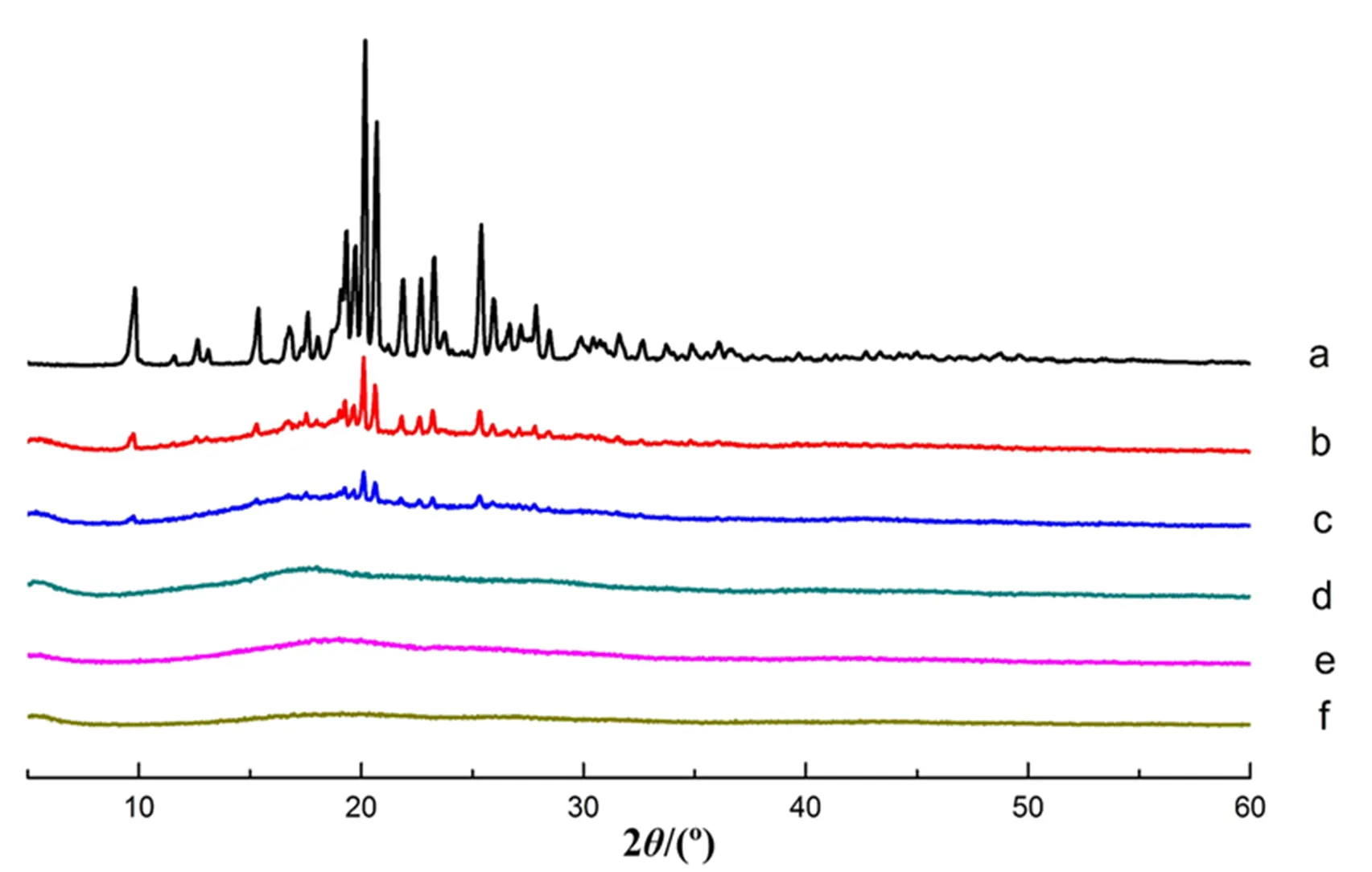
a—CAM;b—Physical mixture 1:2;c— Physical mixture 1:10;d—Blank resin;e—Drug-resin complex 1:2;f—Drug-resin complex 1:10
2.9.2 药物树脂复合物与包衣树脂颗粒外观
应用扫描电镜(scanning electron microscope,SEM),对空白树脂、载药树脂以及包衣树脂颗粒进行显微观察,结果见图12、13。结果表明,空白树脂与载药树脂均为不规则颗粒,而且树脂载药之前与载药之后树脂外观无明显差异。而包衣后的载药树脂的表面存在明显的包衣层,并且衣膜完整。证明工艺的可行性高,实用价值高。

Fig. 12 SEM photographs of blank resin (A) and drug loaded resin granule(B)

Fig. 13 SEM photographs of coated drug loaded resin granule
2.9.3 包衣树脂颗粒的粒径测定
通过激光散射粒度仪,湿法测定原研制剂中颗粒粒径,结果见图14。D50为140 μm,D90为245 μm,与原研制剂接近。证明流化床粉末包衣工艺对树脂颗粒包衣的可行性良好。
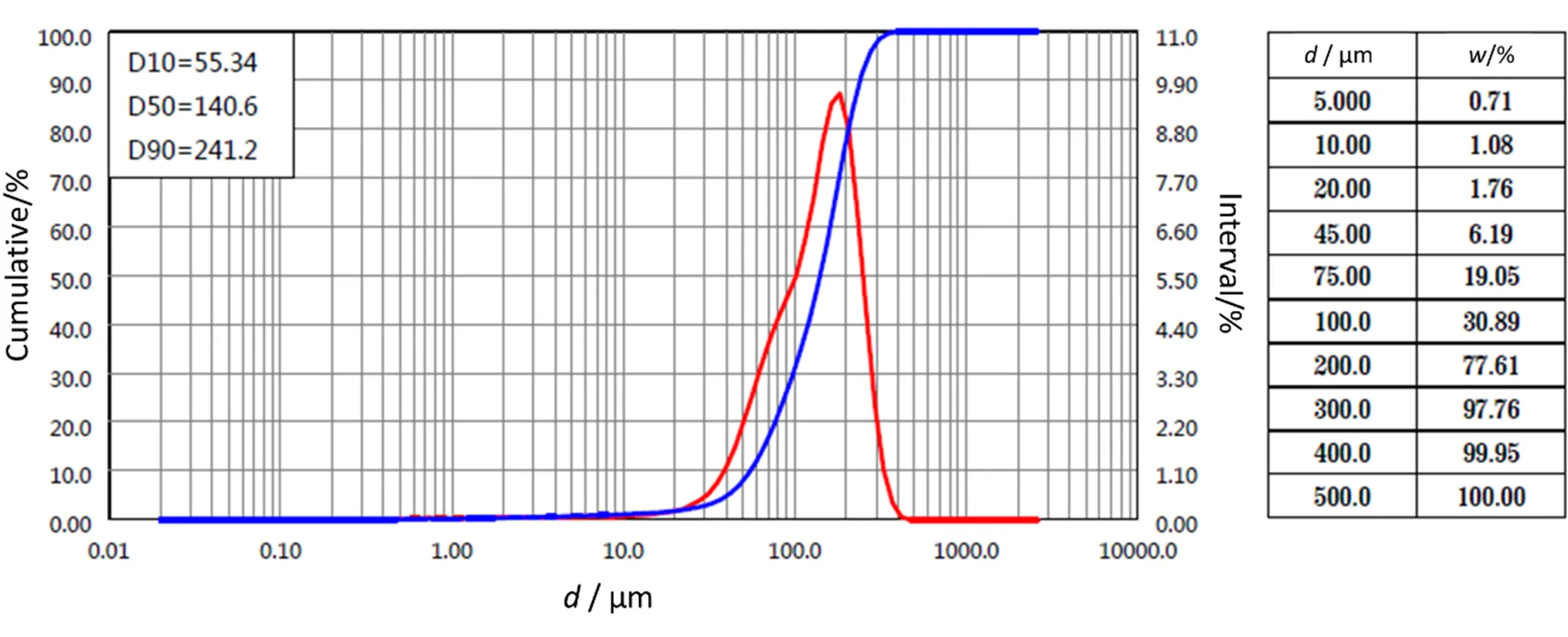
Fig. 14 Particle size distribution of coated drug-resin complex
2.10 释放动力学研究
对包衣树脂颗粒在0.4 mol·L-1磷酸二氢钾盐缓冲液中的释放度进行整体以及分段的释药动力学拟合,结果见表1。结果表明包衣药物树脂复合物的释药过程能够与Weibull模型较好拟合。药物从包衣药物树脂中的体外释放包括两个过程:即药物从树脂中释放和药物通过控释膜扩散。如图15所示,药物首先被溶液中的反离子交换下来,再扩散通过缓释衣层。药物的释放受两者综合作用的影响,因此不能通过简单的缓控释制剂的一级或零级药物释放动力学对其进行拟合,避免影响药物真实释放过程[7]。因此选用Weibull模型对其释放行为进行描述[8]。
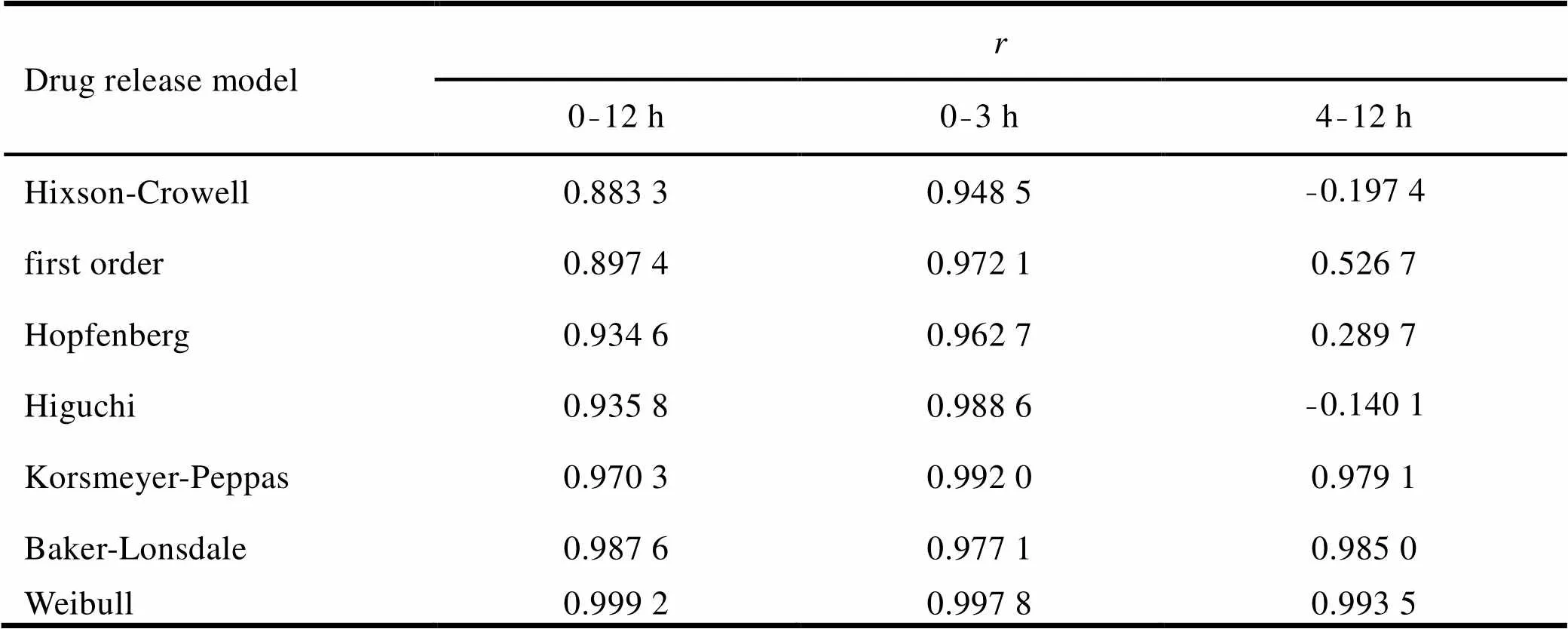
Table 1 Model simulated for the release profile of the suspension of coated drug-resin complex granule
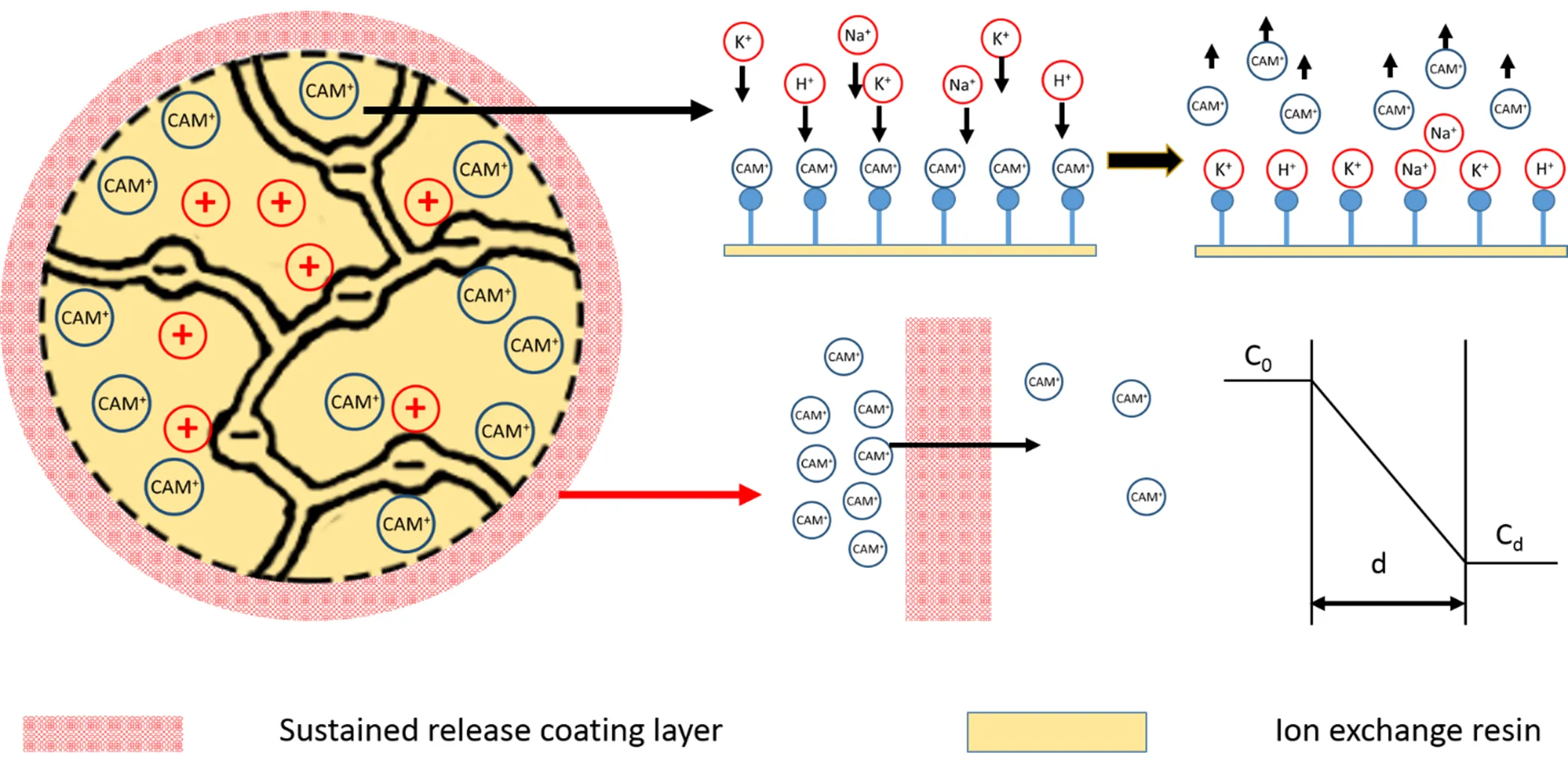
Fig. 15 Drug release mechanism diagram of coated drug-resin complex granules
3 讨论
a. 马来酸卡比沙明制备成缓释制剂后能够减少用药次数,保持稳定的血药浓度,显著提高患者的顺应性。微粉包衣颗粒属于多单元给药系统并且拥有较小的颗粒粒径,在胃肠道转运不受胃排空影响,能够迅速均匀分布于胃肠道黏膜,局部刺激性小、生物利用度高[9]。
b. 目前基于离子交换原理的缓释制剂的制备方式多采用乳化挥发法、喷雾干燥法、剪切制粒法等。乳化挥发法通常使用液体石蜡、丙酮、氯仿等制备O/O乳剂[10],过程会引入大量有机溶剂,溶剂残留无法解决;喷雾干燥法不适合颗粒包衣,由于包衣材料与树脂颗粒的密度不同,在雾化过程中树脂颗粒与包衣液分离,导致包衣效率低;剪切制粒制备包衣颗粒,包衣材料的加入量相对偏高,包衣效率低,稳定性差;流化床粉末包衣技术是将口服药物树脂缓控释系统运用到实际生产中的最合适的制剂制备手段,但传统wuster流化床由于其构造原因导致对粉末包衣的效率非常低,本实验用到的为Solidlab 1流化床,其结构不带有wuster桶,包衣和干燥效率更高,采用涡轮流化方式使得粉末运动更均匀,包衣效果更理想,包衣过程顺利。
c. 药物以离子交换树脂为载体进行递药,其优势在于离子交换树脂中的药物释放依赖于离子环境,因此在吸收部位不易受其他条件(如酶含量、pH值)的影响。另外树脂颗粒粒径小,受胃内容物和胃排空的影响小,吸收速率差异小。本研究中,离子交换药物释放达到要求时的包衣增重为55%,增重相对较高,这是由于粉末比表面积较大,需要较大的增重才能阻滞药物的释放,另一方面马来酸卡比沙明在释放介质中溶解度较高,离子交换反应较快,药物在被释放介质中的离子置换下来后会形成较大的渗透压梯度,因此需要更厚更致密的衣膜阻滞药物的释放速度。
d. 与Eudragit材料相比,Kollicoat材料稳定性好、成膜温度低、老化时间短,能更快形成完整稳定的衣膜,受增塑剂及老化时间的影响较小[11];由于Kollicoat材料自身不受介质pH及盐离子的影响,具有释放速率不受介质影响的优势,更适合基于离子交换原理的缓释制剂的制备。
[1] COCKRELL, JANICE L. Acute hallucinogenic reaction to carbinoxamine maleate[J]. Clinical Toxicology, 1987, 25(1/2): 161-167.
[2] GUO X, CHANG R K, HUSSAIN M A. Ion-exchange resins as drug delivery carriers[J]. Journal of Pharmaceutical Sciences, 2009, 98(11): 3886-3902.
[3] 罗杰英, 王玉蓉, 张自然, 等. 现代物理药剂学理论与实践[M]. 上海: 上海科学技术文献出版社, 2005: 324.
[4] 唐星. 口服缓控释制剂[M]. 北京: 人民卫生出版社, 2007: 26.
[5] SAHOO P K, BENIEN P, GUPTA S. Ion exchange resins transforming drug delivery systems[J]. Current Drug Delivery, 2010, 7(3):.
[6] ALAYOUBI A, DAIHOM B, ADHIKARI H, et al. Development of a taste-masked oral suspension of clindamycin HCl using ion exchange resin Amberlite IRP 69 for use in pediatrics[J]. Drug Development and Industrial Pharmacy, 2016,42(10): 1-11.
[7] 李振华, 平其能, 刘国杰. 口服液体控释给药系统研究进展(综述)[J]. 药学进展, 1998, 30(1): 9-15.
[8] IGNACIO M, CHUBYNSKY M V, SLATER G W. Interpreting the Weibull fitting parameters for diffusion-controlled release data[J]. Physica A Statistical Mechanics & Its Applications, 2017, 486(15): 486-496.
[9] ANAND V, KANDARAPU R, GARG S. Ion-exchange resins: carrying drug delivery forward[J]. Drug Discovery Today, 2001, 6(17): 905-914.
[10] GHEORGHE F, MARIETA C, ELISABETTA E, et al. Cellulose acetate butyrate microcapsules containing dextran ion-exchange resins as self-propelled drug release system[J]. Biomaterials, 2005, 26(20): 4337-4347.
[11] DASHEVSKY A, WAGNER K, KOLTER K, et al. Physicochemical and release properties of pellets coated with Kollicoat? SR 30 D, a new aqueous polyvinyl acetate dispersion for extended release[J]. International Journal of Pharmaceutics, 2005, 290(1/2): 15-23.
Study on preparation technology of carbinoxamine maleate-resin complex coating sustained-release system
LI Jinlong,WANG Tiantian,WANG Yanjiao*,TANG Xing
(,,110016,)
To prepare a sustained-release suspension of carbinoxamine maleate and investigate the release of drug.Carbinoxamine maleate resin complex was prepared by ion exchange reaction, then the sustained-release granules were prepared by fluidized bed microparticle-coating techniques. Finally, the blank matrix solution was applied to prepare a sustained-release suspension. The drug release mechanism of sustained-release granules was investigated.release behaviors of the test formulation and the reference formulation were compared.The release behavior of the prepared resin complex suspension was consistent with the release of the reference formulation. The release process of coated resin was influenced by ion exchange reaction, diffusion of drug and counter ion, and retardation of sustained-release layer.The key to the preparation process of resin complex sustained-release suspension is the microparticle-coating. The exchange effect between the drug and counter ion in the resin and the retardation of the sustained-release coating film together contributed to the sustained release behavior of the drug.
carbinoxamine maleate;drug-resin complex;microparticle-coating;liquid sustained release formulation
R94
A
(2020)02–0079–14
10.14146/j.cnki.cjp.2020.02.001
2019-05-09
李金龙(1992-),男(汉族),辽宁沈阳人,硕士研究生,E-mail Lijinloong@126.com;
王艳娇(1968-),女(汉族),辽宁大连人,副教授,硕士,主要从事药物新剂型及中药现代化的研究工作,Tel. 024-23986343,E-mail tangpharm@ sina.com。
(本篇责任编辑:马丽丽)

