经导管主动脉瓣置换术在肾移植患者中的应用1 例
刘峰源 苏宋丹 徐承义 郭卉 张龙岩 王波
1 临床资料
患者 男,62岁。因“反复胸痛2年余,加重1个月”于2018年9月至武汉科技大学附属亚洲心脏病医院就诊。既往有慢性肾病及透析病史5年,遗留有右侧前臂动静脉内瘘。7年前行肾移植手术,术后长期服用糖皮质激素与免疫抑制药;有高血压病史7年,长期口服氨氯地平(5 mg/次,每日1次)治疗,血压控制良好;否认吸烟史。入院查体:一般情况可,血压101/58 mmHg(1 mmHg=0.133 kPa),心率68次/分,律齐;主动脉瓣第一、二听诊区可闻及收缩期3/6级喷射样杂音,伴有颈部传导;右侧腹部可见陈旧性手术瘢痕(肾移植手术);右前臂可见既往动静脉内瘘手术瘢痕;双下肢无水肿。实验室检查示:血肌酐156 μmol/L,N末端B型脑钠肽前体12 195 pg/ml,肌钙蛋白I 0.087 ng/ml。心电图示:窦性心律,Ⅰ、aVL、V4~V6导联ST段压低并T波倒置或双向。超声心动图示:主动脉瓣、瓣环钙化并主动脉重度狭窄(峰值流速5.6 m/s,最大跨瓣压差123 mmHg,平均流速4.1 m/s,平均跨瓣压差79 mmHg),合并主动脉瓣重度关闭不全,室间隔、左心室壁均匀性肥厚,左心室射血分数50%。冠状动脉CT血管造影(coronary CT angiography ,CTA)示:冠状动脉粥样硬化、左前降支心肌桥。初步诊断:心脏瓣膜病、重度主动脉瓣狭窄(aortic stemosis,AS)、重度主动脉瓣反流,纽约心脏病协会(New York Heart Association,NYHA)心功能分级Ⅱ级。经心血管内外科、血管外科、麻醉科、心脏超声科、影像科等多学科团队讨论,建议行经导管主动脉瓣置换术(transcatheter aortic valve replacement,TAVR)。TAVR术前CT评估结果示:主动脉瓣二叶瓣(0型)重度钙化,部分钙化延伸到左心室流出道,升主动脉内径39.1 mm,窦管交界内径34.1 mm,瓣环面积555.7 mm2,瓣环内径26.6 mm,左心室流出道内径26.2 mm(图1),左冠状动脉高度12.9 mm,右冠状动脉高度17.4 mm,左、右股动脉直径均在6.3~8.7 mm。
患者术前充分水化,术中全身麻醉,选工作体位,外科切开暴露左侧股动脉,留置20 F动脉血管鞘管作为主要入径,经左侧桡动脉入径送猪尾导管至主动脉窦底部指导瓣膜支架定位。经20 F动脉血管鞘送入22 mm×40 mm NuMED球囊(纽曼公司,美国)至主动脉瓣环水平,快速起搏(180次/分),球囊扩张并经猪尾导管行升主动脉造影,左、右冠状动脉球囊显影良好,未见明显主动脉瓣反流,置入L26(杭州启明医疗器械有限公司)主动脉瓣膜支架,以升主动脉造影以及经食管超声心动图(transesophageal echocardiography,TEE)评估中度主动脉瓣周漏,瞬时反流量达7 ml,考虑与患者瓣环钙化及人工瓣贴壁不良相关,再以23 mm×40 mm NuMED球囊(纽曼公司,美国)后扩张,以TEE再次评估显示轻度主动脉瓣周反流,瞬时反流量2 ml,左心室与升主动脉跨瓣压差为6 mmHg,收缩期主动脉瓣口前向血流速度达1.56 m/s,结束手术,外科缝合处理伤口,患者返回心内科重症监护病房(图2 A~C)。术后有低热,最高体温达38.2℃,给予头孢哌酮舒巴坦静脉滴注抗感染治疗3 d,体温恢复正常。3 d后转至普通病房,术后6 d康复出院。
出院后给予阿司匹林(100 mg、每日1次口服)、氢氯吡格雷(75 mg、每日1次口服)双联抗血小板聚集治疗,拟于6个月后口服以上其中一种单联抗血小板聚集治疗,继续服用糖皮质激素与免疫抑制药[1]。术后1个月门诊随访,患者临床无胸痛等症状,超声心动图示:主动脉瓣轻度瓣周反流,主动脉瓣峰值流速2.2 m/s,跨瓣压差29 mmHg,平均流速1.4 m/s,平均跨瓣压差12 mmHg(图2 D)。
2 讨论
AS是最常见的成人心脏瓣膜病之一,当重度AS患者出现心力衰竭、心绞痛、晕厥等临床症状时,若保守治疗,预后效果极差,2年病死率高达50%[2]。有研究发现,在慢性肾功能衰竭患者中,AS的发病率较普通人群更高,此类患者血液中的磷酸盐、血钙水平较高,导致钙磷代谢紊乱,其中转移性钙化是肾功能衰竭患者的重要并发症,不仅影响到瓣膜尖瓣或环,而且还会影响到心肌,产生心力衰竭或完全性心脏传导阻滞[3-6]。在肾功能衰竭或透析的患者中,常常因为贫血及动静脉漏致心输出量增加,常合并高血压导致瓣膜机械应力过大,出现瓣膜过早钙化,使得二尖瓣和主动脉瓣更早发生病变。心血管病和心脏瓣膜病常常是肾功能衰竭及肾移植患者主要的死亡原因之一[7]。
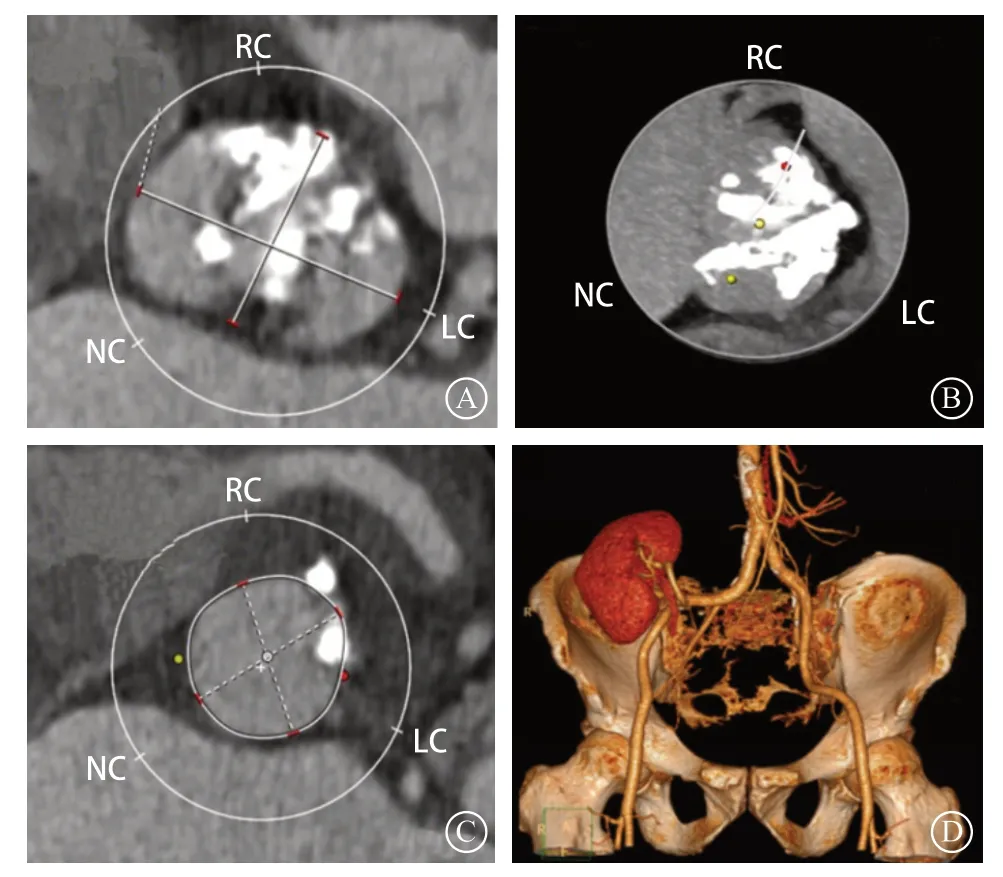
图 1 TAVR术前CT评估结果 A. 主动脉瓣二叶瓣(0型);B. 重度钙化,部分延伸到左心室流出道,计算钙化积分1667 mm3;C. 瓣环面积555.7 mm2,瓣环内径26.6 mm,瓣环不均匀钙化;D.右侧髂窝内见移植肾,皮、髓质分辨清晰,未见异常密度,移植肾动脉开口于右侧髂总动脉,肾血管显影好
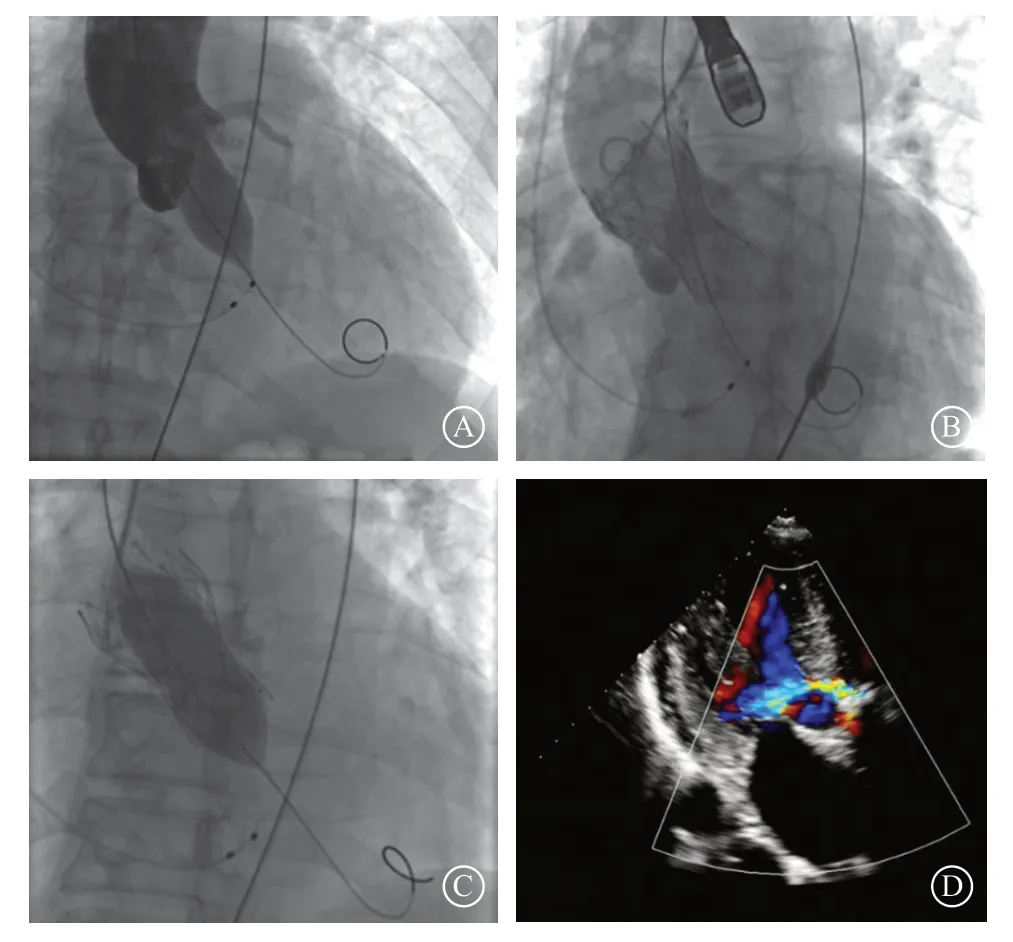
图 2 术中数字减影造影图像及术后复查经胸超声心动图 A. 球囊实时评估(balloon sizing)显示左、右冠状动脉球囊显影良好,未见明显主动脉瓣反流;B. 选择并置入L26(杭州启明医疗器械有限公司)主动脉瓣膜支架后升主动脉造影显示中度主动脉瓣周漏,升主动脉造影可见冠状动脉分支显影,无冠状动脉闭塞;C. 选择23 mm×40 mm NuMED球囊(纽曼公司,美国)后扩张,经食管超声心动图再次评估显示轻度主动脉瓣周漏,结束手术;D. 术后1个月复查经胸超声心动图,主动脉瓣架外短轴约10点及1点方向可见轻度反流信号,反流束宽约0.2 cm、0.1 cm
外科主动脉瓣置换术(surgical aortic valve replacement,SAVR)是重度AS首选治疗方案。但对于存在外科手术禁忌或外科手术高危[美国胸外科医师协会(Society of Thoracic Surgeons,STS)评分≥8分]的患者,推荐TAVR[8]。本例患者重度AS合并关闭不全,临床上存在心绞痛与心力衰竭症状,STS评分2.89分,具备SAVR适应证。应首选SAVR,但患者有肾移植病史,且术后长期服用激素及免疫抑制药。有研究表明,对于合并慢性肾病的高危患者,与SAVR相比,TAVR具有更低的死亡率、更少的急性肾损伤及更短的住院时间[9-12]。美国肾疾病注册研究数据显示,肾移植患者接受外科瓣膜手术住院期间死亡率为14%,2年死亡率为40%。肾移植应视为独立于STS评分系统之外的外科手术高危判断标准[13]。Fox等[14]研究纳入26例肾移植术后症状性重度AS患者,8例接受TAVR治疗(6例经股动脉入径,2例经心尖入径),18例接受SAVR治疗。结果显示,SAVR组患者30 d病死率为11.1%,12个月随访病死率为16.7%,相比于SAVR组,TAVR组患者手术成功率为100%,12个月随访无死亡事件。肾移植患者TAVR的结果令人鼓舞,但也有文献报道2例肾移植患者TAVR术后严重并发症,即主动脉根部破裂,其是否与慢性免疫抑制药治疗相关,值得进一步研究[15]。最后,TAVR术后急性肾损伤同样需要积极防治,TAVR术后1周内急性肾损伤发生率为28%,住院期间需要肾替代治疗的发生率为3%[16]。TAVR术后急性肾损伤常见预测因素见表1[17-20]。
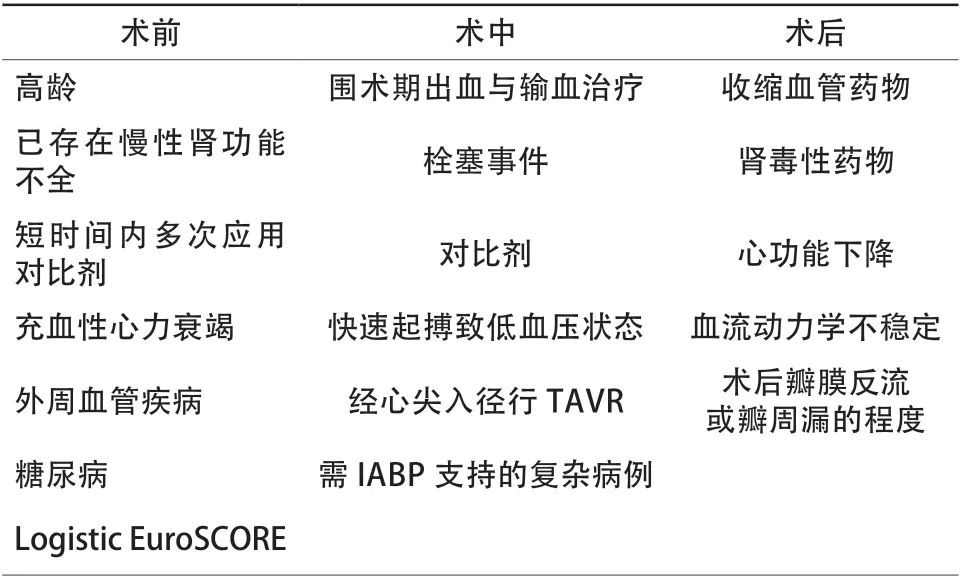
表1 TAVR 术后急性肾损伤常见预测因子
本例患者经心脏团队讨论后推荐TAVR,因右侧有移植肾,植入瓣膜的导管会对肾动脉血供造成影响。为避免造成损伤,故选择左侧股动脉入径,术前CTA评估后5 d安排TAVR,避免短时间内多次应用对比剂。术前充分水化以降低术后对比剂肾病风险。选择股动脉入径,术中外科切开暴露股动脉置管,可避免微穿针造影评估入径及术后评估血管并发症所用的对比剂。术中严格控制对比剂剂量,应用TEE评估瓣膜中心反流以及瓣周反流程度。术后预防性应用抗生素抗感染治疗,避免使用收缩血管药物和肾毒性药物。尽管如此,该患者术后仍然出现感染,随着瓣膜狭窄解除后心功能改善,感染得以有效控制,出院前肾功能、体温恢复正常。目前关于TAVR应用于慢性肾功能衰竭和(或)肾移植人群中的研究较少。本病例为国内首次报道,临床经验有限,以期为此类患者疾病治疗提供参考。

