化脓隐秘杆菌候选抗原的免疫保护效果测试
徐登峰,余远迪,张素辉,付利芝,许国洋,赵扬扬,沈克飞
(1.重庆市畜牧科学院,重庆 402460;2.重庆市兽用生物制品工程技术研究中心,重庆 402460)
化脓隐秘杆菌(Trueperellapyogenes)是革兰氏阳性细菌,是山羊化脓性肺炎的主要病原之一,感染导致肺脏组织不可逆损伤,严重影响羔羊的存活率[1-2]。化脓隐秘杆菌是革兰氏阳性菌,主要寄生在动物的呼吸道、消化道、生殖道等黏膜,属于一种共生性条件致病菌,通常导致多种动物的肺脏脓肿、肝脓肿、脑脓肿、乳腺炎、子宫内膜炎、流产和死胎等[3-5]。
在哺乳动物体内,游离铁含量极低,细胞外的铁与转铁蛋白和乳铁蛋白结合,细胞内的铁与血红蛋白等蛋白质有关的血红素结合。获取铁的能力是许多致病菌致病的必要条件,致病菌需要利用自身表达的ATP结合盒(ATP binding cassette,ABC)转运体等系统从宿主体内摄取铁,以抵御宿主的杀菌作用,维持生存和毒力[6-7]。ABC转运体由ABC型膜透酶(Permease)、ATP结合蛋白质(或称ATP酶,ATPase)和底物结合蛋白(Substrate-binding protein,SBP)组成,不同类型的ABC转运体转运不同的底物。在ABC系统中,底物首先被SBP结合,然后通过ATP驱动的渗透作用穿过膜。SBP在革兰氏阴性菌中定位于周质空间,在革兰氏阳性菌中定位于细胞膜。SBP是一类细菌黏附蛋白,其中一部分是致病菌的毒力因子,在细菌体内的生存过程中和致病过程中发挥重要作用,同时也是疫苗候选抗原[8]。山羊化脓隐秘杆菌重庆分离株2012CQ-ZSH基因组中注释的编码铁摄取的ABC转运体主要有:二价金属离子ABC转运体、铁ABC转运体、血红素(Heme)ABC转运体,在化脓隐秘杆菌不同菌株中高度保守,功能可能类似于其他病原菌的铁摄取相关ABC转运体,在宿主体内不同铁环境条件下会出现差异表达,以适应摄取宿主体内不同组织的铁源[9-10]。
化脓隐秘杆菌已鉴定的毒力因子有溶血素(Pyolysin,PLO)和黏附蛋白胶原结合蛋白(Collage-binding protein,Cbp)CbpA、神经氨酸酶(Neuraminidases,Nan)Nan H和Nan P等[11-15],除了PLO,至今还没有发现新的保护性抗原。这阻碍了用于化脓隐秘杆菌感染的预防、诊断和控制所需新产品、新方法和新技术的研发,也不利于开展化脓隐秘杆菌免疫应答机制的研究。为此,本研究应用免疫印迹和质谱技术鉴定膜相关的化脓隐秘杆菌候选抗原,进而开展候选抗原的抗原性、免疫原性和免疫保护效果研究,为化脓隐秘杆菌亚单位疫苗研究提供新的可选抗原。
1 材料与方法
1.1 菌株、抗血清及质粒
山羊化脓隐秘杆菌重庆分离株 2012CQ-ZSH 及其小鼠抗血清由重庆畜牧科学院兽医研究所保存和提供;大肠杆菌BL21(DE3)菌株感受态细胞购自天根生化科技(北京)有限公司;pGEX-4T-1质粒购自北京沃比森科技有限公司。
1.2 主要试剂
细菌膜蛋白分离试剂盒购自上海贝博生物科技有限公司;细菌DNA提取试剂盒、DNA凝胶回收试剂盒购自上海联硕宝为生物科技有限公司;还原性谷胱甘肽购自GE Healthcare公司;GST小鼠单克隆抗体(GST2)、碱性磷酸酶标记的山羊抗小鼠IgG(完整分子)抗体购自Sigma-Aldrich(上海)贸易有限公司,Gluthathione-Sepharose 4B购自GE Healthcare生物科学有限公司;BCTP/NBT购自生工生物工程(上海)股份有限公司;蛋白质预染Marker、pMD18-T载体购自宝日医生物技术(北京)有限公司。
1.3 实验动物
体质量约为25 g的雌性SPF昆明小鼠购自中国人民解放军第三军医大学,分为GST融合蛋白免疫组、GST免疫组和PBS对照组,每组15只。
1.4 膜蛋白分离提取
使用细菌膜蛋白分离试剂盒分离提取新鲜培养的化脓隐秘杆菌膜蛋白,具体操作按说明书要求进行。采用SDS-PAGE检测提取的膜蛋白,采用免疫印迹技术分析提取的膜蛋白与化脓隐秘杆菌免疫的小鼠血清的反应原性。
1.5 质谱与序列分析
切下与免疫血清反应的聚丙烯酰胺凝胶上对应的条带,采用 LC-MS/MS 方法对样品进行质谱分析。将获得的多肽序列在NCBI上进行BLAST搜索以获得靶标蛋白的编码基因。
1.6 基因克隆
以PCR方法从山羊化脓隐秘杆菌重庆分离株2012CQ-ZSH基因组(GenBank登录号CP012649)中扩增目的基因。上游引物序列为GGATCCTCCTCTAAGCCT,下游引物序列为CTCGAGTTACTTCAGGCCGGC,斜体部分分别为BamHⅠ和XhoⅠ限制性内切酶的识别位点。使用细菌 DNA 试剂盒提取化脓隐秘杆菌基因组DNA。PCR反应体系:10×PCR Buffer (含15 mmol/L Mg2+)2.5 μL,2.5 mmol/L dNTPs 0.5 μL,5 U/μL rTaq0.10 μL,10 μmol/L上、下游引物各0.5 μL,DNA 0.5 μL,用去离子水补足25 μL。PCR反应参数:94 ℃预变性2 min;94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸45 s,共进行30个循环;72 ℃ 延伸5 min。目的片段经DNA凝胶回收试剂盒回收后克隆到pMD18-T载体,转化入DH5α,进行转化、涂板、挑菌等步骤。经序列测定正确的重组质粒使用BamHⅠ和XhoⅠ双酶切,将酶切下的目的基因与经同样双酶切的pGEX-4T-1连接构建表达载体pGEX-SBP,转化入DH5α,筛选阳性克隆提取重组质粒,将其转化入大肠杆菌BL21(DE3)菌株用于诱导表达融合蛋白GST-SBP。
1.7 重组蛋白的诱导表达与鉴定
37 ℃振摇培养至菌体浓度达OD600≈1时,加入终浓度为0.1 mmol/L IPTG,37 ℃诱导表达 3 h。培养物 4 ℃ 5 000 r/min离心 30 min,沉淀用 PBS 洗涤 3 次。每 100 mL培养液加 20 mL PBS 以悬浮菌体沉淀,冰水浴中超声裂解菌悬液(超声功率为 300 W,工作 4 s 间歇 5 s,超声裂解 15 min)。裂解物 12 000 r/min 离心 10 min,样本经 SDS-PAGE后转印至硝酸纤维素膜上,采用 50 g/L 脱脂奶粉封闭 2 h,TBST洗 3 次后与 GST 单克隆抗体(1∶5 000)孵育,TBST 洗 3 次后与碱性磷酸酶标记的山羊抗小鼠 IgG (1∶5 000)孵育,最后置 BCTP/NBT 中显色。
1.8 重组蛋白质纯化
向裂解物中加入体积分数为1%的 Trition X-100,4 ℃振摇孵育 30 min,5 000 r/min 离心 30 min,收集上清。每 20 mL上清加入 300 μL Gluthathione-Sepharose 4B,4 ℃搅动孵育 1 h。PBS 洗涤 3 次后用 10 mmol/L 还原性谷胱甘肽洗脱,采用 SDS-PAGE 分析纯化效果。
1.9 重组蛋白与抗血清反应
将纯化的GST-SBP转印至硝酸纤维素膜上,采用 50 g/L的脱脂奶粉封闭 2 h,TBST 洗 3 次后与化脓隐秘杆菌小鼠抗血清(1∶500)孵育,TBST 洗 3 次后与碱性磷酸酶标记的山羊抗小鼠 IgG(1∶5 000)孵育,最后置 BCTP/NBT中 显色。
1.10 重组蛋白质的免疫原性及保护作用
将纯化的重组蛋白和铝胶佐剂按体积比 5∶1混合,充分摇匀,每只小鼠腿部肌肉注射0.2 mL,蛋白剂量为10 μg,间隔2周免疫1次,共免疫3 次。GST-SBP免疫15 只小鼠,GST免疫15 只小鼠。对照组小鼠15 只,每只肌肉注射PBS 0.2 mL。第3次免疫15 d后,采集眶前静脉血液,每组采集5 只,分离血清。采用已纯化的GST-SBP为包被抗原的间接ELISA方法测试特异性抗体水平,每份血清做3次平行检测,数据以“平均值±标准差”表示。采用免疫印迹分析GST-SBP免疫小鼠血清与化脓隐秘杆菌菌体蛋白的识别反应。剩下的10只小鼠用于攻毒以测试保护率。采用已进行平板计数的新鲜培养的化脓隐秘杆菌进行攻毒,每只小鼠腹腔注射细菌剂量为1×109个CFU(菌落形成单位)。
2 结果与分析
2.1 膜蛋白提取与质谱分析
利用细菌膜蛋白提取试剂盒从新鲜培养的化脓隐秘杆菌菌体中提取膜蛋白,SDS-PAGE显示所提取的蛋白质分子质量为35~140 ku(图1),免疫印迹显示所提取的膜蛋白能与化脓隐秘杆菌免疫的小鼠血清发生反应,呈现 2 条特异条带,分子质量分别约为68 ku和40 ku(图2)。将对应SDS-PAGE凝胶上的2条蛋白质条带切下进行LC-MS/MS分析,获得2条多肽序列:VLVTGHDAFNYLGR和IADTELFADTLGTEAPVDTYVGAFK,得分为229。BLAST搜索结果显示,这2条多肽序列与化脓隐秘杆菌铁ABC转运体SBP高度同源,同时该SBP在不同化脓隐秘杆菌分离株中的同源性高于99%。

M.蛋白质相对分子质量标准;1.膜蛋白
M.Protein marker;1.Membrane proteins
图1 提取的膜蛋白电泳图 Fig.1 Electrophoresis of membrane protein
2.2 基因克隆
运用PCR技术从化脓隐秘杆菌基因组中扩增到与预期大小888 bp相符的目的基因SBP(图3),序列测定结果显示所得基因序列无突变。利用BamHⅠ和XhoⅠ限制性内切酶从重组质粒pMD18-T-SBP中酶切获得SBP基因,将其克隆至质粒pGEX-4T-1,转化至BL21(DE3)。筛选阳性克隆提取质粒,采用BamHⅠ和XhoⅠ双酶切质粒,获得与目的基因大小相符的片段(图4),表明成功构建含SBP基因的重组质粒和重组菌株。
M.蛋白质相对分子质量标准;1.未免疫小鼠血清;2.免疫小鼠血清
M.Protein marker;1.Serum of unimmunized mice;2.Serum of immunized mice
图2 提取的膜蛋白与化脓隐秘杆菌
免疫小鼠血清的反应(免疫印迹)
Fig.2 Response of extracted membrane proteins to mouse serum immunized with
T.pyogenes(Western blot)
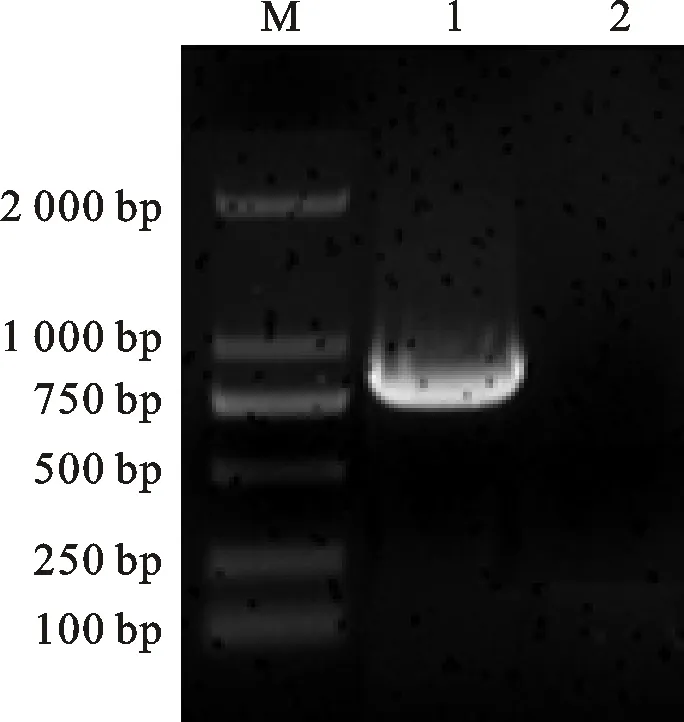
M.DNA marker DL2000;1.PCR产物;2.阴性对照
M.DNA marker DL2000;1.PCR products;2.Negative control
图3 目的基因的PCR扩增
Fig.3 PCR amplification of target gene
2.3 目的蛋白的诱导表达
免疫印迹分析显示,经IPTG诱导后,在诱导培养物裂解液上清中可见分子质量约58 ku的目的条带,大小与预期相符,表明融合蛋白GST-SBP在重组大肠杆菌BL21(DE3)以可溶性形式表达(图5)。
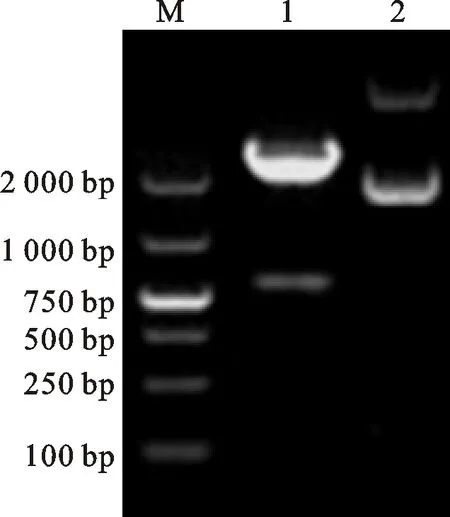
M.DNA marker DL2000;1.酶切的重组质粒pGEX-SBP; 2.未酶切的重组质粒pGEX-SBP
M.DNA marker DL2000;1.Enzyme-digested recombinant plasmid pGEX-SBP;2.Undigested recombinant plasmid pGEX-SBP
图4 重组质粒双酶切鉴定
Fig.4 Recombinant plasmid identification

M.蛋白质相对分子质量标准;1.未诱导培养物裂解液上清;2.诱导培养物裂解液上清
M.Protein marker;1.Uninduced culture lysate supernatant;2.Induced culture lysate supernatant
图5 Western blot分析重组表达的GST-SBP
Fig.5 Expression analysis of GST-SBP
2.4 重组蛋白纯化
利用Gluthathione-Sepharose 4B从重组菌BL21(DE3)诱导培养物裂解液上清中纯化到重组蛋白GST-SBP,经测试纯度高于95%,每100 mL培养物可获得10 mg纯化的SBP (图6)。

M.蛋白质相对分子质量标准;1. GST-SBP
M.Protein marker;;1. GST-SBP
图6 GST-SBP的纯化
Fig.6 Purified GST-SBP
2.5 GST-SBP与抗血清的反应
免疫印迹结果显示(图7),纯化的GST-SBP与化脓隐秘杆菌免疫的小鼠抗血清能发生抗原抗体反应,呈现一条与GST-SBP大小一致的特异条带,表明重组表达的GST-SBP具有反应原性。

M.蛋白质相对分子质量标准;1.化脓隐秘杆菌免疫的小鼠血清;2.未免疫小鼠血清
M.Protein marker;1.Serum of mice immunized withT.pyogenes;2.Serum of mice unmmunized
图7 GST-SBP与化脓隐秘杆菌
免疫小鼠血清的免疫印迹分析
Fig.7 Immunoblotting analysis of GST-SBP and antiserum
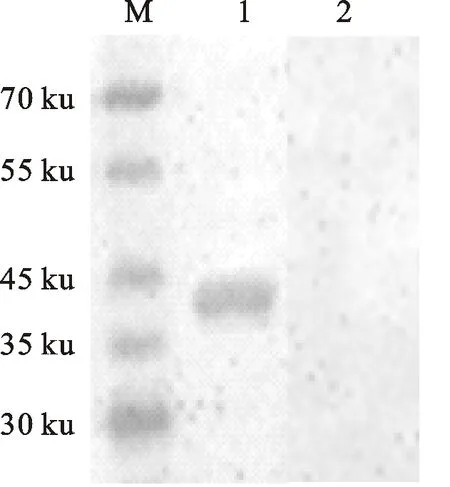
M.蛋白质相对分子质量标准;1.GST-SBP免疫的小鼠血清;2.GST免疫的小鼠血清
M.Protein marker;1.Serum of mice immunized with GST-SBP;2.Serum of mice immunized with GST
图8 GST-SBP抗血清与化脓隐秘杆菌
菌体蛋白的免疫印迹分析
Fig.8 Immunoblotting analysis of GST-SBP antiserum andT.pyogenesproteins
2.6 GST-SBP的免疫保护作用
经测试分析,GST-SBP免疫的小鼠产生高水平的抗体(表1),抗体能识别化脓隐秘杆菌菌体蛋白,产生1条特异性条带,条带大小与化脓隐秘杆菌小鼠抗血清同化脓隐秘杆菌反应出现的条带大小一致(图8)。结果表明SBP具有免疫原性。在1×109化脓隐秘杆菌腹腔攻毒后,PBS对照组 10只小鼠全部死亡,GST免疫组死亡9只,GST-SBP免疫小鼠死亡1 只,存活9 只,保护率为90%,表明SBP有免疫保护作用。
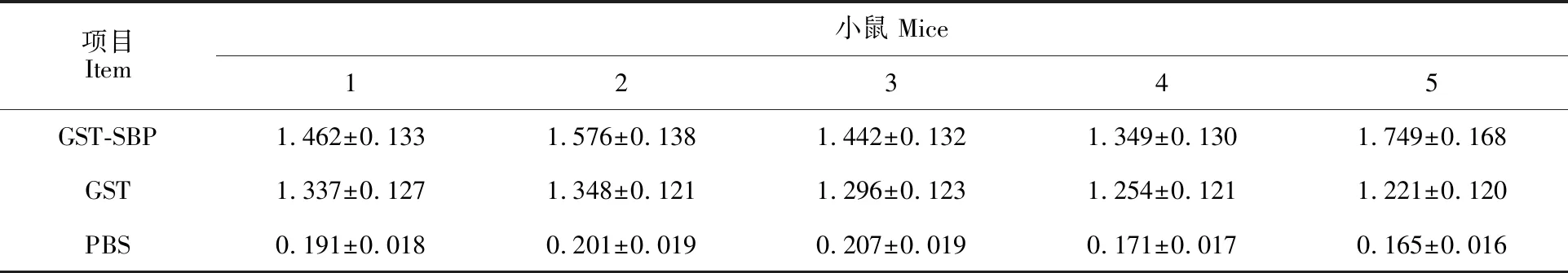
表1 免疫小鼠抗体水平Table 1 Antibody level in immunized mice
3 讨 论
膜蛋白是病原菌膜结构的主要组分,不仅在病原菌的生命活动中具有重要的生理功能,且部分膜蛋白还与病原菌的感染及刺激机体产生免疫应答密切相关[16-17]。为了鉴定化脓隐秘杆菌的新候选抗原,本研究提取化脓隐秘杆菌膜蛋白,运用免疫印迹和质谱技术鉴定出2条与化脓隐秘杆菌铁ABC转运体的SBP匹配的多肽序列。免疫印迹结果显示,该SBP的重组蛋白GST-SBP能与化脓隐秘杆菌抗血清发生特异反应,GST-SBP抗血清能与化脓隐秘杆菌菌体蛋白发生特异性反应,表明SBP具有抗原性和免疫原性,同时佐证质谱数据的可靠性。
近年来,细菌ABC转运体作为疫苗候选抗原受到关注[18-19]。肺炎链球菌表面蛋白PsaA(锰和锌离子ABC转运体SBP)是肺炎链球菌(Streptococcus pneumoniae)定植咽部的黏附蛋白,以壳聚糖为输送系统,PsaA能诱导机体产生黏膜免疫应答及系统免疫应答,增加对肺炎球菌急性中耳炎和侵袭性感染的保护[20]。Semchenko等[21]证实淋病奈瑟菌的MetQ(甲硫氨酸ABC转运体的结合蛋白)能黏附宫颈上皮细胞,MetQ突变株在人单核细胞、巨噬细胞和血清中存活率下降,并能够阻止菌体黏附上皮细胞。卡他莫拉菌(Moraxellacatarrhalis,是儿童中耳炎和成人下呼吸道慢性阻塞性肺病的致病菌)的AfeA(ABC转运体SBP)诱导了小鼠肺部抗卡他莫拉菌的保护性免疫[22]。伍小松等[23]用猪多杀性巴氏杆菌重组抗菌肽ABC转运体ATP 酶免疫小鼠,相比于对照组,提高了免疫组小鼠攻毒后的存活率。细菌ABC转运体透酶也是重要的候选抗原[24]。本研究结果显示,免疫铁ABC转运体重组SBP的小鼠能抵御致死剂量的化脓隐秘杆菌攻击,免疫小鼠存活率为90%,表明该SBP是免疫原性良好的保护性抗原,可用于化脓隐秘杆菌亚单位疫苗的研发。
——一道江苏高考题的奥秘解读和拓展

