新辅助化疗后MRI上乳腺癌不同退缩模式对疗效评估的价值
许梅,马捷,戈春燕,林小慧
乳腺新辅助化疗(neoadjuvant chemotherapy,NAC)是治疗局部晚期乳腺癌的重要手段,其目的在于缩小肿瘤使其分期降低以利于手术,对于有保乳意愿但不适合行保乳手术(breast-conserving therapy,BCT)的患者而言可获得更大的保乳机会,从而改善术后生活质量[1]。NAC后BCT 是否会增加同侧乳腺肿瘤复发(ipsilateral breast tumor recurrence,IBTR)率及局部复发(local-regional recurrence,LRR)率是普遍关注的问题。乳腺NAC后部分肿瘤呈碎片样退缩,但可能仍有病灶残留在退缩的组织中,给手术切除范围的判定带来困难[2],故为了成功施行BCT,必须考虑原发肿瘤的范围和肿瘤的退缩模式,并需谨慎检测切缘状况。目前,乳腺MRI对评估新辅助化疗后残留病灶的准确性较高,优于超声、乳腺X线摄影及临床触诊[3-5]。文献对退缩模式的描述不一,主要归为两种:向心性退缩及非向心性退缩。目前笔者尚未发现有国内文献将退缩模式分为三型的报道。笔者基于所搜集数据及相关文献[6-8],对比NAC前后病变的范围和影像学特点,将退缩模式分为向心性、碎片样及混合型三类,旨在探讨NAC后原发肿瘤的退缩模式及不同退缩模式对NAC后疗效的评估价值。
材料与方法
1.研究对象
回顾性分析本院2016年8月-2019年5月符合纳入和排除标准的50例乳腺癌患者的临床和影像资料,均为女性患者,年龄 24~62岁,平均(43.8±9.4)岁。纳入标准:①经术前穿刺活检及NAC后手术病理证实的单侧乳腺癌;②NAC前及NAC第8周期结束后手术前一周内行MRI检查。排除标准:①NAC后没有进行手术治疗及化疗后病灶进展;②因扫描技术等原因图像质量不佳,不能满足诊断要求;③影像资料或病理资料不全。
2.NAC方案
采用TEC方案15例, TAC方案6例,EC-TH方案20例,TCH方案6例,CEF方案2例,GP方案1例。TEC方案:泰索帝(75 mg/m2)+表阿霉素(70 mg/m2)+环磷酰胺(600 mg/m2),每周期一次,21天/周期。TAC 方案:多西他赛(75 mg/m2)+表柔比星(75 mg/m2)+环磷酰胺(500 mg/m2),每周期一次,21天/周期。EC-TH方案:表柔比星(90 mg/m2)+环磷酰胺(600 mg/m2)+多西他赛(90 mg/m2),每周期一次,21天/周期。TCH方案:多西他赛(75 mg/m2)+卡铂(550 mg/m2),每周期一次,21天/周期,共6周期;曲妥珠单抗于第1周按照4 mg/kg的剂量使用1次,其后2 mg/kg的剂量每周注射1次共使用17周,随后6 mg/kg每3周1次。CEF方案:环磷酰胺(600 mg/m2)+表阿霉素(80 mg/m2)+5-氟尿嘧啶(600 mg/m2),每周期一次,21天/周期;GP方案:吉西他滨(1.6 g)+顺铂(40 mg/m2),每周期一次,21天/周期。
3.MRI检查方法
患者均行乳腺MRI平扫及增强扫描。使用Siemens Skyra 3.0T超导磁共振仪和4通道乳腺线圈。患者取俯卧位,双侧乳腺自然下垂,平静自由呼吸。扫描序列包括常规MR平扫(横轴面T1WI、T2WI、脂肪抑制T2WI)、DWI和动态增强MRI。DWI扫描参数:单次激发SE-EPI序列,TR 5700 ms,TE 59 ms,层厚4 mm,间距0.8 mm,层数32,采集矩阵192×96,视野340 mm×340 mm,b 值分别取50、400和800 s/mm2,扫描时间3 min 54 s。动态增强MRI采用3D扰相梯度回波FLASH序列,扫描参数:TR 4.7 ms,TE 1.7 ms,层厚1.6 mm,间距0 mm,层数72,采集矩阵448×372,视野360 mm×360 mm,翻转角10°,共扫描6期,每期扫描时间约1 min。注射对比剂前先扫描蒙片,然后暂停30 s,并立即采用高压注射器团注造对比剂Gd-DTPA,剂量0.2 mmol/kg,注射流率3.0 mL/s。随后连续扫描5期,每期扫描时间为61 s,总扫描时间为6 min 33 s。NAC前及 8个周期NAC后于手术前一周内进行2次MRI扫描,使用的MR检查设备及扫描参数相同。
4.图像分析
由2位分别从事乳腺影像诊断工作5年及30年的放射科医师独立阅片,记录各自的诊断结果,用于评价测量者间的一致性。随后,对未达成一致意见的诊断结果,经讨论后达成一致意见,用于后续的评估。将NAC后肿块的退缩模式分为3类:①向心性退缩,即肿瘤呈环形自外周逐渐向中心缩小,呈同心圆样改变,形成与原来的肿块形状相似但体积减小的瘤灶(图1);②碎片样退缩,即肿瘤整体体积基本不变或略缩小,但肿瘤组织散在分布于原瘤床内,周围被纤维组织分隔,增强扫描时呈多发结节样或区域性强化表现(图2);③混合型,即同时包含向心性及碎片样退缩,肿瘤既向中心缩小,又呈结节样或碎片样强化表现(图3)。
5.肿瘤化疗反应的评估标准及免疫组化分析
新辅助化疗病理疗效评价采用Miller & Payne(MP)病理反应分级标准[9]:1级为肿瘤细胞数量无明显变化;2级为肿瘤细胞减少的比例≤30%;3级为肿瘤细胞减少的比例为31%~90%;4级为肿瘤细胞减少的比例>90%,仅残余少量肿瘤细胞呈散在分布;5级为所有切片均无浸润性癌灶残存,可见残存的导管内癌成分。其中1~4级为非病理性完全缓解,5级为病理性完全缓解(pathological complete response,pCR)。
NAC前使用空心针对乳腺肿瘤病灶进行穿刺活检,检测雌激素受体 (estrogen receptor,ER)、孕激素受体 (progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)及Ki-67的表达状况。显微镜下(×400)观察癌细胞核染色呈棕黄色颗粒样即为 ER或PR阳性细胞 ,本研究设定ER或PR阳性细胞数≥10%为阳性结果。HER2通过免疫组织化学(immunohistoche-mistry,IHC)染色来判定浸润性癌细胞的细胞膜着色情况,结果分为(-)、(+)、()和 (),再用荧光原位杂交(fluorescence in situ hybridization,FISH)法检测HER2, IHC()或FISH阳性即判断为HER2阳性。 Ki-67阳性细胞数≥20%为高表达,阳性细胞数<20%为低表达[10]。 根据2013 年 St. Gallen国际乳腺癌会议[10],将乳腺癌分为4种分子分型,即Luminal A 型、Luminal B型、HER2 过表达型和三阴型。
6.统计分析
使用SPSS 21.0软件进行统计分析。采用Kappa检验评价2位医师对退缩模式分型评价的一致性,Kappa<0.40为一致性低,0.40~0.75一致性中等,>0.75为一致性好。采用χ2检验、Fisher精确检验与Wilcoxon秩和检验比较pCR组及非pCR组各项临床指标的差异,采用Fisher精确检验比较4种分子分型间肿瘤退缩模式和NAC前在MRI上的形态学差异,以及3种退缩模式之间肿瘤在NAC前的增强方式的差异。以相关临床特征及退缩模式作为影响因素,采用Binary logistic回归分析法分析其对疗效的影响,计算优势比和95%置信区间。以P<0.05为差异有统计学意义。
结 果
1.临床特征
经穿刺活检证实,50例中29例为非特殊类型浸润性癌,18例为非特殊类型浸润性癌伴导管原位癌(ductal carcinoma in situ,DCIS),3例为浸润性小叶癌。术前临床分期:ⅡA期15例,ⅡB期16例,ⅢA期10例,ⅢB期2例,ⅢC期 4例,Ⅳ期3例。NAC后经手术病理证实,pCR 16例(32%),非pCR34例(68%)。NAC后手术方式分别为行保乳手术20例,乳腺改良根治术15例,全乳房切除术15例。
2.pCR与非pCR组各项指标的比较
pCR和非pCR组间临床特征、肿瘤标记物及增强CT表现的比较结果见表1。两组间年龄、绝经状态、治疗前病灶最大径、淋巴结转移情况、T分期、分子分型和肿瘤标记物(ER、PR、Ki-67状态)、NAC前MRI上肿瘤强化方式及背景实质强化(background parenchymal enhancement,BPE)情况的差异均无统计学意义(P>0.05)。两组间仅HER2表达情况和肿瘤退缩模式的差异具有统计学意义(P<0.05)。
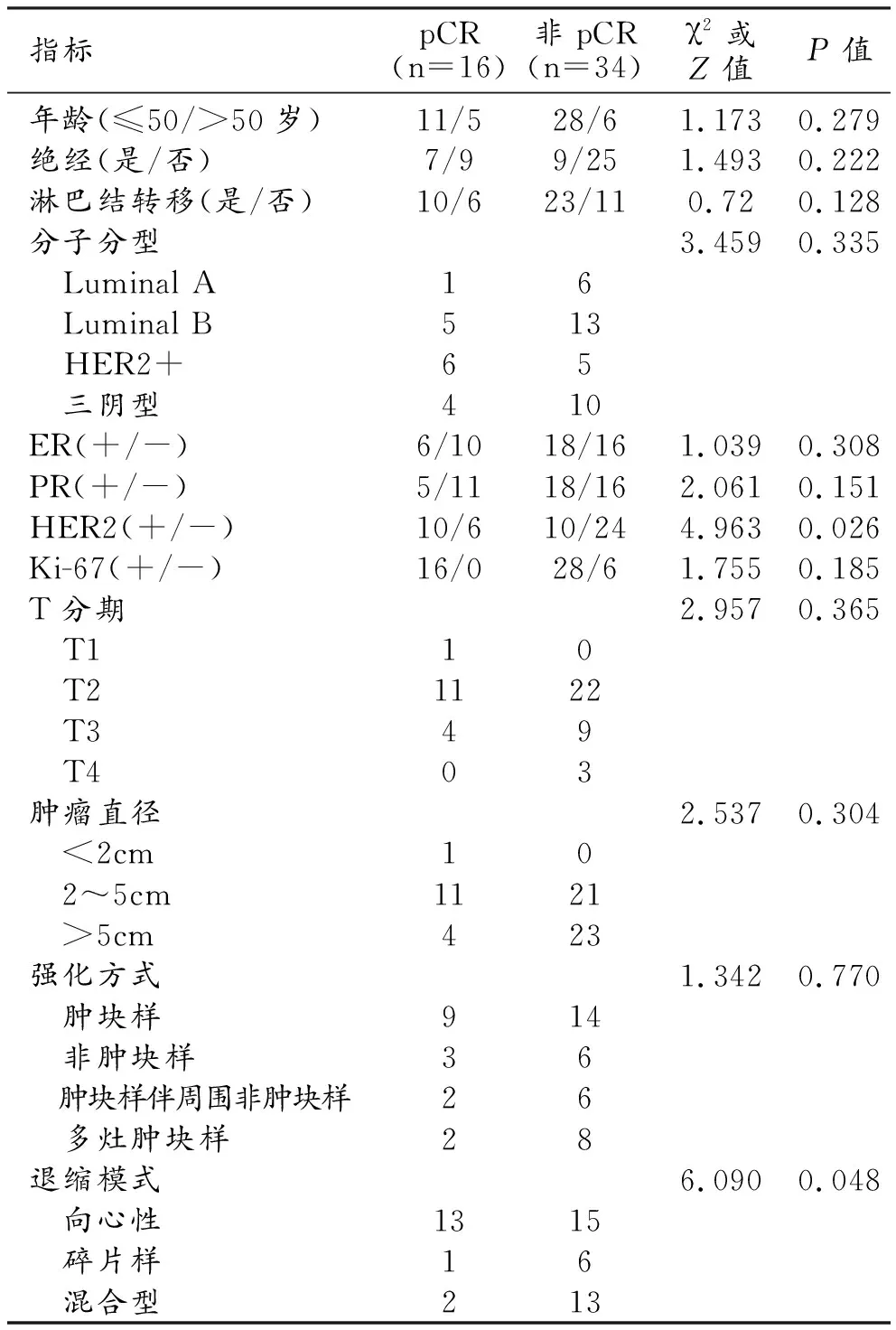
表1 乳腺癌NAC后pCR组和非pCR组的临床及病理特点
Logistic多因素回归分析模型显示,HER2状态(优势比为6.637,95%置信区间为1.360~32.384,P=0.019)和退缩模式(优势比为4.425,95%置信区间为1.528~15.28,P=0.006)是预测疗效能否达到pCR的独立影响因素。病灶HER2阳性更容易达到pCR,pCR中更大概率为向心性退缩,碎片样退缩及混合型退缩难以达到pCR。
3.不同分子分型间影像表现及退缩模式的比较
本研究中Luminal A型7例,Luminal B型18例,HER2型11例,三阴型14例。各型乳腺癌的在NAC前MRI上的强化方式及在NAC后的退缩模式见表2。Luminal型乳腺癌主要表现为肿块样强化,占48.0%(12/25);三阴型乳腺癌主要表现为肿块样强化,约占50.0%(7/14)。但4种分子分型乳腺癌在NAC前MRI上的强化方式比较,差异无统计学意义(χ2=4.272,P=0.936)。Luminal型乳腺癌以向心性退缩为主,约占48.0%(12/25),其次是混合型,占32.0%(8/25);绝大部分三阴型乳腺癌表现为向心性退缩,占85.7%(12/14);HER-2型呈混合型退缩模式为主,占45.5%(5/11)。但是4种分子分型乳腺癌之间肿瘤退缩模式的差异无统计学意义(χ2=8.779,P=0.153)。

表2 不同分子分型乳腺癌的强化方式及退缩模式 (例)
4.不同退缩模式的肿瘤强化方式的比较
不同退缩模式组在NAC前MRI上的肿瘤强化方式详见表3。术前呈肿块样强化者(18/23)多表现为向心性退缩(图1),其它两种模式相对少见(图2);非肿块样强化(4/9)以碎片样及混合型退缩模式为主,肿块样伴周围非肿块样强化和多灶肿块样强化者均以向心性及混合型退缩模式为主(图3),不同退缩模式的乳腺癌在MRI上的强化方式间的差异具有统计学意义(χ2=15.825,P=0.005)。

表3 不同退缩模式间强化方式的比较 (例)
5.两位医师对退缩模式分析的一致性
对两位医师对化疗后肿瘤退缩模式的分型结果进行一致性分析,Kappa值为0.719,一致性为中等。
讨 论
1.NAC后不同分子分型影像表现及退缩模式的关系
本组资料中Luminal A型和B型乳腺癌主要表现为肿块样强化,NAC后以向心性退缩为主,其次是混合型退缩模式。Navarro Vilar等[11]报道,Luminal型乳腺癌为低度-中度恶性,多表现为肿块样强化,形态不规则,边缘呈毛刺状,内部强化不均匀,发生钙化及微钙化的比例低。Li等[6]报道,Luminal型乳腺癌患者多见巢状或树突状退缩,即碎片样退缩模式。李蔓蔓等[12]提出Luminal A型乳腺癌多呈向心型退缩,Luminal B型多呈巢状或树枝状退缩。Ballesio等[7]报道Luminal A型乳腺癌在NAC后多表现为混合型退缩模式。
本组资料中三阴型乳腺癌在MRI上主要表现为肿块样强化,约占50.0%,NAC后绝大部分为向心性退缩。文献报道三阴型乳腺癌多表现为单发较大肿块,呈圆形、卵圆形或浅分叶状,边缘清楚,肿块内少有钙化灶,NAC后往往呈向心型退缩[10-11,13]。
本组资料中HER-2阳性型在动态增强MRI上的表现多样,因此在退缩模式上也更加多样。在HER-2阳性组,多表现为肿块强化,而退缩模式以混合型为主。文献报道HER-2阳性型以巢状或树突状退缩为主[10],在MRI上多表现为非肿块样强化,呈导管样、节段或区域性分布,钙化及微钙化灶较多见[10-11,13]。本研究与上述文献报道不一致。笔者认为可能原因是本组资料中HER2阳性型乳腺癌样本量较少所致。
2.肿瘤退缩模式与MRI上强化方式的关系
本研究中50个病灶中有46%(23/50)呈肿块样强化;18%(9/50)呈非肿块样强化;16%(8/50)呈肿块样伴周边非肿块样强化,多见于浸润性癌中含广泛导管内癌成分、或病灶周围含导管原位癌的患者;还有20%(10/50)表现为多灶肿块样强化,即表现为一个较大的肿块伴周边相对较小的病灶,病灶之间相互分隔,或有线样强化的淋巴管浸润相连,多个病灶可为同一性质,也可为不同性质。
有研究者认为在对比增强MRI上肿瘤的强化方式是治疗后其退缩模式的重要预测因素,NAC前呈肿块样强化的病灶在治疗后多表现为向心性退缩模式,而NAC前呈多灶肿块样强化或非肿块样强化的病灶更倾向于表现为碎片样退缩模式[14]。但笔者尚未见国内将肿瘤退缩模式分为3型的报道。本研究中将肿瘤退缩模式分为向心性、碎片样及混合型三型。呈肿块样强化者多为向心性退缩,占78.3%(18/23);非肿块强化者以碎片样及混合型退缩模式为主,均占44.4%(4/9);肿块样伴非肿块样强化以向心性及混合型退缩为主,均占50%(4/8),未见碎片样退缩;多灶肿块样强化者以向心性及混合型退缩模式为主。上述表现与文献报道基本一致。原因可能是非肿块样强化的病灶,肿瘤组织通常与正常腺体组织或脂肪组织相间存在;同时,因肿瘤内部高度异质性,不同区域对细胞毒性药物的敏感性存在差异,这就使得非肿块强化的病灶在NAC后更容易表现为碎片样或混合型退缩;而多灶肿块样强化的病灶,当多个病灶性质相同时,对化疗反应相似,在NAC后更容易表现为多个病灶同时向心性退缩,而当多个病灶性质不一致时,各个病灶对细胞毒性药物的敏感性存在差异,则病灶在NAC后更容易表现为混合型退缩。
3.肿瘤退缩模式与疗效关系
NAC后获得pCR的患者具有更好的预后[15-16],此类患者行 BCT后LRR率较低[16]。Ballesio等[7]研究认为NAC后肿瘤向心性退缩方式与pCR存在显著相关性(P<0.001),混合型退缩方式与治疗后表现为病理无反应之间亦存在显著相关性(P=0.005)。低级别Luminal乳腺癌患者NAC中,MRI上显示向心性退缩模式是预后的独立相关因素[8]。新辅助化疗后对肿瘤退缩模式的准确影像评估是乳腺癌化疗后保乳手术选择及降低复发率的关键。呈向心型退缩的肿块较易判断其边界,局部切除后切缘常为阴性,因此易行保乳手术;碎片样退缩的肿瘤则会在化疗后分裂成多个小的肿块,不易清楚地判断其边界,局部切除后切缘常有肿瘤残留,而残存肿瘤的多灶模式,可能增加保留乳房手术局部复发率。当肿瘤为树枝样退缩模式(碎片样)时,MRI容易低估残余肿瘤的大小,MRI评估残余肿瘤大小时必须谨慎,需要考虑肿瘤退缩模式的差异[17]。Curigliano等[18]报道的2017年St.Gallen共识指出,对于经NAC肿瘤降期后拟行手术的患者,若肿瘤呈向心性退缩,手术要求为单一残留病灶的切缘无肿瘤即可,而对于多病灶残留或碎片样退缩的患者则要求距离阴性切缘2mm。有研究者认为,对于向心性退缩患者,则以残余肿瘤的大小设计切除范围;对于碎片状退缩患者则按原病灶设计切除范围,术后应行乳腺X线摄影检查以尽量保证恶性钙化被完整切除,术后辅以有效的辅助化疗、内分泌治疗及足够剂量的局部放疗,以减少复发[19]。了解NAC后肿瘤的退缩模式、准确界定NAC后的肿瘤范围,既可以保证无癌细胞残留,又可以减小切除范围,降低局部复发率。
笔者侧重探讨NAC治疗后原发肿瘤退缩模式能否与其它临床特征作为病理疗效评估的独立因素,结果显示HER2状态及以及治疗后肿瘤退缩模式是影响病理组织学疗效评价是否达到pCR的独立预测因素,病灶HER2阳性者更越容易达到pCR,与其它研究结果一致[20-21]。碎片样退缩及混合型退缩难以达到pCR,达pCR患者中呈向心性退缩的概率更大。本研究显示,肿瘤退缩模式与HER2状态与pCR相关。
综上所述,不同分子分型乳腺癌表现为不同退缩模式,MRI上肿瘤增强方式与退缩模式显著相关,NAC后退缩模式可作为NAC疗效评估的独立预测因素。HER2受体阳性者更越容易达到pCR,NAC后碎片样退缩及混合型退缩模式难以达到pCR,达pCR患者中更大概率为向心性退缩模式。

