MiR-22重组腺病毒的构建及对HepG2细胞葡萄糖摄取的影响
廖立红,袁文彬,陈勇,梁继超
·生物技术与方法·
MiR-22重组腺病毒的构建及对HepG2细胞葡萄糖摄取的影响
廖立红1,袁文彬2,陈勇2,梁继超2
1 武汉大学中南医院 儿科,湖北 武汉 430071 2 湖北大学 中药生物技术湖北省重点实验室药物高通量筛选技术国家地方联合工程研究中心,湖北 武汉 430062
文中构建了miR-22重组腺病毒Ad-miR-22,分析了其对HepG2细胞胰岛素信号通路及葡萄糖摄取的抑制作用。通过PCR方法,扩增了miR-22的前体及侧翼序列,酶切后克隆至腺病毒穿梭载体pAdTrack-CMV中,构建穿梭质粒pAdT-22,经PCR及测序鉴定。穿梭质粒经Ⅰ线性化后,直接转化含有腺病毒骨架载体的感受态细胞BJ5183,产生重组腺病毒质粒Ad-miR-22,最后经Ⅰ线性化后转染包装细胞系293A。重组腺病毒经过3轮扩增后感染HepG2细胞,通过荧光定量PCR检测miR-22表达水平。通过葡萄糖摄取实验观察Ad-miR-22对HepG2细胞葡萄糖摄取的影响。采用Western blotting检测Ad-miR-22对HepG2细胞SIRT1在蛋白质水平的表达及GSK-3β磷酸化水平的影响。采用荧光定量PCR检测miR-22对PEPCK及G6Pase等基因在mRNA水平表达的影响。结果表明,重组腺病毒Ad-miR-22感染显著增加HepG2细胞miR-22表达水平。此外,Ad-miR-22显著抑制胰岛素诱导的HepG2葡萄糖摄取,并通过下调GSK-3β磷酸化抑制胰岛素信号通路的激活。Ad-miR-22反转胰岛素对糖异生关键酶表达的抑制作用,并下调SIRT1基因在蛋白质水平的表达。综上所述,构建了miR-22的重组腺病毒,发现其显著增加糖异生,抑制HepG2细胞葡萄糖摄取,该作用可能与miR-22调节SIRT1在蛋白质水平的表达有关。
miR-22,重组腺病毒,葡萄糖摄取,糖异生,基因治疗,SIRT1
随着我国生活水平的提高、生活习惯的改变,糖尿病患者有不断增加的趋势。其中,2型糖尿病患者占比超过了90%。2型糖尿病的发病机制非常复杂,至今尚未完全研究清楚。过度激活的肝糖异生是2型糖尿病的重要发病机制之一[1]。
SIRT1作为一个重要的去乙酰化酶,在胰岛素抵抗和2型糖尿病发生发展过程中扮演了重要角色。研究表明,SIRT1可以直接去乙酰化PGC-1α[2],激活其转录共激活子的活性,促进其下游靶基因的表达,而PGC-1α可以在体外及体内强烈激活糖异生关键酶PEPCK及G6Pase等的表达[3]。SIRT1的激活剂白藜芦醇可以通过激活SIRT1的去乙酰化酶活性,调节FOXO1的核转位,从而增加肝糖异生及葡萄糖输出[4]。然而,有研究表明,白藜芦醇可以增加肝胰岛素敏感性,降低肝糖异生并促进葡萄糖动态平衡[5]。此外,研究发现SIRT1可以去乙酰化CRTC2,促进其泛素介导的蛋白质降解,从而抑制肝糖异生基因的表达[6]。可见,SIRT1对肝糖异生及2型糖尿病的调节有双重作用。
microRNA是一类18–25个核苷酸的微小非蛋白质编码RNA,研究表明,其在多种疾病包括2型糖尿病的发生发展过程中发挥了重要调节作用[7-14]。miR-22通过抑制PPARα表达促进心衰及心肌肥大,表明其在心肌能量代谢调控方面有重要调节作用[15]。miR-22直接靶向AKT通路抑制因子PTEN,进而影响FOXO1核定位,可能对FOXO1下游靶基因表达有影响。有趣的是,AKT的失活会降低miR-22启动子的活性,这样miR-22与PTEN和AKT之间可能形成一种反馈调节机制[16]。在正常饮食条件下,miR-22基因敲除小鼠表现出正常的葡萄糖耐受与胰岛素耐受,但是,在高脂饮食条件下,miR-22基因敲除小鼠体重和血脂水平均低于正常小鼠[17]。以上研究显示,miR-22可能在葡萄糖代谢方面,特别是肝葡萄糖稳态平衡调节方面发挥了重要作用。本研究构建了miR-22过表达重组腺病毒,发现miR-22能抑制SIRT1激活,并抑制HepG2细胞葡萄糖 摄取。
1 材料与方法
1.1 材料及试剂
限制性内切酶Ⅰ及Ⅰ购于NEB公司。λ DNA/dⅢ及DL2000分子量标准购于TaKaRa公司。Lipofectamine 2000转染试剂及TRizol试剂购于Invitrogen公司。凝胶回收试剂盒购于AXYGEN公司。荧光定量PCR试剂盒购于TOYOBO公司。DMEM细胞培养基、胎牛血清购于GIBCO公司。RIPA裂解液、BCA试剂盒、ECL化学发光试剂盒购于碧云天公司。蛋白酶及磷酸酶抑制剂购于Roche公司。抗人SIRT1单克隆抗体购于Cell Signaling Technology公司。抗人β-actin、p-GSK3β及T-GSK3β多克隆抗体购于万类生物公司。miRNA提取试剂盒购于Ambion。质粒大量提取试剂盒购于天根生化科技(北京)有限公司。
引物设计:扩增miR-22前体及侧翼序列、 荧光定量PCR的引物见表1 (小写字母为酶切 位点)。

表1 本研究所用引物
1.2 质粒、菌株及细胞
穿梭载体pAdTrack-CMV来源于Invitrogen公司,由本实验室保存。大肠杆菌感受态细胞DH5α由本实验室制备并保存,BJ5183感受态由本实验室制备并保存。293A及HepG2细胞来源于武汉大学细胞中心,由本实验室保存。
1.3 穿梭质粒及重组腺病毒质粒的构建
经PCR扩增的miR-22片段首先连接至pGEM-T easy载体,测序正确后,再用Ⅰ和Ⅰ双酶切后亚克隆至pAdTrack-CMV载体上,构建重组穿梭质粒pAdT-22。重组质粒pAdT-22用Ⅰ酶切线性化,回收纯化后电转化含有pAdEasy-1质粒的BJ5183感受态细胞,卡那霉素筛选平板培养18 h左右,挑取6–8个较小的单克隆,小量提取质粒DNA,用Ⅰ酶切筛选阳性克隆,得到重组腺病毒质粒pAd-miR-22。
1.4 重组腺病毒的包装和扩增
大量提取质粒pAd-miR-22,并纯化,取约4 μg质粒用Ⅰ进行酶切线性化,经乙醇沉淀回收后,用Lipofectamine 2000转染293A细胞,继续培养,直至出现扩增斑。继续培养细胞至约50%的细胞变圆并飘起,离心收集细胞,经4次反复冻融裂解细胞,离心收集上清即得第1代重组腺病毒。按照Invitrogen公司说明书,对重组腺病毒进行扩增,第3代扩增的腺病毒可用于细胞实验,病毒滴度为5×109PFU/mL。
1.5 荧光定量PCR
按照试剂盒说明书提取miRNA,经反转录后采用Taqman探针法分析miR-22表达水平。细胞总RNA经TRIzol提取后反转录合成cDNA,采用SYBR法定量分析基因表达水平,结果采用2-ΔΔCt表示。实验重复3次,取平均值。
1.6 葡萄糖摄取检测
HepG2细胞接种于6孔板,感染腺病毒24 h后更换无血清DMEM培养基饥饿3 h,用50 μmol/L 2-NBDG (美国Invitrogen公司) 及100 nmol/L胰岛素处理细胞30 min,收集细胞,于485 nm/535 nm激发/发射波长测定荧光值。为了校正细胞接种量的差异对结果的影响,葡萄糖摄取结果用总蛋白质进行归一化处理,即数据用荧光强度除以蛋白质浓度来表示。实验重复3次,取平均值。
1.7 细胞糖原含量检测
HepG2细胞接种于6孔板,感染相应腺病毒24 h,血清饥饿12 h后100 nmol/L胰岛素处理24 h,取105个细胞按照糖原含量检测试剂盒(北京Solarbio公司)说明书进行糖原含量测定。即离心收集细胞,用试剂盒提供的提取液重悬后超声(200 W,每次3 s) 30次,之后煮沸20 min,按说明书加入相关试剂和浓硫酸,沸水浴10 min,冷却后620 nm波长测定吸光值。实验重复3次,取平均值。
1.8 Western blotting
接种HepG2细胞于6孔板,24 h后感染Ad-GFP或Ad-miR-22。24 h后收集细胞RIPA裂解,或者无血清DMEM处理3 h后用100 nmol/L胰岛素处理细胞15 min,之后RIPA裂解细胞。用于裂解细胞的RIPA含有蛋白酶及磷酸酶抑制剂。经BCA法测定蛋白质浓度。加入上样缓冲液并煮沸10 min后上样50 μg总蛋白质进行电泳。电泳结束后将蛋白转印到PVDF膜上,3% BSA封闭后用相应一抗4 ℃孵育过夜。TBST漂洗 4次,HRP标记二抗室温孵育1 h,TBST漂洗 6次,加入ECL化学发光液之后成像分析。实验重复3次。
2 结果与分析
2.1 构建重组穿梭质粒pAdT-22
设计引物,PCR扩增miR-21片段,经琼脂糖凝胶电泳检测扩增结果,如图1所示,扩增产物长度与预计相同。扩增产物经切胶回收后连接到pGEM-T easy载体上,再用Ⅰ和Ⅰ进行酶切,同时pAd-Track-CMV载体用相同的酶进行双酶切,5 h后凝胶电泳并切胶回收DNA片段。将载体与miR-22片段按照1∶7混合,用T4 DNA连接酶进行连接过夜,转化DH5α感受态细胞并涂卡那霉素抗性平板过夜,挑取2–3个单克隆,小量制备质粒,经Ⅰ和Ⅰ双酶切后凝胶电泳鉴定。如图2所示,双酶切2 h后电泳,泳道1和2均出现一条约480 bp的DNA片段,说明可能是重组质粒,泳道3可能是载体自连的产物。将泳道1和2相应阳性克隆进行测序,结果表明PCR扩增产物插入pAd-Track-CMV载体,插入序列无突变,插入方向正确。以上结果证明重组穿梭质粒pAdT-22构建成功,可以用于下一步实验。
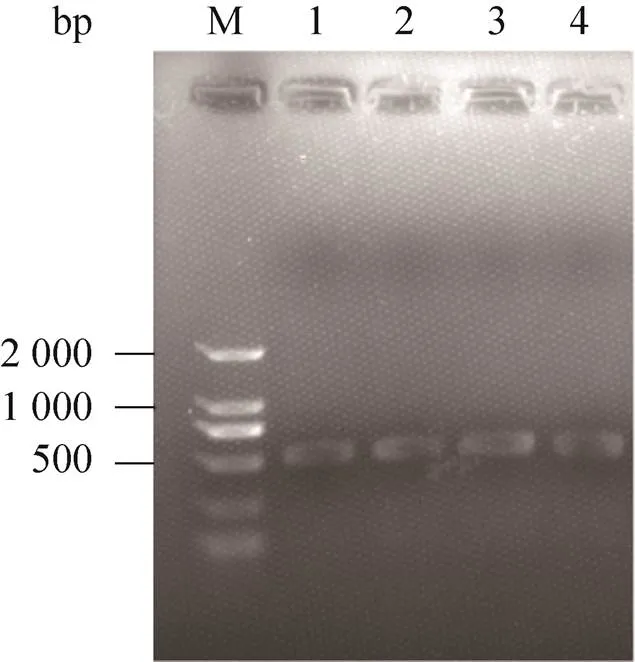
图1 miR-22基因片段的PCR扩增
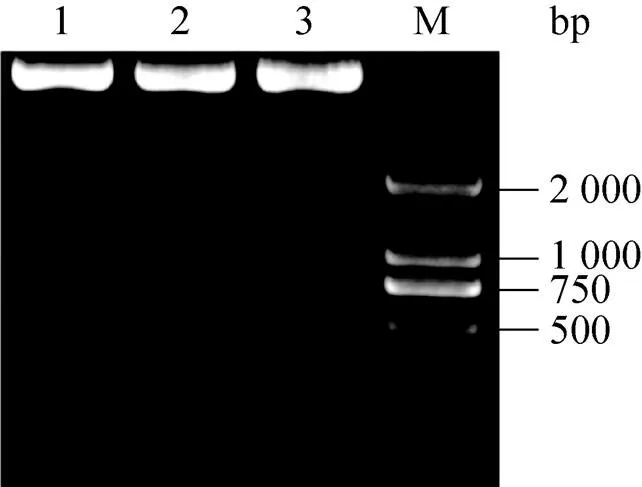
图2 重组穿梭质粒pAdT-22的双酶切鉴定
2.2 构建重组腺病毒过表达载体
大量制备重组穿梭质粒pAdT-22并进行纯化,取3 μg重组质粒用Ⅰ酶切,凝胶电泳分离后进行DNA片段回收。线性化的重组穿梭质粒与含有pAdEasy-1骨架质粒的BJ5183感受态细胞混合,在2 500 V、200 Ohms、25 μF的条件下进行电穿孔转化。涂卡那霉素抗性平板培养过夜,挑取6–10个较小的单克隆,小量制备质粒后用Ⅰ进行酶切并凝胶电泳鉴定。如图3所示,酶切产生3.5 kb或4 kb左右的条带即为阳性克隆,证明重组腺病毒过表达载体构建成功,命名为pAd-miR-22。将pAd-miR-22转化大肠杆菌DH5α感受态细胞,大量提取质粒并纯化。
2.3 重组腺病毒颗粒的产生及大量扩增
取4 μg纯化的pAd-miR-22质粒,用Ⅰ进行酶切线性化,乙醇沉淀回收DNA后用Lipofectamine 2000转染对数生长期的293A细胞,48–72 h左右可以观察到绿色荧光蛋白(GFP)的表达。5–7 d后观察到所有细胞均有GFP的表达,并逐渐出现扩增斑。如图4所示,大约2周左右,50%的细胞变圆并漂起,收集细胞,液氮/ 37 ℃水浴反复冻融4次,离心收集上清,即重组miR-22过表达腺病毒。取少量含有重组腺病毒的细胞培养基上清,感染对数生长期的新鲜293A细胞,对腺病毒进行扩增。
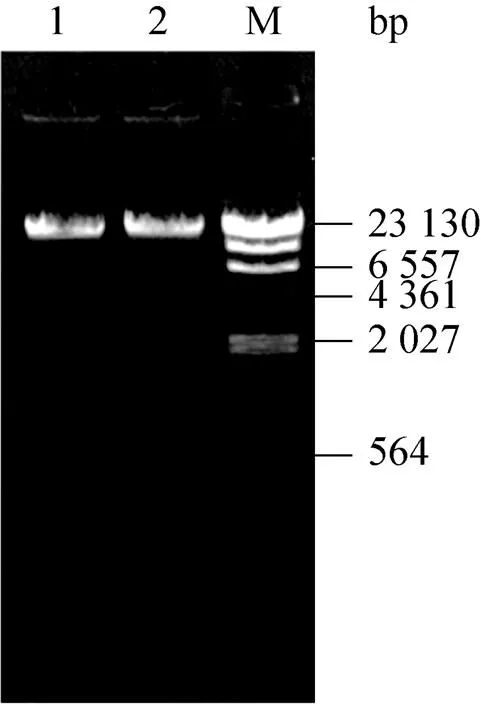
图3 重组腺病毒载体的PacⅠ酶切鉴定

图4 重组腺病毒在293A细胞中的包装及绿色荧光蛋白的表达
2.4 miR-22在HepG2细胞中的表达分析
培养HepG2细胞,分别感染Ad-GFP和Ad-miR-22腺病毒,24 h和48 h后分析miR-22表达水平。如图5所示,与对照组相比,感染Ad-miR-22后,细胞内miR-22表达水平显著升高(<0.05)。
2.5 miR-22对肝细胞糖异生及葡萄糖摄取的抑制
进一步分析了过表达miR-22对肝细胞糖异生及葡萄糖摄取的影响,HepG2细胞分别感染Ad-GFP和Ad-miR-22后荧光定量PCR分析糖异生关键基因表达,或血清饥饿3 h对细胞同步化,胰岛素及2-NBDG处理细胞30 min,荧光酶标仪检测葡萄糖摄取。如图6A所示,Ad-miR-22处理显著诱导糖异生关键酶PEPCK和G6Pase基因mRNA表达。而过表达miR-22显著抑制基础及胰岛素刺激的HepG2细胞葡萄糖摄取(图6B)。此外,我们研究了过表达miR-22对正常肝细胞L02葡萄糖摄取的影响,得到了类似的结果,过表达miR-22显著抑制了L02细胞葡萄糖的摄取(图6C)。以上研究结果表明miR-22可能抑制肝细胞葡萄糖代谢。
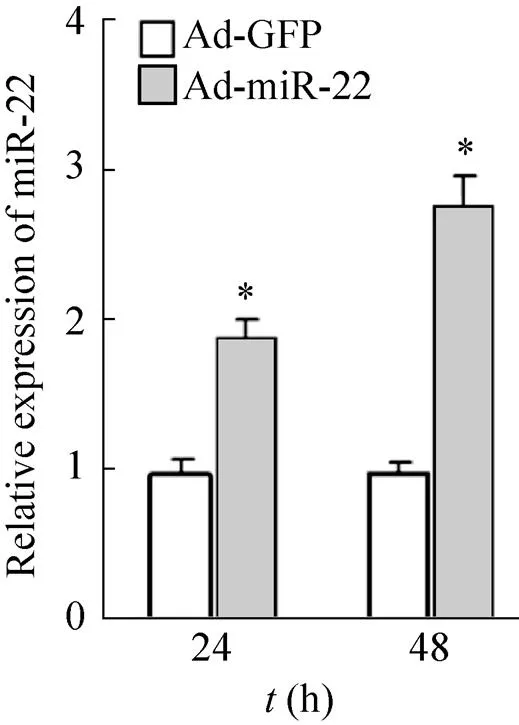
图5 荧光定量PCR分析miR-22表达水平
2.6 miR-22对肝细胞糖原合成的抑制
肝细胞在调节机体葡萄糖代谢过程中发挥了重要作用,进食后胰岛素会增加肝细胞糖原合成,从而维持正常血糖水平。本研究最后分析了过表达miR-22对肝细胞糖原合成的影响。如图7A所示,过表达miR-22对基础糖原合成没有显著影响,但对胰岛素刺激的糖原合成有显著抑制作用。同样,我们在正常肝细胞L02中得到类似的结果,miR-22过表达显著抑制胰岛素诱导的糖原合成(图7B)。
2.7 miR-22对GSK-3β磷酸化及SIRT1蛋白质表达的抑制
如图8所示,与对照组相比较,腺病毒介导的过表达miR-22显著抑制胰岛素刺激的GSK3β磷酸化,并降低SIRT1蛋白表达水平。
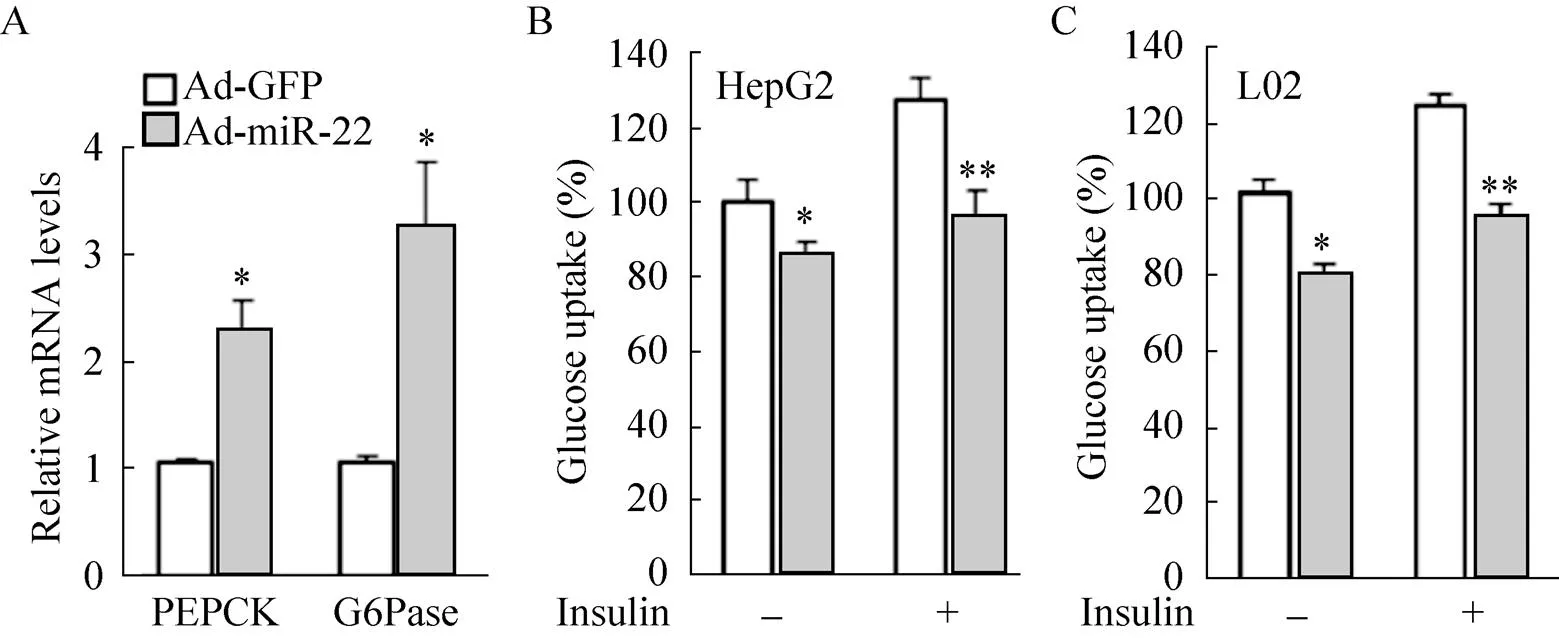
图6 过表达miR-22抑制糖异生及葡萄糖吸收
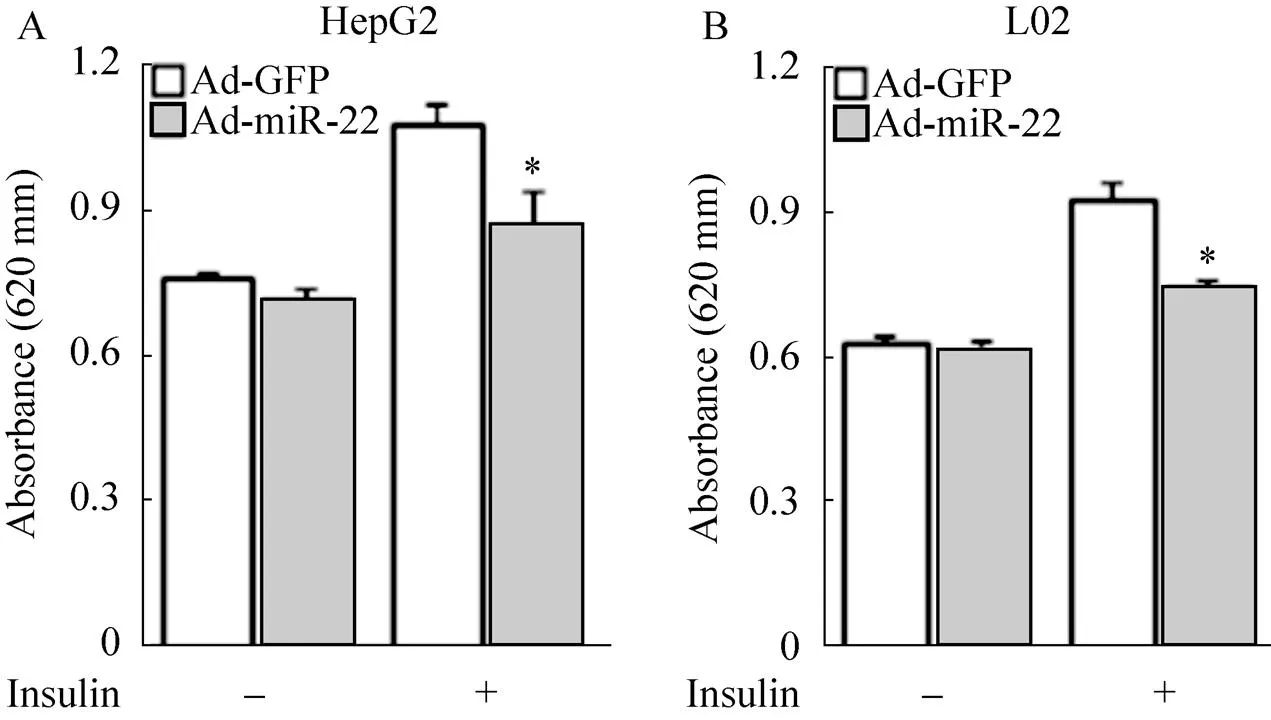
图7 过表达miR-22抑制胰岛素诱导的糖原合成
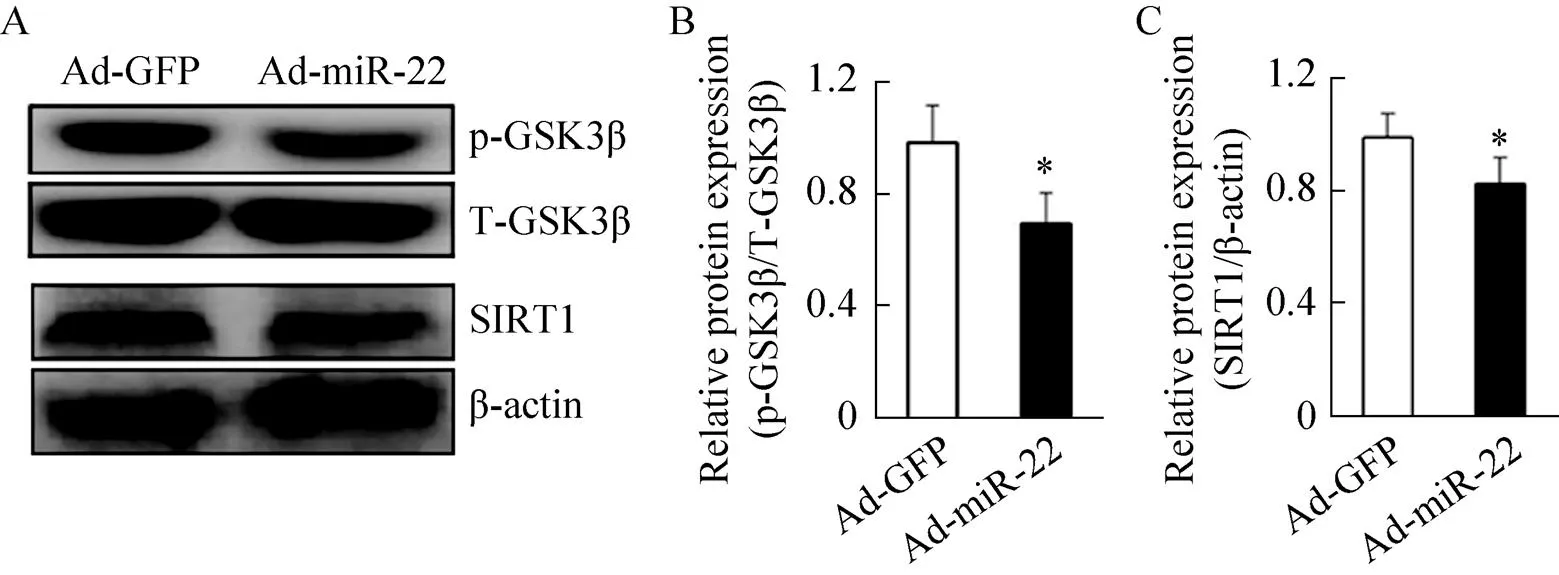
图8 过表达miR-22抑制GSK3β磷酸化及SIRT1蛋白表达
3 讨论
在生理条件下,机体糖代谢的调节主要依靠肝脏、脂肪和肌肉三大代谢组织来完成[18]。进食后,胰岛素分泌增加,促进肌肉和肝脏摄取葡萄糖,并转化为肌糖原和肝糖原进行储存[19]。同时,脂肪细胞在胰岛素的刺激下葡萄糖摄取增加,并最终转变为脂肪进行存储[20]。机体对葡萄糖的转运主要通过细胞膜上的葡萄糖转运蛋白(GLUT1–4) 来完成[21],其中肝脏主要由GLUT2负责葡萄糖的转运。对葡萄糖转运蛋白结构的解析以及对其表达调控的研究一直是糖代谢研究的热点领域[22-26],然而由于人GLUT2属于膜蛋白,结构特殊,解析其三维结构极具挑战性,导致人类对其三维结构知之甚少。由于2型糖尿病发病机制非常复杂,目前尚未完全研究清楚。已经上市的治疗药物较多,但基本难以完全治愈。2型糖尿病在我国的发病率正呈逐年增长趋势,严重影响我国居民健康,进一步揭示其发病机制,寻找新的治疗靶点将为抗2型糖尿病新药研发提供新的思路。
microRNAs是一类小分子量非蛋白质编码RNA,研究表明其在糖代谢过程中扮演了重要角色。最近有研究显示,miR-22在db/db糖尿病模型小鼠肝脏表达水平显著升高,提示miR-22可能参与了肝细胞葡萄糖代谢,并可能与肝细胞胰岛素抵抗密切相关[27]。目前用于基因投递的方式主要分为脂质体、阳离子聚合物等介导的转染和病毒介导的转染,前者转染效率低且不稳定,对细胞损伤较大,血清对转染效率影响较大。而病毒载体如腺病毒介导的转染不仅效率高,而且对细胞无损伤,血清对转染效率影响较小,此外还可以在动物水平进行高效转染。因此,我们设计构建了新的miR-22腺病毒表达载体,希望通过腺病毒载体在肝细胞过表达miR-22,分析其对肝细胞糖异生、葡萄糖摄取及糖原合成的影响,揭示miR-22调节肝糖代谢的分子机制。同时,为动物水平研究miR-22的功能提供了可靠的载体系统。在载体构建过程中,如图2所示,泳道1和2对应的小分子量目标条带较弱,主要是因为载体的分子量大约为9 000 bp,而插入的小分子量目标条带只有480 bp,导致上下两条带的亮度差异较大。
本研究结果表明,过表达miR-22显著抑制基础及胰岛素刺激的HepG2细胞葡萄糖摄取,但miR-22是否影响了葡萄糖转运蛋白的表达或膜定位还需要进一步的研究。之前的研究显示,miR-22能够增加肝细胞糖异生,进而影响其葡萄糖输出,而过度激活的肝糖异生与2型糖尿病密切相关,这些研究结果与我们的数据相一致。
最近的研究显示,miR-22参与了多种肿瘤的发生发展过程[28-31],体内和体外研究均表明miR-22能调节这些肿瘤细胞的增殖与凋亡,但机制尚未研究清楚。肿瘤细胞与正常细胞的区别在于,其增殖失控,需要更多的糖来维持高代谢活性,miR-22可以调节细胞葡萄糖摄取,是否与其在肿瘤代谢调控中的重要角色有关,还需要进一步的探索。
综上所述,我们构建了miR-22的过表达腺病毒,并发现上调miR-22的表达水平促进糖异生基因的表达、抑制HepG2细胞葡萄糖摄取及糖原合成,该作用可能与其调节SIRT1蛋白表达水平有关。
[1] He L, Sabet A, Djedjos S, et al. Metformin and insulin suppress hepatic gluconeogenesis through phosphorylation of CREB binding protein. Cell, 2009, 137(4): 635–646.
[2] Rodgers JT, Lerin C, Haas W, et al. Nutrient control of glucose homeostasis through a complex of PGC-1α and SIRT1. Nature, 2005, 434(7029): 113–118.
[3] Puigserver P, Rhee J, Donovan J, et al. Insulin-regulated hepatic gluconeogenesis through FOXO1–PGC-1α interaction. Nature, 2003, 423(6939): 550–555.
[4] Park JM, Kim TH, Bae JS, et al. Role of resveratrol in FOXO1-mediated gluconeogenic gene expression in the liver. Biochem Biophys Res Commun, 2010, 403(3/4): 329–334.
[5] Lagouge M, Argmann C, Gerhart-Hines Z, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1α. Cell, 2006, 127(6): 1109–1122.
[6] Liu Y, Dentin R, Chen D, et al. A fasting inducible switch modulates gluconeogenesis via activator/coactivator exchange. Nature, 2008, 456(7219): 269–273.
[7] Brennan E, Wang B, McClelland A, et al. Protective effect of let-7 miRNA family in regulating inflammation in diabetes-associated atherosclerosis. Diabetes, 2017, 66(8): 2266–2277.
[8] Herrera BM, Lockstone HE, Taylor JM, et al. Global microRNA expression profiles in insulin target tissues in a spontaneous rat model of type 2 diabetes. Diabetologia, 2010, 53(6): 1099–1109.
[9] Jordan SD, Krüger M, Willmes DM, et al. Obesity-induced overexpression of miRNA-143 inhibits insulin-stimulated AKT activation and impairs glucose metabolism. Nat Cell Biol, 2011, 13(4): 434–446.
[10] Liang JC, Liu CZ, Qiao AJ, et al. MicroRNA-29a-c decrease fasting blood glucose levels by negatively regulating hepatic gluconeogenesis. J Hepatol, 2012, 58(3): 535–542.
[11] Chen YH, Heneidi S, Lee JM, et al. miRNA-93 inhibits GLUT4 and is overexpressed in adipose tissue of polycystic ovary syndrome patients and women with insulin resistance. Diabetes, 2013, 62(7): 2278–2286.
[12] Guay C, Kruit JK, Rome S, et al. Lymphocyte-derived exosomal microRNAs promote pancreatic β cell death and may contribute to Type 1 diabetes development. Cell Metabol, 2019, 29(2): 348–361.e6.
[13] Grigelioniene G, Suzuki HI, Taylan F, et al. Gain-of-function mutation of microRNA-140 in human skeletal dysplasia. Nat Med, 2019, 25(4): 583–590.
[14] He Y, Hwang S, Cai Y, et al. MicroRNA-223 ameliorates nonalcoholic steatohepatitis and cancer by targeting multiple inflammatory and oncogenic genes in hepatocytes. Hepatology, 2019, 70(4): 1150–1167.
[15] Gurha P, Wang TN, Larimore AH, et al. microRNA-22 promotes heart failure through coordinate suppression of PPAR/ERR-nuclear hormone receptor transcription. PLoS ONE, 2013, 8(9): e75882.
[16] Bar N, Dikstein R. miR-22 forms a regulatory loop in PTEN/AKT pathway and modulates signaling kinetics. PLoS ONE, 2010, 5(5): e10859.
[17] Diniz GP, Huang ZP, Liu J, et al. Loss of microRNA-22 prevents high-fat diet induced dyslipidemia and increases energy expenditure without affecting cardiac hypertrophy. Clin Sci, 2017, 131(24): 2885–2900.
[18] Guay C, Roggli E, Nesca V, et al. Diabetes mellitus, a microRNA-related disease? Trans Res, 2011, 157(4): 253–264.
[19] Rhee J, Inoue Y, Yoon JC, et al. Regulation of hepatic fasting response by PPARγ coactivator-1α (PGC-1): requirement for hepatocyte nuclear factor 4α in gluconeogenesis. Proc Natl Acad Sci USA, 2003, 100(7): 4012–4017.
[20] Bergman RN, van Citters GW, Mittelman SD, et al. Central role of the adipocyte in the metabolic syndrome. J Invest Med, 2001, 49(1): 119–126.
[21] Thorens B. GLUT2, glucose sensing and glucose homeostasis. Diabetologia, 2015, 58(2): 221–232.
[22] Thurmond DC, Pessin JE. Molecular machinery involved in the insulin-regulated fusion of GLUT4-containing vesicles with the plasma membrane. Mol Membr Biol, 2001, 18(4): 237–245.
[23] Hruz PW, Mueckler MM. Structural analysis of the GLUT1 facilitative glucose transporter (review). Mol Membr Biol, 2001, 18(3): 183–193.
[24] Sun LF, Zeng X, Yan CY, et al. Crystal structure of a bacterial homologue of glucose transporters GLUT1–4. Nature, 2012, 490(7420): 361–366.
[25] Quistgaard EM, Löw C, Moberg P, et al. Structural basis for substrate transport in the GLUT-homology family of monosaccharide transporters. Nat Struct Mol Biol, 2013, 20(6): 766–768.
[26] Yan N. Structural biology of the major facilitator superfamily transporters. Ann Rev Biophys, 2015, 44: 257–283.
[27] Kaur K, Vig S, Srivastava R, et al. Elevated hepatic miR-22-3p expression impairs gluconeogenesis by silencing the Wnt-responsive transcription factor Tcf7. Diabetes, 2015, 64(11): 3659–3669.
[28] Zhang HH, Tang JL, Li C, et al. MiR-22 regulates 5-FU sensitivity by inhibiting autophagy and promoting apoptosis in colorectal cancer cells. Cancer Lett, 2015, 356(2): 781–790.
[29] Koufaris C, Valbuena GN, Pomyen Y, et al. Systematic integration of molecular profiles identifies miR-22 as a regulator of lipid and folate metabolism in breast cancer cells. Oncogene, 2016, 35(21): 2766–2776.
[30] Yang F, Hu Y, Liu HX, et al. MiR-22-silenced cyclin A expression in colon and liver cancer cells is regulated by bile acid receptor. J Biol Chem, 2015, 290(10): 6507–6515.
[31] Liu XB, Zhang LF, Tong YN, et al. MicroRNA-22 inhibits proliferation, invasion and metastasis of breast cancer cells through targeting truncated neurokinin-1 receptor and ERα. Life Sci, 2019, 217: 57–69.
Effect of recombinant adenovirus Ad-mir-22 on glucose uptake in HepG2 cells
Lihong Liao1, Wenbin Yuan2, Yong Chen2, and Jichao Liang2
1Department of Pediatrics, Zhongnan Hospital of Wuhan University, Wuhan 430071, Hubei, China 2 Hubei Province Key Laboratory of Biotechnology of Chinese Traditional Medicine, National and Local Joint Engineering Research Center of High-throughput Drug Screening Technology, Hubei University, Wuhan 430062, Hubei, China
The recombinant adenoviruses expressing miR-22 (Ad-miR-22) was constructed and the effect of Ad-miR-22 on insulin signal pathway and glucose uptake in HepG2 cells was analyzed. MiR-22 gene was amplified by PCR from human hepatocytes and cloned into the pAdTrack-CMV vector to generate the shuttle plasmid pAdT-22. The positive colonies were confirmed by PCR and sequencing. The resultant shuttle plasmid was linearized withI, followed by co-transformation into competent BJ5183 cells containing an adenoviral backbone plasmid (pAdEasy-1) to create the recombinant plasmid pAd-miR-22. After digested withI, the linearized pAd-miR-22 was transfected into 293A packaging cell line to generate recombinant adenoviruses Ad-miR-22. HepG2 cells were infected with Ad-miR-22 or control Ad-GFP (adenoviruses expressing green fluorescent protein), and then the miR-22 expression levels were analyzed by qPCR. The result shows that adenovirus-mediated overexpression of miR-22 significantly decreased insulin-induced glucose uptake in HepG2 cells. Moreover, overexpression of miR-22 markedly decreased insulin-induced phosphorylation of GSK-3β. miR-22 also increased the mRNA levels of gluconeogenic genes in HepG2 cells. Furthermore, Western blotting results indicate that the protein expression of SIRT1 decreased in Ad-miR-22 infected HepG2 cells as compared with Ad-GFP infected HepG2 cells. In summary, overexpressing of miR-22 significantly increased gluconeogenesis while decreased glucose uptake in HepG2 cells. The effect of miR-22 on glucose metabolism may be mediated by SIRT1.
miR-22, recombinant adenoviruses, glucose uptake, gluconeogenesis, gene therapy, SIRT1
August 2, 2019;
December 16, 2019
Supported by: National Natural Science Foundation of China (Nos. 81400791, 81300555), the Fundamental Research Funds for the Central Universities (No. 2042018kf0082).
Jichao Liang. Tel/Fax: +86-27-88663882; E-mail: liang529114@163.com
国家自然科学基金 (Nos. 81400791,81300555),中央高校基本科研业务费专项资金 (No. 2042018kf0082) 资助。
10.13345/j.cjb.190346
廖立红, 袁文彬, 陈勇, 等. MiR-22重组腺病毒的构建及对HepG2细胞葡萄糖摄取的影响. 生物工程学报, 2020, 36(4): 763–771.
Liao LH, Yuan WB, Chen Y, et al. Effect of recombinant adenovirus Ad-mir-22 on glucose uptake in HepG2 cells. Chin J Biotech, 2020, 36(4): 763–771.
(本文责编 郝丽芳)
——一道江苏高考题的奥秘解读和拓展

