小干扰RNA透皮递送策略研究进展
陈毓,许诺,胡振林
·综 述·
小干扰RNA透皮递送策略研究进展
陈毓1,许诺1,胡振林2
1 温州大学 生命与环境科学学院,浙江 温州 325035 2 温州大学 生命科学研究院,浙江 温州 325035
小干扰 RNA (Small interfering RNA,siRNA) 已被用于各种皮肤病的治疗。然而,由于siRNA具有电负性、极性强、易被核酸酶降解以及难以突破皮肤表皮屏障等缺陷,使其应用受限。因此,安全高效的siRNA递送载体是siRNA有效治疗皮肤病的前提。近年来,随着对siRNA研究的不断深入,基于脂质、聚合物、肽和纳米颗粒的递送系统的开发取得了很大进展,一些新的siRNA透皮递送载体应运而生,如类脂质体、树枝状聚合物、细胞穿透肽、球形核酸纳米颗粒等等。文中将重点介绍近年来siRNA透皮递送载体的最新研究进展。
RNA干扰,小干扰RNA,递送载体,皮肤病,脂质体,聚合物,纳米颗粒
RNA干扰 (RNA interference,RNAi) 是一种基因表达调节机制,可在真核细胞中引起转录后基因沉默现象[1]。siRNA是RNAi的有力工具之一,已应用于多种疾病治疗。皮肤是siRNA最易到达的器官,siRNA疗法尤其适用于皮肤疾病的治疗,很多皮肤病,如银屑病、色素障碍性皮肤病、雄激素源性脱发等,早已开展了siRNA治疗的临床试验[2]。但siRNA很难突破皮肤屏障,到达靶细胞发挥干扰效应。因此,开发透皮递送载体是当前siRNA应用于皮肤病治疗的热点。本文将对siRNA透皮递送最新进展进行综述,为设计安全高效的siRNA透皮递送载体、实现皮肤疾病的高效治疗提供参考。
1 siRNA透皮递送需要克服的障碍
siRNA透皮递送的障碍主要有细胞外屏障和细胞内屏障。细胞外屏障主要来自皮肤角质层的阻碍。皮肤由表皮、真皮、皮下组织以及皮肤附属器官构成,提供了抵御有害外来物入侵的屏障。表皮层的最外层角质层由终末分化的无核角化细胞通过桥粒紧密连接构成10–20 μm厚的薄层,细胞内含大量角蛋白丝,细胞间由神经酰胺、脂肪酸和胆固醇组成的脂质基质粘合在一起,形成了所谓的“砖墙结构”[3]。活性物质经皮渗透主要有跨细胞、细胞间和皮肤附属器3种途径,而角质层的这种结构只允许小分子量 (<500 Da) 的亲脂性分子渗透,因而角质层被认为是皮肤的主要物理屏障,阻碍了外来物的进入[4]。而siRNA的极性强且分子量在13 kDa左右,难以穿过皮肤屏障,因而角质层成为了siRNA透皮递送首要克服的障碍[2]。细胞内的障碍是从细胞膜的渗透一直至siRNA对靶mRNA的作用,siRNA带负电荷且分子量高,很难通过细胞膜,即使siRNA穿过细胞膜,裸siRNA也易被溶酶体或者核酸酶降解而失活[5]。
2 siRNA透皮递送载体
理想的siRNA透皮递送载体应能克服 siRNA的理化性质,满足皮肤渗透条件,以及保护siRNA免受细胞内环境的作用。近年来,开发了不少siRNA的皮肤递送载体,包括脂质体、树枝状分子、细胞渗透肽、纳米颗粒等等,这些载体的优点包括高递送效率、高生物相容性、低免疫原性以及靶向性等[6]。
2.1 基于脂质的siRNA递送系统
脂质载体是运用最广泛的药物递送系统,也是应用最早的透皮载体。脂质系统递送效率受粒径、电荷、脂质比或组成成分等因素的影响,其大小在20 nm至0.5 µm不等,主要以包裹形式携带siRNA向皮肤各层递送。总的来说,这类脂质系统由于与皮肤脂质成分相近而具有较好的生物相容性、低免疫原性、制备简单以及开发成本低等优点,在siRNA的透皮递送载体设计中较受欢迎。
2.1.1 脂质体
脂质体 (Liposomes) 是由磷脂和其他类脂构成脂质双分子层包围亲水核心的闭合囊球 (图1)。脂质体介导的siRNA递送系统将siRNA包裹到水性囊泡中或将脂质体与siRNA相连,通过脂质体的变形性,将携带着的siRNA从角质层细胞间挤过。然而,传统脂质体结构成分与角质层、细胞膜的脂基成分相似,虽提高了其生物相容性,但在透皮过程中容易发生聚集而无法深入皮肤深层,同时结构中的磷脂易氧化而影响稳定性,因而传统脂质体递送siRNA在皮肤应用研究中并不多见[7-8]。为改善脂质体携带siRNA向靶点的透皮递送,开始对传统脂质体进行优化,其中之一就是开发了以阳离子脂质体为主的siRNA脂基递送系统,比如1,2-二十八烯基-3-三甲胺-丙烷 (DOTMA)、1,2-二烯基-3-三甲胺-丙烷 (DOTAP)等[9]。基于阳离子脂质载体DOTAP为主的脂蛋白复合物递送系统用于透皮递送针对Kelch样ECH相关蛋白1 (Keap1) 的siRNA,有效抑制了NF-E2相关因子2 (Nrf-2) 的表达,改善了糖尿病小鼠模型中的伤口闭合[10]。
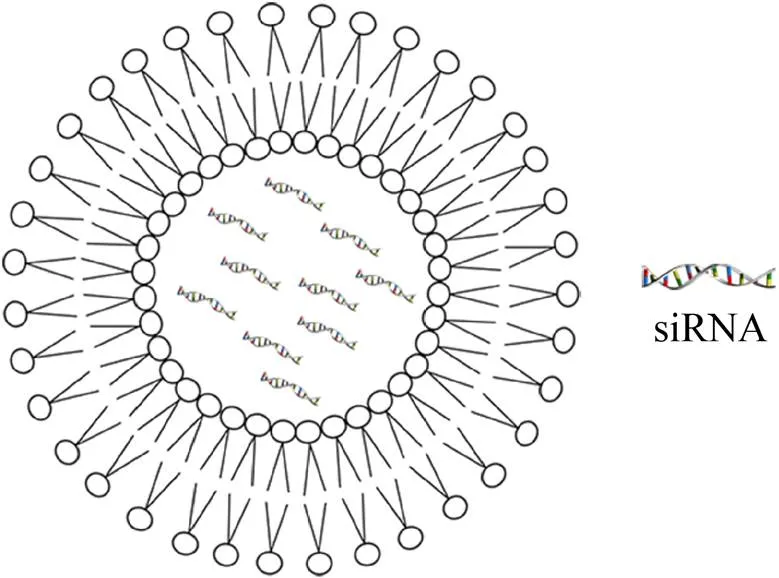
图1 用于siRNA递送的脂质体结构
2.1.2 类脂质体
类脂质体 (Niosomes) 是由非离子表面活性剂自组装成的单层或双层结构[11]。与脂质体相比,类脂质体具有更高的稳定性和包封效率、更好的灵活性和强渗透性以及较低的生产成本。类脂质体能可逆降低角质层的阻隔性,使活性成分更快通过表皮层,很多市售皮肤护理产品都运用类脂质体来递送活性成分。然而类脂质体递送效率受多种因素影响,如表面活性剂的性质和结构、包封药物的性质、膜组成形状等。目前以类脂质体为原型衍生出了核-壳结构的纳米球概念,大小在10 nm至200 nm之间,能更有效地向皮肤深层递送活性成分[12]。局部应用这些载体递送siRNA,可能比脂质体显示更强的基因沉默能力。
2.1.3 可变形囊泡
可变形囊泡 (Ultradeformable vesicles,UDV),又称柔性纳米脂质体,因具有高度变形性和水化梯度驱动力,更易通过皮肤上的微孔道,将负载药物递送到表皮和真皮层中,克服了传统脂质体的不稳定性以及皮肤渗透性差等缺点,有望成为新一代的药物靶向载体[13]。目前关注较高的UDV主要是传递体 (Transfersomes)、醇质体 (Ethosomes) 和醇传递体(Transethosomes) 3种,其最大区别在于掺入了不同极性的活性物质,因此对皮肤的渗透性也有所不同[14]。
传递体是第一代UDV,主要由磷脂和边缘活化剂 (EAs) 如胆酸钠 (NaCho)、脱氧胆酸钠、Span、Tween和甘草酸二钾组成[15]。EAs/磷脂比是影响其在皮肤层渗透深度和递送效率的关键因素,EAs的掺入增加了角质层的水合作用,增强了皮肤的亲和力,同时EAs能使囊泡轻易改变形状以应对外来机械压力,使之能挤过直径只有囊泡十分之一的通道[16-17]。Dorrani等[18]在黑色素瘤治疗研究中发现DOTAP/NaChol为6∶1的传递体可渗透皮肤层且将BRAF-siRNA均匀地沉积在真皮层,调整配制比为8∶1时,其可有效地穿透角质层并沉积于下表皮/上真皮,且此种配比下siRNA的递送速率最高;然而配制比为10∶1的传递体克服角质层屏障后只能沉积在上表皮中。
醇质体是主要由磷脂、20%–45%低级醇和水组成的囊泡[19]。因含高剂量乙醇体,形成了高弹性囊泡膜,具有柔软可塑、强变形性的特点,同时乙醇体可以嵌入到皮肤脂质分子层中,破坏并溶解角质层的脂质,改善了诸如siRNA类高亲水性分子在封闭和非封闭条件下向皮肤深层的递送[20]。Chen等[21]设计了一种SPACE穿透肽修饰的醇脂质体,该组合系统促进了GAPDH-siRNA在猪皮肤中的渗透和积累。
醇传递体是2012年Song等开发出的一种新型柔性脂质载体,其结合了醇质体和传递体的优点,除基本的脂质成分外,同时也具有高含量的乙醇 (高达30%) 和边缘活化剂,致使其在皮肤的渗透和驻留能力均比醇质体和传递体强,同时,醇传递体能稳定包封siRNA长达4周[13,22-23]。在皮肤人源化小鼠牛皮癣模型中,包封于醇传递体中的DEFB4-siRNA被准确地递送至表皮抑制靶基因的表达,改善了小鼠背部银屑病样特征[24]。
伴随着脂质系统在透皮靶向递送siRNA设计上的不断优化,其可能成为用于治疗诸如牛皮癣等皮肤疾病较有前途的治疗工具。但是受尺寸、电荷等影响,脂质系统还需改进低封装效率的问题。
2.2 基于聚合物的siRNA递送系统
基于聚合物的递送载体具有生物相容性和可生物降解等优点,在siRNA透皮递送载体研究中越来越受到关注,其不仅解决了siRNA低携带率的难题,同时也表现出高转染率。大部分聚合物通常含高密度正电荷,与带负电荷的siRNA通过静电结合作用,自发形成紧凑的siRNA-聚合物复合物,可大大降低siRNA表面的负电荷,进一步提高其稳定性,同时克服了裸siRNA难以轻易穿过细胞生物膜的障碍。此外,这些高电荷密度的阳离子聚合物通常具有“质子海绵效应”,这有利于协助寡核苷酸从内体逃逸,保护siRNA免于降解,从而能提高siRNA转染效率[25]。因考虑到生物降解性问题,目前基于聚合物的siRNA递送载体主要向树突状大分子等生物可降解聚合物的方向发展。
2.2.1 聚乙烯亚胺
聚乙烯亚胺 (Polyethyleneimine,PEI) 是研究较多的用于递送核酸的聚合物载体。PEI的结构内含许多氨基基团,并呈现高密度正电荷,促使其具有较好的络合作用和内体/溶酶体途径所涉及到的pH范围内的pH缓冲能力,保护核酸免受溶酶体降解,这也是其高转染效率的关键因素[26-27]。PEI的独特性能使其成为siRNA递送载体而被广泛应用。然而PEI的一个显著缺点就是细胞毒性问题,PEI以线状和分支状两种形式存在,随着分子量和分支结构的增加,其转染效率相对来说不断提高,但表现出来的细胞毒性也随之增加。因此,与分支状PEI相比,线性或者低分子量的PEI似乎拥有良好的转染效率和低毒性。然而低分子量的PEI供siRNA结合的位点较少,在酸性环境下不能维持结构稳定性,这就大大限制了PEI作为递送载体的能力[28-29]。为了克服这一缺点,在不改变其理化性质的基础上,对PEI进行了各种修饰以优化PEI递送载体。比如在皮肤疤痕研究过程中[30]分子量25 kDa的PEI处理的细胞,其活力仅不到30%,而PEI经山梨醇修饰后 (PSPEI),显著降低了细胞毒性,细胞活力提高至80%;在伤口处结缔组织生长因子 (CTGF) 高表达,向伤口处递送CTGF-siRNA以沉默CTGF,减少伤口愈合时疤痕的形成,经PSPEI处理的伤口较裸siRNA或25 kD-PEI组提前愈合,且伤口疤痕缩小。此外,经硬脂酸修饰的PEI (StA-PEI) 将siRNA递送至B16黑色素瘤细胞中实现了STAT3的高效下调,而且StA-PEI络合siRNA所需要的含量比PEI更少,这表明其潜在的毒性可能更低[31]。
2.2.2 树突状聚合物
树突状聚合物是具有树状结构的纳米级大分子[32](图2)。与传统的线性和支链聚合物不同,树突状聚合物有以下一些优点:1) 可控制的大小和亲脂性,造就了树突状聚合物球形形态及其通过细胞膜的能力[33];2) 具有丰富的末端基团可进行不同配体的修饰,例如探针、靶向配体等,这些修饰降低了siRNA-树突状聚合物在递送过程中的毒性,提高靶向性[34];3) 优良的柔韧性使其空间位阻较低,利于和siRNA结合并可形成约70 nm的稳定纳米粒,协助siRNA从酸性内体环境中逃逸,从而促进siRNA的释放,达到基因沉默的效果[35-36]。目前已开发了在siRNA递送中均取得良好效果的多种树状聚合物,如高负载能力的氟化树枝状聚合物、优良生物相容性能的氨基酸官能化树枝状聚合、高转染能力的碳硅烷树枝状聚合物,除此之外还有聚胺类树状聚合物、聚丙烯亚胺类树状聚合物、聚赖氨酸类树状聚合物等[2]。近年来为进一步改善树枝状聚合物透皮递送效率,许多研究团队开始对其进行重新设计或者优化。Liu等[37]将两亲性树枝状聚合物自组装成囊泡状纳米结构用于递送siRNA到多种细胞类型中,包括原代细胞和干细胞,表现出了高递送效率和成功的基因沉默。在糖尿病大鼠皮肤愈合实验[38]中环糊精修饰的聚酰胺-胺 (PAMAM) 阳离子星形聚合物成功将MMP9-siRNA递送至成纤维细胞中,导致MMP-9表达下调,促进糖尿病创面愈合。经C12饱和烷基链修饰后的PAMAM在递送极低剂量的siRNA (10 nmol/L) 时,其基因沉默效率也能达到80%[39]。携带siRNA-VEGF的可生物还原的氟化肽第二代树状聚合物显示出了优异的基因沉默功效,达到了65%[40]。然而,高效siRNA-树突状聚合物递送载体存在难制备的问题,高代数的树突状分子其结合siRNA的能力较高,递送效率虽随之提高,但同时空间位阻也相对增加,导致其制备难度增加,难以大规模生产,这就限制了其更广泛的应用。
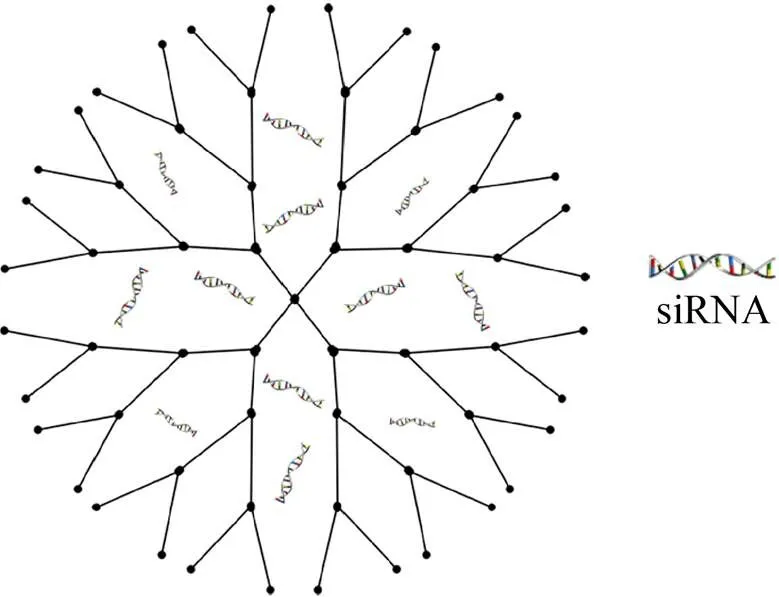
图2 用于递送siRNA的树突状聚合物
2.2.3 聚乳酸-乙醇酸
聚乳酸-乙醇酸 (Polylactic-co-glycolic acid,PLGA) 是一种具有生物可降解性的安全聚合物,广泛应用于药物的递送,包括siRNA递送。在细胞水平上,PLGA容易穿透细胞膜或促进siRNA通过内吞作用进入细胞,并在溶酶体降解siRNA之前将其快速释放到靶位置。然而,有报道PLGA单独与siRNA结合时封装效率、药物释放和转染效率都有限,可能受siRNA的阴离子电荷和极性的影响。运用PEI修饰的PLGA纳米颗粒,提高了对siRNA的包封效率和释放度,改善了siRNA在聚合物中的保留,促进了siRNA向细胞质的释放[41]。这些研究表明,PLGA纳米颗粒也是siRNA有效皮肤递送的潜在方法。
虽然siRNA-聚合物载体的研究取得了一些令人欣慰的进展,但是毒性问题依然是限制聚合物载体往临床转化的一大障碍,大部分适用于siRNA的聚合物透皮载体表面携带较多的正电荷,虽因此使其保持着较高的转染率,但过多的正电荷同时会增加复合物的细胞毒性,尽管可以通过表面修饰进行毒性的降低,但是安全性问题一直是人们最为关注的焦点,在聚合物载体进入临床应用前必须进行安全性和毒性的评估。
2.3 细胞穿透肽
细胞穿透肽 (CPP) 作为一种低毒有效的生物活性分子递送载体也成为了siRNA透皮递送的候选治疗工具。CPP通常由不超过30个氨基酸的短序列组成,可分为阳离子、两亲性和疏水性三类,通过能量依赖或独立机制经组织和细胞膜,将生物活性大分子导入细胞内,具有极高的穿膜转运效率[42]。目前已有几种CPP,如TAT、聚精氨酸、TD-1、SPACE肽等,被证明可增强siRNA在皮肤上的递送。TAT (HIV-1细胞穿透肽)[43]是富含精氨酸和赖氨酸的阳离子类肽,以能量依赖方式克服皮肤障碍,易位进入细胞。TAT载体携带siRNA以纳米颗粒的形式向皮肤递送时,当直径大于70 nm,TAT-siRNA纳米颗粒可从毛囊穿过,70 nm以下的颗粒则可通过表皮渗透[44]。TD-1 (ACSSSPSKHCG)和SPACE肽通过与皮肤角质细胞中的角蛋白结合促进跨细胞途径的转运[45]。CPP以共价或非共价形式与递送物缀合,共价结合形式相对耗时,对递送物的特异性要求较高,相对来说,非共价缀合显得较灵活,带负电的siRNA通过静电相互作用与CPP构成非共价复合物,这避免了对siRNA的任何化学修饰,从而极大地保留了siRNA活性,然而,CPP以非共价结合形式穿膜,可能干扰CPP与细胞膜相互作用的能力[46]。因此,许多研究开始对CPP进行化学修饰或以多聚体形式与另一种siRNA载体结合使用以允许其不受阻碍被摄取并促进释放。比如Tat肽 (GRKKRRQRRRCG) 和AT1002 (FCIGRLCG) 的双肽系统[47-48]来增强siRNA在皮肤中的基因干扰效率。siRNA通过与Tat肽静电复合以增强细胞内递送,而AT1002肽作为皮肤细胞紧密连接的调节剂以增强复合物渗透到表皮和真皮中。运用特应性皮炎小鼠模型研究siRNA皮内渗透[49],AT1002和硬脂酸 (STR)修饰的CH2R4H2C肽作为siRNA的递送载体,涂抹皮肤1 h后即可在表皮层5–10 µm检测到siRNA强荧光信号,10 h后,siRNA荧光信号深入到皮肤深层50 µm处;而未经修饰的CH2R4H2C肽或STR-CH2R4H2C肽携带siRNA仅停留在表皮层5–10 µm处。此外,很多穿膜肽也运用纳米技术来优化增强其递送系统,比如正在进行Ⅱa期临床研究的一种抗纤维化siRNA治疗候选药物STP705,其正是利用多肽纳米颗粒 (PNP) 增强递送系统以及双重靶向抑制特性直接降低了皮肤伤口纤维化活性和炎症活性,减少了皮肤增生性瘢痕的形成[50]。
除了CPP的递送优势外,另外值得注意的是,大部分初级CPP的细胞特异性较低,导致靶向性不高,今后在往临床研究应用时还需要对其加以优化;此外,能应用于siRNA透皮递送的CPP种类有限,高效安全的CPP还需要进一步开发。
2.4 基于纳米颗粒的siRNA递送系统
基于纳米级颗粒的各种新型药物递送载体因具有独特的优势已在透皮递送领域中取得了一定的地位[51]:1) 根据大小、形状、表面电荷以及平衡亲水性-疏水性能调节角质层流化;2) 纳米级递送载体与皮肤表面紧密接触,药物驻留时间加长,同时具有药物控释能力;3) 经细胞特异性配体修饰以提高靶向性;4) 纳米载体可经毛囊等皮肤附属器向皮肤深层释放药物。基于这些优点,纳米载体被发展为皮肤基因治疗最具潜力的透皮递送工具。
2.4.1 脂质-聚合物杂化纳米颗粒
脂质-聚合物杂化纳米颗粒 (Lipid-polymer hybrid nanoparticles,LPN) 结合了聚合物纳米颗粒和脂质体的特征,在结构完整性、贮存稳定性、聚合物核的控释能力以及生物相容性和生物利用度方面显示出了极大的优越性,已迅速发展成为一个强大的基因递送载体[52]。LPN53]主要包含3种组分:一是包封药物的可生物降解的聚合物核心;二是包裹聚合物核心的内部脂质层,主要功能是赋予聚合物核心生物相容性,同时起到分子栅栏的作用,最大限度地减少封装物的泄漏,另外通过限制水向内扩散来减缓聚合物的降解,从而实现封装物的持续释放;三是外部脂质PEG层,用于稳定载体,此外脂质的嵌入也增加了其在皮肤层的渗透能力。Shi等[54]开发了PLGA脂质杂化纳米颗粒,与PLGA和PLGA-PEG相比,杂化纳米颗粒siRNA包封率高达78%–82%,而PLGA和PLGA-PEG仅包封所需siRNA的4%–8%。Desai 等[55]基于此设计了一种新型环状阳离子头脂质-聚合物杂合纳米载体 (CyLiPns),有效地将TNFα- siRNA和辣椒素 (Cap) 递送至真皮层360 µm处,在治疗慢性皮肤炎性疾病方面显示出协同作用。
2.4.2 球形核酸纳米颗粒
球形核酸纳米颗粒 (Spherical nucleic acid nanoparticle conjugates,SNA-NCs) 是一种以球形纳米颗粒为核心,高度定向的寡核苷酸致密地附着在纳米颗粒表面,以此形成球状结构的核酸递送载体,尺寸在5 nm至400 nm之间[56](图3)。构成SNA-NCs核心结构的材料,包括各种各样的无机粒子 (金、银、铂、二氧化硅等)、有机材料 (脂质体、聚合物等) 或者混合结构 (金属-有机骨架) 等[57],这些纳米颗粒缀合物本质上就是惰性材料,稳定性高,具有强抗菌性,既不需要阳离子转染材料也不需要额外的修饰来驱动进入细胞,像L’Oreal和L’Core Paris等化妆品巨头公司正在使用金纳米粒子制造更有效的乳霜和乳液。迄今为止,SNA-NC已经在超过50种细胞系、组织和器官中验证了其高效的穿透力、靶向性、快速摄取和低免疫原性等性能。为了证明siRNA-SNA能穿透皮肤进行基因调节,Zheng等[58]设计了金纳米颗粒来递送siRNA,其几乎100%穿过角质形成细胞,在皮肤局部施用几小时后即可穿过小鼠模型和人类皮肤模拟物中的表皮屏障,递送效率比商用转染剂高达100倍之多。糖尿病小鼠创口愈合研究中[59],局部施用经SNA递送的GM3S-siRNA,12 d内可完全治愈糖尿病样小鼠的伤口,相对于游离的GM3S-siRNA,其加速了伤口愈合,同时在实验小鼠的肺、肾等其他器官中几乎检测不到SNA的痕迹。在银屑病治疗方面,直径约12 nm的金纳米颗粒被开发出来递送siRNA,仅24 h就达到了90%的细胞转染率,而且在皮摩尔至纳摩尔浓度下即可显示出持久的皮肤内基因敲低能力,同时未表现出毒性[60]。
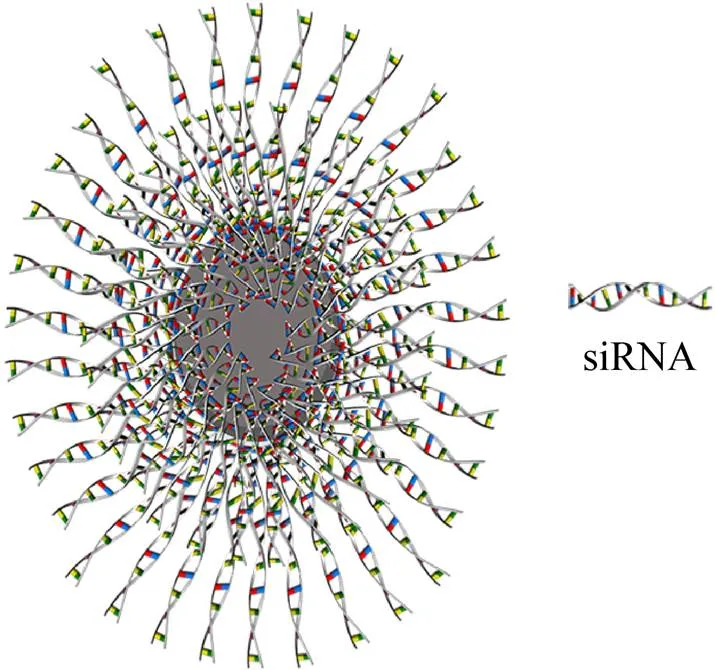
图3 用于递送siRNA的球形核酸纳米颗粒
除重金属纳米颗粒以外,介孔二氧化硅纳米颗粒 (MSNP) 也被开发出来用于核酸的递送。与金纳米颗粒不同,MSNP[61]独特的多孔结构以及较高的比表面积,表现出了高装载效率、优异的生物相容性和化学稳定性,同时也易于合成和修饰。Lio等[62]将靶向TGFβR-1的siRNA装载到经多聚赖氨酸修饰 (PLL) 的MSNPs介孔中,构建了MSNPs-PLL复合物,并在异种移植模型小鼠中将siRNA经皮递送到皮肤鳞状细胞癌中,显著下调了TGFβR-1的表达,并抑制了肿瘤的生长,抑制率达2倍之多。这些结果均表明了SNA-NCs成为siRNA透皮递送载体的巨大潜力。
3 总结与展望
文中总结了脂质、聚合物、穿膜肽以及纳米颗粒等载体在siRNA透皮递送过程中的应用及研究进展。脂质载体因其具备低免疫原性以及高度柔韧性而提高了siRNA的递送效率;聚合物递送系统优良的生物相容性改善了siRNA的生物可降解性;穿膜肽提高了siRNA的透皮性以及细胞转染效率;基于纳米颗粒的递送系统给予了siRNA高度的靶向性和稳定性;这些新型的透皮递送载体克服了siRNA局部透皮释放的障碍,给siRNA治疗剂的开发提供了新的方向,给皮肤疾病的治疗带来了新的希望。但是将这些siRNA透皮递送载体真正转向临床应用又是一个更大的挑战,仍然有一系列的问题需要解决。比如,脂质载体有限的包裹空间不足以提供高负载率而难以在靶部位释放有效作用剂量;聚合物载体高阳离子电荷易对细胞膜造成破坏,因而可能影响周边正常细胞功能;穿膜肽携带siRNA穿透皮肤进入体内后容易受核酸酶的降解而导致稳定性发生改变;金纳米颗粒在体内的重金属累积以及清除也是一个令人担忧的问题。
为了克服这些挑战,研究者开始重新优化siRNA载体系统,比如设计基于脂质体的双药递送系统[63],又或者构建复合纳米颗粒,比如LPN[64]等等,均比单一成分的递送系统发挥出更高效的皮肤内基因沉默效果。基于此,本课题组结合穿膜肽与纳米颗粒的特性提出构建基于穿膜肽修饰的复合纳米载体的思路,我们期望该载体能显著提高siRNA的透皮性和转染性,通过介导细胞的内吞作用,将siRNA靶向运输至作用部位,改善siRNA的稳定性,提高siRNA的生物利用度。我们认为从长远来看,复合纳米载体的siRNA透皮递送载体将表现出更大的发展潜力,将会是一种潜在高效的siRNA局部透皮给药系统。
目前,关于siRNA的透皮递送系统的开发研究越来越多,随着研究的深入,相信在不久的将来,会有更多新型的siRNA透皮递送载体被设计出来,基于siRNA的RNAi技术将逐步成熟,其将在皮肤疾病乃至其他疾病治疗方面作出巨大贡献。
[1] Fire A, Xu S, Montgomery MK, et al. Potent and specific genetic interference by double-stranded RNA in. Nature, 1998, 391(6669): 806–811.
[2] Aldawsari M, Chougule MB, Babu RJ. Progress in topical siRNA delivery approaches for skin disorders. Curr Pharm Des, 2015, 21(31): 4594–4605.
[3] Lee T, Friedman A. Skin barrier health: regulation and repair of the stratum corneum and the role of Over-the-Counter skin care. J Drugs Dermatol, 2016, 15(9): 1047–1051.
[4] Lane ME. Skin penetration enhancers. Int J Pharm, 2013, 447(1/2): 12–21.
[5] Chen X, Mangala LS, Rodriguez-Aguayo C, et al. RNA interference-based therapy and its delivery systems. Cancer Metastasis Rev, 2018, 37(1): 107–124.
[6] Rosa J, Suzuki I, Kravicz M, et al. Current non-viral sirna delivery systems as a promising treatment of skin diseases. Curr Pharm Des, 2018, 24(23): 2644–2663.
[7] Elsayed MMA, Abdallah OY,Naggar VF, et al. Lipid vesicles for skin delivery of drugs: reviewing three decades of research. Int J Pharm, 2007, 332(1/2): 1–16.
[8] Geusens B, Strobbe T, Bracke S, et al. Lipid-mediated gene delivery to the skin. Eur J Pharm Sci, 2011, 43(4): 199–211.
[9] Wan C, Allen TM, Cullis PR. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Deliv Transl Res, 2014, 4(1): 74–83.
[10] Rabbani PS, Zhou A, Borab ZM, et al. Novel lipoproteoplex delivers Keap1 siRNA based gene therapy to accelerate diabetic wound healing. Biomaterials, 2017, 132: 1–15.
[11] Bartelds R, Nematollahi MH, Pols T, et al. Niosomes, an alternative for liposomal delivery. PLoS ONE, 2018, 13(4): e0194179.
[12] Kaul S, Gulati N, Verma D, et al. Role of nanotechnology in cosmeceuticals: a review of recent advances. J Pharm, 2018, 2018: 3420204.
[13] Ascenso A, Raposo S, Batista C, et al. Development, characterization, and skin delivery studies of related ultradeformable vesicles: transfersomes, ethosomes, and transethosomes. Int J Nanomedicine, 2015, 10: 5837–5851.
[14] Ita K. Current status of ethosomes and elastic liposomes in dermal and transdermal drug delivery. Curr Pharm Des, 2016, 22(33): 5120–5126.
[15] Niki E. Role of vitamin E as a lipid-soluble peroxyl radical scavenger:andevidence. Free Rad Biol Med, 2014, 66: 3–12.
[16] Chen J, Lu WL, Gu W, et al. Skin permeation behavior of elastic liposomes: role of formulation ingredients. Expert Opin Drug Deliv, 2013, 10(6): 845–856.
[17] Rai S, Pandey V. Transfersomes as versatile and flexible nano-vesicular carriers in skin cancer therapy: the state of the art. Nano Rev Exp, 2017, 8(1): 1325708.
[18] Dorrani M, Garbuzenko OB, Minko T, et al. Development of edge-activated liposomes for siRNA delivery to human basal epidermis for melanoma therapy. J Control Release, 2016, 228: 150–158.
[19] Abdulbaqi IM, Darwis Y, Khan NAK, et al. Ethosomal nanocarriers: the impact of constituents and formulation techniques on ethosomal properties,studies, and clinical trials. Int J Nanomedicine, 2016, 11: 2279–2304.
[20] Sala M, Diab R, Elaissari A, et al. Lipid nanocarriers as skin drug delivery systems: Properties, mechanisms of skin interactions and medical applications. Int J Pharm, 2018, 535(1/2): 1–17.
[21] Chen M, Zakrewsky M, Gupta V, et al. Topical delivery of siRNA into skin using SPACE-peptide carriers. J Control Release, 2014, 179: 33–41.
[22] Song CK, Balakrishnan P, Shim CK, et al. A novel vesicular carrier, transethosome, for enhanced skin delivery of voriconazole: characterization and/evaluation. Colloids Surf B Biointerfaces, 2012, 92: 299–304.
[23] Chen XF. Current and future technological advances in transdermal gene delivery. Adv Drug Deliv Rev, 2018, 127: 85–105.
[24] Desmet E, Bracke S, Forier K, et al. An elastic liposomal formulation for RNAi-based topical treatment of skin disorders: Proof-of-concept in the treatment of psoriasis. Int J Pharm, 2016, 500(1/2): 268–274.
[25] Wojnilowicz M, Glab A, Bertucci A, et al. Super-resolution imaging of proton sponge-triggered rupture of endosomes and cytosolic release of small interfering RNA. ACS Nano, 2019, 13(1): 187–202.
[26] Grayson ACR, Doody AM, Putnam D. Biophysical and structural characterization of polyethylenimine-mediated siRNA delivery. Pharm Res, 2006, 23(8): 1868–1876.
[27] Neuberg P, Kichler A. Recent developments in nucleic acid delivery with polyethylenimines. Adv Genet, 2014, 88: 263–288.
[28] Fischer D, Bieber T, Li YX, et al. A novel non-viral vector for DNA delivery based on low molecular weight, branched polyethylenimine: effect of molecular weight on transfection efficiency and cytotoxicity. Pharm Res, 1999, 16(8): 1273–1279.
[29] Reineke TM, Davis ME. Nucleic acid delivery via polymer vehicles. Polym Sci A Compr Refer, 2012, 9: 497–527.
[30] Cho KH, Singh B, Maharjan S, et al. Local delivery of CTGF siRNA with Poly(sorbitol-co-PEI) reduces scar contraction in cutaneous wound healing. Tissue Eng Regen Med, 2017, 14(3): 211–220.
[31] Alshamsan A, Hamdy S, Samuel J, et al. The induction of tumor apoptosis in B16 melanoma following STAT3 siRNA delivery with a lipid-substituted polyethylenimine. Biomaterials, 2010, 31(6): 1420–1428.
[32] Menjoge AR, Kannan RM, Tomalia DA. Dendrimer-based drug and imaging conjugates: design considerations for nanomedical applications. Drug Discov Today, 2010, 15(5/6): 171–185.
[33] Kalomiraki M, Thermos K, Chaniotakis NA. Dendrimers as tunable vectors of drug delivery systems and biomedical and ocular applications. Int J Nanomedicine, 2016, 11: 1–12.
[34] Wang H, Huang Q, Chang H, et al. Stimuli-responsive dendrimers in drug delivery. Biomater Sci, 2016, 4(3): 375–390.
[35] Liu XX, Rocchi P, Qu FQ, et al. PAMAM dendrimers mediate siRNA delivery to target Hsp27 and produce potent antiproliferative effects on prostate cancer cells. ChemMedChem, 2009, 4(8): 1302–1310.
[36] Kesharwani P, Banerjee S, Gupta U, et al. PAMAM dendrimers as promising nanocarriers for RNAi therapeutics. Mater Today, 2015, 18(10): 565–572.
[37] Liu XX, Zhou JH, Yu TZ, et al. Adaptive amphiphilic dendrimer-based nanoassemblies as robust and versatile siRNA delivery systems. Angew Chem Int Ed Engl, 2014, 53(44): 11822–11827.
[38] Li N, Luo HC, Yang C, et al. Cationic star-shaped polymer as an siRNA carrier for reducing MMP-9 expression in skin fibroblast cells and promoting wound healing in diabetic rats. Int J Nanomedicine, 2014, 9: 3377–3387.
[39] Chang H, Zhang YM, Li L, et al. Efficient delivery of small interfering RNA into cancer cells using dodecylated dendrimers. J Mater Chem B, 2015, 3(41): 8197–8202, doi: 10.1039/C5TB01257K.
[40] Cai XJ, Zhu HF, Zhang YM, et al. Highly efficient and safe delivery of VEGF siRNA by bioreducible fluorinated peptide dendrimers for cancer therapy. ACS Appl Mater Interfaces, 2017, 9(11): 9402–9415.
[41] Patil Y, Panyam J. Polymeric nanoparticles for siRNA delivery and gene silencing. Int J Pharm, 2009, 367(1/2): 195–203.
[42] Gagat M, Zielinska W, Grzanka A. Cell-penetrating peptides and their utility in genome function modifications (Review). Int J Mol Med, 2017, 40(6): 1615–1623.
[43] Guidotti G, Brambilla L, Rossi D. Cell-penetrating peptides: from basic research to clinics. Trends Pharmacol Sci, 2017, 38(4): 406–424.
[44] Nasrollahi SA, Taghibiglou C, Azizi E, et al. Cell-penetrating peptides as a novel transdermal drug delivery system. Chem Biol Drug Des, 2012, 80(5): 639–646.
[45] Kumar S, Zakrewsky M, Chen M, et al. Peptides as skin penetration enhancers: mechanisms of action. J Control Release, 2015, 199: 168–178.
[46] Beloor J, Zeller S, Choi CS, et al. Cationic cell-penetrating peptides as vehicles for siRNA delivery. Ther Deliv, 2015, 6(4): 491–507.
[47] Uchida T, Kanazawa T, Takashima Y, et al. Development of an efficient transdermal delivery system of small interfering RNA using functional peptides, Tat and AT-1002. Chem Pharmaceut Bull, 2011, 59(2): 196–201.
[48] Manosroi J, Lohcharoenkal W, Götz F, et al. Transdermal absorption and stability enhancement of salmon calcitonin by Tat peptide. Drug Dev Ind Pharm, 2012, 39(4): 520–525.
[49] Ibaraki H, Kanazawa T, Takashima Y, et al. Development of an innovative intradermal siRNA delivery system using a combination of a functional stearylated cytoplasm-responsive peptide and a tight junction-opening peptide. Molecules, 2016, 21(10): E1279.
[50] Nikam RR, Gore KR. Journey of siRNA: Clinical developments and targeted delivery. Nucleic Acid Ther, 2018, 28(4): 209–224.
[51] Pradhan M, Alexander A, Singh MR, et al. Understanding the prospective of nano-formulations towards the treatment of psoriasis. Biomed Pharmacother, 2018, 107: 447–463.
[52] Krishnamurthy S, Vaiyapuri R, Zhang L, et al. Lipid-coated polymeric nanoparticles for cancer drug deliveryBiomater Sci, 2015, 3(7): 923–936.
[53] Hadinoto K, Sundaresan A, Cheow WS. Lipid-polymer hybrid nanoparticles as a new generation therapeutic delivery platform: a review. Eur J Pharm Biopharm, 2013, 85(3): 427–443.
[54] Shi J, Xiao Z, Votruba AR, et al. Differentially charged hollow core/shell lipid-polymer-lipid hybrid nanoparticles for small interfering RNA delivery. Angew Chem Int Ed Engl, 2011, 50(31): 7027–7031.
[55] Desai PR, Marepally S, Patel AR, et al. Topical delivery of anti-TNFα siRNA and capsaicin via novel lipid-polymer hybrid nanoparticles efficiently inhibits skin inflammation. J Control Release, 2013, 170(1): 51–63.
[56] Barnaby SN, Sita TL, Petrosko SH, et al. Therapeutic applications of spherical nucleic acids. Cancer Treat Res, 2015, 166: 23–50.
[57] Li H, Zhang BH, Lu XG, et al. Molecular spherical nucleic acids. Proc Natl Acad Sci USA, 2018, 115(17): 4340–4344.
[58] Dan Z, Giljohann DA, Chen DL, et al. Topical delivery of siRNA-based spherical nucleic acid nanoparticle conjugates for gene regulation. Proc Natl Acad Sci USA, 2012, 109(30): 11975–11980.
[59] Randeria PS, Seeger MA, Wang XQ, et al. siRNA-based spherical nucleic acids reverse impaired wound healing in diabetic mice by ganglioside GM3 synthase knockdown. Proc Natl Acad Sci USA, 2015, 112(18): 5573–5578.
[60] Nemati H, Ghahramani MH, Faridi-Majidi R, et al. Using siRNA-based spherical nucleic acid nanoparticle conjugates for gene regulation in psoriasis. J Control Release, 2017, 268: 259–268.
[61] Cha W, Fan R, Miao Y, et al. Mesoporous silica nanoparticles as carriers for intracellular delivery of nucleic acids and subsequent therapeutic applications. Molecules, 2017, 22(5).
[62] Lio DCS, Liu C, Oo MMS, et al. Transdermal delivery of small interfering RNAs with topically applied mesoporous silica nanoparticles for facile skin cancer treatment. Nanoscale, 2019, 11(36): 17041–17051.
[63] Yu M, Han SC, Kou ZG, et al. Lipid nanoparticle-based co-delivery of epirubicin and BCL-2 siRNA for enhanced intracellular drug release and reversing multidrug resistance. Artif Cells Nanomed Biotechnol, 2018, 46(2): 323–332.
[64] Mukherjee A, Waters AK, Kalyan P, et al. Lipid-polymer hybrid nanoparticles as a next-generation drug delivery platform: state of the art, emerging technologies, and perspectives. Int J Nanomedicine, 2019, 14: 1937–1952.
Research progress in transdermal delivery for small interfering RNA
Yu Chen1, Nuo Xu1, and Zhenlin Hu2
1,,325035,,Institute of Life SciencesWenzhou UniversityWenzhouZhejiangChina
Small interfering RNA (siRNA) has been used to treat various skin diseases. However, siRNA is limited in application due to its electronegativity, strong polarity, easy degradation by nuclease and difficulty in breaking through the skin barrier. Therefore, safe and efficient siRNA delivery vector is the premise of effective treatment of skin diseases by siRNA. In recent years, with the deepening of research on siRNA, great progress has been made in the development of delivery systems based on lipids, polymers, peptides and nanoparticles, some new transdermal delivery vectors of siRNA have emerged, such as liposomes, dendrimers, cell penetrating peptides, and spherical nucleic acid nanoparticles. This review will focus on the recent advance in siRNA transdermal delivery vectors.
RNA interference,small interfering RNA, delivery vector, skin diseases, lipidosome, polymers, nanoparticles
June12, 2019;
November11, 2019
Zhenlin Hu. Tel: +86-577-86591693;E-mail: zhenlinhu@hotmail.com
10.13345/j.cjb.190246
2019-11-21
http://kns.cnki.net/kcms/detail/11.1998.Q.20191120.1611.001.html
陈毓,许诺,胡振林.小干扰RNA透皮递送策略研究进展. 生物工程学报, 2020, 36(4): 622–631.
Chen Y, Xu N, Hu ZL. Research progress in transdermal delivery for small interfering RNA. Chin J Biotech, 2020, 36(4): 622–631.
(本文责编 郝丽芳)

