BDE-28对斑马鱼核受体介导的内分泌干扰效应研究
宋静文,靳亚茹,刘红玲
南京大学环境学院,污染控制与资源化研究国家重点实验室,南京 210023
2,4,4’-三溴联苯醚(2,4,4’-tribromodiphenyl ether, BDE-28)作为高溴代多溴联苯醚(PBDEs)代谢中间产物之一[1],曾在长江三角洲沉积物中PBDE类物质中检出相对丰度最高(14%),超过了2,2’,4,4’-四溴联苯醚(2,2’,4,4’-tetrabromodiphenyl ether, BDE-47)[2]。BDE-28等低溴代联苯醚还曾在我国海产品中检出并且含量相对较高[3]。在长江下游的16种水生生物群包括蟹类、虾类以及各种鱼类的样本均检测到BDE-28的存在,占所有检出的PBDEs比例相对较高(10.9%),这大大超过了国外的检出频次和浓度[4]。BDE-28在水环境中的广泛检出使其可能对水生生物造成潜在危害,应该引起重视。
PBDEs的发育毒性和核受体介导内分泌干扰效应已在啮齿类动物和水生脊椎动物中得到了广泛的研究,这些研究主要侧重在高溴代同系物如BDE-47和BDE-99等,相比较之下低溴代的BDE-28的研究则较少,但是BDE-28同样会对一些水生生物甚至人类健康产生有害影响。例如有研究发现,BDE-28会导致斑马鱼胚胎发育异常并且对人类婴幼儿的神经发育功能也有负面效应[5-6],有研究表明,在非洲绿猴肾细胞(CV-1)中BDE-28(100 nmol·L-1)可增强三碘甲状腺氨酸(T3)诱导甲状腺激素受体β(trβ)的激活,但对甲状腺激素受体α(trα)的激活没有增强作用[7]。此外,已有文献报道人类体内甲状腺激素(TH)浓度与体内BDE-28浓度相关[8]。然而,到目前为止关于BDE-28在鱼类等水生脊椎动物体内与核受体相互作用的研究较少,所以本文选择斑马鱼为模式生物,对其8个重要受体(包括雄激素受体(AR)、甲状腺激素受体(TR)、芳香烃受体(AhR)、雌激素受体(ER)、糖皮质激素受体(GR)、孕烷X受体(PXR)、盐皮质激素受体(MR)、过氧化物酶体增殖物激活受体(PPAR))及其相关基因展开研究。结合计算模拟方法来研究BDE-28对斑马鱼幼鱼的作用,通过分子对接研究BDE-28是否能与核受体的配体结合域(ligand-binding domain, LBD)结合,进行分子动力学模拟,进一步研究BDE-28与斑马鱼相关核受体之间的相互作用。
1 材料与方法 (Materials and methods)
1.1 实验材料
BDE-28(纯度>99.2%),购自美国AccStandard公司;二甲基亚砜(dimethyl sulfoxide, DMSO)分析纯,购自上海捷瑞生物工程有限公司,作助溶剂;RNA抽提试剂盒(RNeasy®Mini Kit)购于Qiagen公司;cDNA逆转录试剂盒(Omniscript RT Kit)购自Thermo公司;实时定量PCR试剂盒(SYBR®Real time PCR Master Mix Plus Kits)购自日本Toyobo公司。
1.2 斑马鱼胚胎收集及暴露实验[9]
AB型成年斑马鱼(7月龄)在斑马鱼半自动养殖系统中培养,胚胎收集和暴露参照以前实验[9]。简要叙述如下:将BDE-28的DMSO母液梯度稀释成系列暴露液(2、20和200 μg·L-1),DMSO不超过暴露液体积的0.1%。将胚胎(4 hpf)进行3个浓度3个平行暴露并配制0.1%的DMSO为对照。在120 hpf对斑马鱼幼鱼取样,用RNAlater试剂固定样品,贮存于-20 ℃低温冰箱中备用。
1.3 定量实时聚合酶链式反应(q-RT-PCR)实验[10]
使用RNA抽提试剂盒提取各浓度组培养的斑马鱼幼鱼样品的总RNA,然后逆转录成cDNA。最后使用SYBR实时定量PCR试剂盒对逆转录后的cDNA进行靶基因的扩增和测定。q-RT-PCR反应条件为:95 ℃变性10 min并扩增至40个循环,之后降温到60 ℃保持60 s。以持家基因18S rRNA作为mRNA的表达内参,基因表达的变化用空白对照组进行标准化并通过2-ΔΔCT方法计算。采用Graphpad Prism 7软件使用单因素方差分析(ANOVA)方法并随后通过多重比较Tukey检验方法分析实验组与对照组基因调控倍数之间的显著性差异,当P<0.05时表示存在显著性差异。
1.4 结构模型准备
在ChemDraw内构建BDE-28的分子结构,利用Sybyl 7.3软件赋予BDE-28分子Gasteiger-Hückel电荷[11]和Tripos分子力场[12]并使其能量最小化,选择Powell方法设置1 000次迭代,使化合物的能量收敛到0.01 kcal·(mol·nm)-1。优化后的化合物结构作为后续分子对接的初始结构。从Uniport网站(www.uniport.org)下载斑马鱼核受体氨基酸序列信息,选择具有一致性且无断链的结构作为模板,在SwissModel工作站(http://swissmodel.expasy.org/workspace/)通过同源模建方法,构建斑马鱼LBD域的初始形态[13]。
1.5 核受体通路的构建
根据之前的研究构建8种核受体相关通路[14]。对于与AhR和ER通路相关的基因,利用安捷伦文献检索软件,在Cytoscape软件v3.1.1中构建生物相互作用网络[15]。其他6个核受体通路的基因网络通过WikiPathways网站(http://www.wikipathways.org/)和SABioscien-ce基因网络中心(http://www.sabiosciences.com/genenetwork/genenetworkcentral.php)检索获取,并与AhR和ER通路整合关联,通过Cytoscope将其可视化为一个基因网络。在这个网络通路只显示出被研究的基因,根据不同浓度中基因表达的显著调控倍数,用Cytoscape中的Enhanced Graphics模块对生成的网络基因(节点)进行着色。
1.6 分子动力学模拟
利用Sybyl 7.3软件的Surflex-Dock模块将能量最小化的BDE-28小分子对接进斑马鱼受体LBD域。在分子对接中,采用Automatic模式搜索对接口袋,其中阈值(Threshold)和膨胀系数(Bloat)分别设置为0.5和0(默认值)[16]。通过分子对接得到配体的10个对接构象,选取打分值最高的构象作为活性构象并将之与受体结合组成复合物,在南京大学计算机中心的刀片式服务器上用Gromacs-5.1.4软件包进行分子动力学模拟。在模拟过程中对受体分子赋予CHARMM27力场,配体小分子的力场参数使用SwissParam平台(http://www.swissparam.ch/)处理。以距离蛋白质-小分子配体表面至少2 nm构建盒子,填充TIP3P水分子,即蛋白质与溶剂边缘至少有1 nm,并加入Na离子或Cl离子以平衡体系电荷。在进行动力学模拟前,系统先经受5 000步的能量最小化。然后进行2个阶段平衡:以NVT和NPT来平衡系统。每个系统在NVT系综中被模拟为500皮秒(ps),在能量最小化的情况下从0到300 K逐渐加热,并且在NPT系统中保持300 K平衡500 ps。模拟中利用Particle Mesh Ewald(PME)算法计算电相互作用,范德华力以1 nm截断半径。最后进行10 ns的MD模拟,所有模拟步长设置为2飞秒(fs),并每2 ps记录一次运动轨迹[17]。利用OriginLab软件对骨架原子的均方根偏差(root-means-square deviation, RMSD)进行分析。
2 结果(Results)
2.1 BDE-28对斑马鱼关键核受体通路调控的影响
根据之前的研究[14],八大受体中心基因网络中涉及41个基因。转录结果表明,斑马鱼胚胎暴露于BDE-28后导致AR、TR和AhR及相关基因发生显著性下调,而ER及相关基因表达发生显著性上调。
如图1和图2所示,暴露在2、20和200 μg·L-1的BDE-28下的AR(ar)基因分别显著下调,下调倍数为3.03、2.64和10.10,与AR相关的增殖相关蛋白基因2G4-b(pa2g4b)、β-连环蛋白(ctnnb1)只在200 μg·L-1的BDE-28处理下发生显著下调,且下调倍数分别为3.30和4.43,在较低浓度(2、20 μg·L-1)下这些基因的表达没有明显变化。然而,增殖相关蛋白2G4-a(pa2g4a)基因在3个暴露浓度下都发生了显著下调,在由低到高暴露浓度(2、20和200 μg·L-1)下的下调倍数分别为3.77、2.58和2.01。核受体共激活因子4(ncoa4)基因在2、20和200 μg·L-13种浓度下的下调倍数分别为4.81、3.42和5.68。斑马鱼幼鱼trα基因在2、20和200 μg·L-1暴露下的下调倍数分别为2.21、2.18和2.31,与TR相关的核受体共抑制因子2(ncor2)基因也在低中高3种暴露浓度下下调,下调倍数分别为4.23、3.93和14.69。
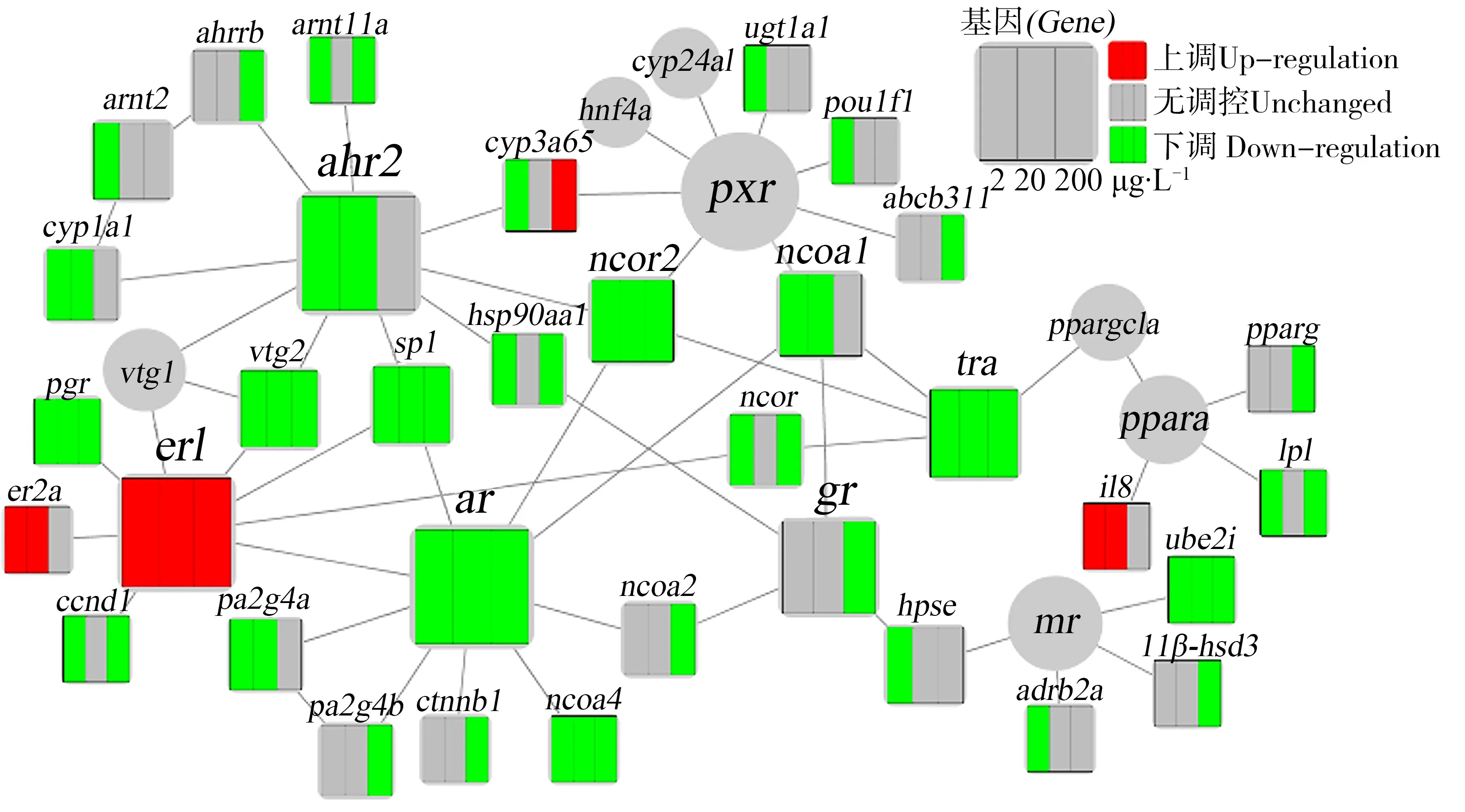
图1 斑马鱼中8个受体通路相关基因相互作用的网络关系图和BDE-28暴露对基因表达的影响注:每个节点代表一个基因,连线代表蛋白和蛋白或蛋白和DNA的相互作用关系;红色代表基因显著上调(P<0.05),而绿色代表基因显著下调(P<0.05)。Fig. 1 Interaction network shows the relationship among genes associated with eight receptor pathways of zebrafish and the expression of these genes after exposure to BDE-28Note: Nodes represent single genes, and edges indicate either protein-protein or protein-DNA interactions; the red color represents significant up-regulation (P<0.05) and the green color represents significant down-regulation of genes (P<0.05).

图2 8个核受体通路的基因表达情况火山图注:虚线X=-1左侧和X=1右侧的点分别代表下调倍数为2以上和上调倍数为2以上的基因;虚线Y=1.30以上的点表示基因表达量与对照组有显著性差异(P<0.05);AR表示雄激素受体,TR表示甲状腺激素受体,AhR表示芳香烃受体,ER表示雌激素受体,GR表示糖皮质激素受体,PXR表示孕烷X受体,MR表示盐皮质激素受体,PPARα表示过氧化物酶体增殖物激活受体。Fig. 2 Volcano plot of gene expression profiles in each nuclear receptor pathwayNote: The dotted lines on the left of X=-1 and on the right of X=1 represent genes that are down-regulated by more than 2-fold and up-regulated by more than 2-fold, respectively; points above the dotted line Y=1.30 indicate significance (P<0.05); AR stands for androgen receptor; TR stands for thyroid hormone receptor; AhR stands for aryl hydrocarbon receptor; ER stands for estrogen receptor; GR stands for glucocorticoid receptor; PXR stands for pregnane X receptor; MR stands for mineralocorticoid receptor; PPARα stands for peroxisome proliferator activated receptor.
此外,斑马鱼AhR与其调控的相关基因也发生了显著变化(图1和图2)。芳香烃受体基因(ahr2)和细胞色素P4501a1(cyp1a1)在暴露于2和20 μg·L-1的BDE-28之后显著下调,下调倍数分别为12.65、9.23和8.33、4.35,而在最高浓度下两者都没有显著变化。芳香烃受体核转位蛋白2(arnt2)和芳香烃受体抑制因子b(ahrrb)分别只在最低浓度和最高浓度下下调,下调倍数为2.19和3.50,而在其他暴露浓度无显著变化。雌激素受体(er1)基因在3个暴露浓度下都发生了显著上调,在由低到高浓度下的上调倍数分别为12.29、12.67和15.87。雌激素受体(er2a)基因在2和20 μg·L-1的BDE-28下的上调倍数分别为10.83和17.19,但在最高浓度下其调控水平没有受到影响。相反,er1的下游基因孕酮受体基因(pgr)和卵黄蛋白原2(vtg2)在2、20和200 μg·L-1相较于对照组显著下调,倍数分别为3.29、2.55、3.45与4.98、3.36、3.24。BDE-28的基因影响不呈剂量效应关系。除此之外,暴露在浓度为200 μg·L-1的BDE-28下使斑马鱼GR显著下调,倍数为17.05,较低浓度下没有观察到下调现象。3种暴露浓度下没有发现PXR、MR和PPAR核心受体调控有显著的变化。
2.2 BDE-28与核受体的对接和分子动力学模拟
图3显示了经拉氏图验证模建的蛋白结构良好。将BDE-28与AR、TR、AhR和ER这4个受显著影响的核受体进行分子对接及分子动力学模拟研究。对接结果显示,BDE-28成功地与斑马鱼AR、TR、AhR和ER的LBD域对接。进一步进行分子动力学模拟来观察斑马鱼AR、TR、AhR和ER受体和配体结合的动态过程,模拟时间为10 ns。5 ns之后,4个受体-配体复合物趋于稳定,复合物RMSD在5 ns后平均波动小于0.2 nm(图4)。对于AR,其H12链在5 ns之后保持稳定(图4),H12链呈现“鼠夹”现象(图5)。在动力学模拟过程中,配体和受体复合物出现“鼠夹”现象时,化合物可以被初步判断为有活性。从图6(a)可以看到,BDE-28在受体口袋中被PHE764、MET749、MET787、MET745、MET42、LEU873、LEU704、PHE876、MET780、LEU880和VAL889氨基酸残基包围并通过和这些氨基酸残基形成疏水键与AR稳定的结合。
分子对接模拟的结果同样也表明,BDE-28能够与斑马鱼TR、AhR和ER快速稳定地结合。比如TR(图6(b)),BDE-28位于对接口袋的中心且稳定地保留在结合位点上,一个苯环位于残基ALA266、LEU277、LEU290、ILE302和LEU279形成的疏水区域中,另一个苯环位于残基ILE225、PHE408、LEU295、PHE404、PHE218、PHE221和PHE388形成的疏水区域中,这些氨基酸残基与配体的苯环和Br原子形成疏水键。此外,BDE-28的氧原子还与氨基酸残基HIS384形成氢键(键长0.2816 nm),这表明,BDE-28能在核受体LBD域内稳定地与受体蛋白结合并且发生相互作用。TR与BDE-28复合物的RMSD的波动数值在5 ns之后小于0.2 nm(图4),表明配体-受体复合物已经趋于稳定。此外,BDE-28与AhR和ER的动力学模拟结果如图4和图6(c)和(d)所示,且BDE-28与AhR和ER只存在疏水相互作用,没有氢键生成。
3 讨论(Discussion)
暴露于2、20和200 μg·L-1的BDE-28主要改变了4个核受体(AR、TR、AhR和ER)信号通路的基因表达,其中,AR和TR信号通路受影响最大。在3种浓度BDE-28处理下斑马鱼幼鱼AR和ncoa4表达均显著下调,说明BDE-28是一种AR拮抗剂,并可能干扰鱼类体内的睾丸素产生[18]。在最高浓度下pa2g4b和ctnnb1以及ncoa2基因明显下调,低中浓度下pa2g4a基因表达下调,这可能干扰了斑马鱼的生长调节信号。之前有毒性研究发现,BDE-28会对斑马鱼幼鱼的生长发育造成影响[5]。作为BDE-47在鱼类体内的代谢产物,BDE-28结构式与母体化合物相差一个Br原子,这可能使BDE-28在干扰生物体内生殖激素的分泌及信号通路传导方面有相似的作用,从而影响有机体的生殖与发育功能。研究表明,BDE-47可与AR产生拮抗作用[19-20]。与BDE-47观察到的效应类似,BDE-28主要抑制了ctnnb1和ncoa4的表达。ctnnb1作为Wnt信号通路的细胞内信号传感器,可以直接结合转录因子并作用于早期胚胎,在身体一些发育过程中起核心作用[21]。睾丸中共激活因子ncoa4的表达可以调节AR对精子形成的调控,精子形成是一个雄激素与AR相互依赖的过程。有研究显示,男性体内精子数量、睾丸功能和睾丸大小均和体内的PBDEs含量相关[22]。之前有研究表明,BDE-47可减少日本青鳉鱼体内精子浓度[23];最近也有研究表明,暴露在室内灰尘中的BDE-28可能会影响人类男性精液质量[24]。本研究结果表明,BDE-28也可能通过AR介导对斑马鱼产生内分泌干扰作用。
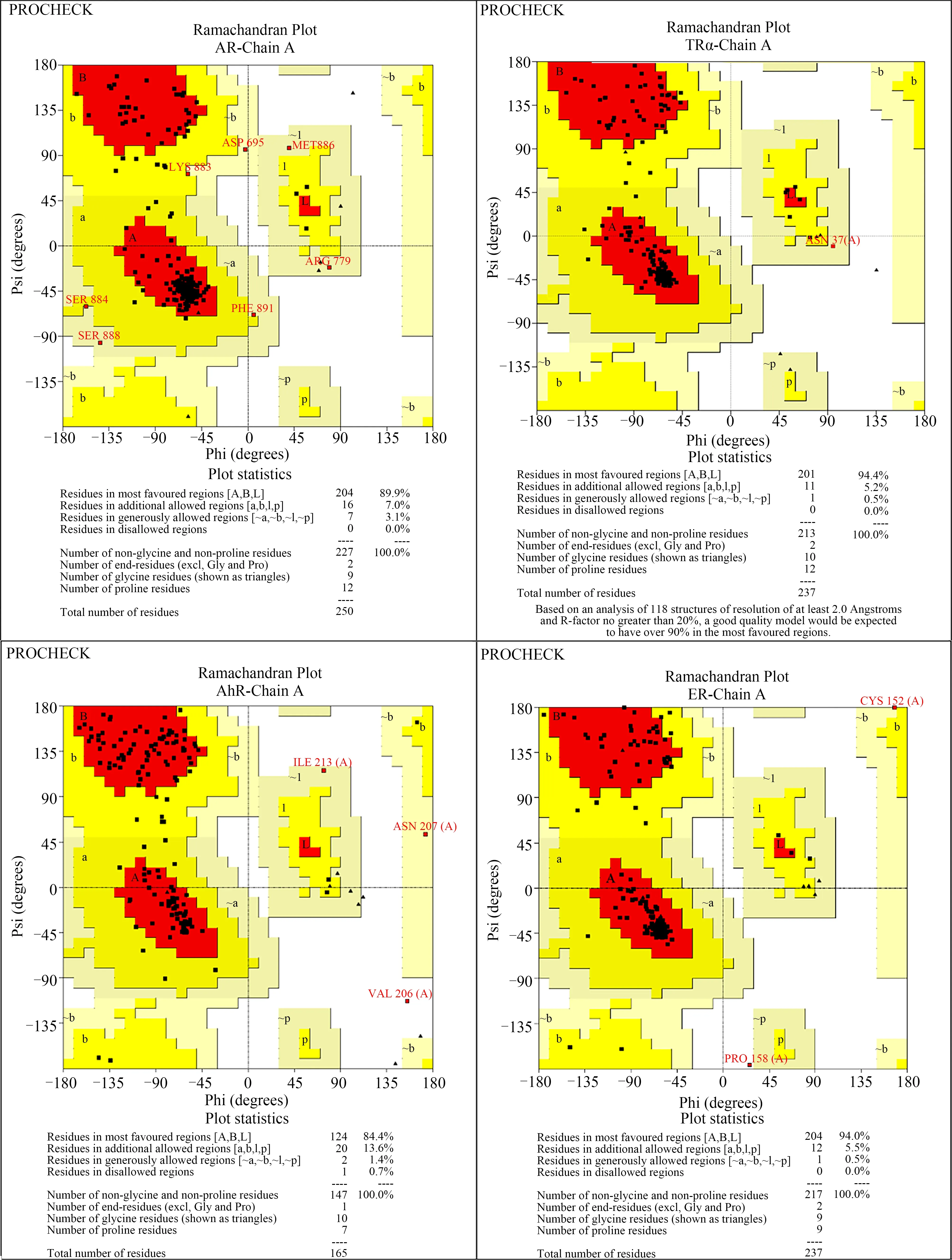
图3 模建斑马鱼核受体配体结合域(LBD)的拉氏图Fig. 3 Ramachandran plot of modeled zebrafish nuclear receptors (NRs) ligand-binding domain (LBD)

图4 骨架原子(AR)的H12链以及受体配体复合物的均方根偏差(RMSD)注:RMSD波动在5 ns之后<0.2 nm。Fig. 4 The root mean square deviation (RMSD) for backbone atoms of H12 (AR) and receptor-ligand complexNote: The relative fluctuations of complex is less than 0.2 nm after 5 ns.

图5 雄激素受体出现的“鼠夹”机制Fig. 5 The “mousetrap” mechanism of androgen receptor
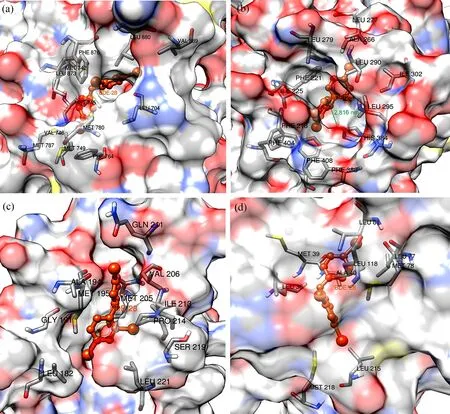
图6 斑马鱼(a)AR、(b)TR、(c)AhR、(d)ER核受体结合位点的关键氨基酸残基注:红色组分代表化合物BDE-28,绿线代表氢键。Fig. 6 The key amino acids residue of the nuclear receptor binding sites of zebrafish (a) AR, (b) TR, (c) AhR and (d) ERNote: The red component represents compound BDE-28, and green line is hydrogen bonds.
有研究表明BDE-28会影响人体内的甲状腺功能[25],另有研究证明孕妇体内血清中的BDE-28浓度与TH水平呈负相关[26]。而从本研究结果可以看出,斑马鱼经过BDE-28暴露后trα受到影响,明显下调,这说明BDE-28可能会作用于TR。从图1可以看出,ncor2在3个浓度下都显著下调,其作为一种核受体共抑制因子同时也是一种转录相关调节蛋白,包含多个与核受体相互作用域,已被证明和TR、AR有相互作用[27]。此外,ncor2有将组蛋白脱乙酰基酶招募到DNA启动子区域的功能,并协助核受体下调靶基因表达[28]。TR对三碘甲腺原氨酸(T3)和甲状腺素(T4)是高亲和力受体,它影响到身体生理发育的几乎每一个过程,包括生长、代谢、体温和心率等[29]。此前对斑马鱼的研究表明,在BDE-47暴露后T4含量显著下降而T3含量显著上升[30]。BDE-28可能由于其结构与BDE-47相似,影响了与TR及相关的基因表达,改变了斑马鱼TH水平,显示BDE-28可能会造成斑马鱼的甲状腺功能紊乱。
此外,BDE-28对斑马鱼ahr2的影响呈非剂量效应关系,rhrrb和arnt2分别只在最高和最低浓度下有显著下调,这可能是由于斑马鱼早期生命阶段有着更高的敏感性。雌激素受体er1和er2a显著上调,之前也有学者研究仓鼠卵巢细胞发现,BDE-28在er1和er2a检测中表现出激动活性[31]。然而,vtg2基因却在3个浓度下明显下调。卵黄蛋白原是卵黄的前体蛋白,可与脂类、磷酸盐、糖和金属离子结合,为卵黄生物胚胎发育提供必需的营养和能量,卵黄蛋白原基因(vtgs)的诱导表达被看作卵生脊椎和无脊椎动物暴露于类雌激素物质的分子生物标志物。这些结果说明,AhR-ER“串扰”作用的机制十分复杂,因此,在评估环境污染物的雌激素效应的过程中,对BDE-28通过影响ER产生的内分泌干扰效应有待更多的实验数据去支持验证。在本研究中,斑马鱼GR只在200 μg·L-1的BDE-28浓度下下调,显示BDE-28引起的内分泌干扰效应可能涉及到GR信号通路。
本研究过程通过分子对接和分子动力学模拟来证实体内实验AR、TR、AhR和ER分析的结果。由于目前斑马鱼受体的晶体结构尚未被解析,因此使用同源建模来构建斑马鱼AR、TR、AhR和ER的LBD域初始形态。分子动力学研究中,通过观察AR的H12链和4个受体与BDE-28复合物的稳定性,以及配体在受体活性位点部位与关键氨基酸残基成键作用,显示BDE-28可以稳定地与这些受体相互作用。核受体通路上相关基因调控变化的实验结果表明,BDE-28可能是斑马鱼AR、TR、AhR的拮抗剂和ER的激动剂。该研究手段可以为众多污染物的内分泌干扰效应筛查提供借鉴,研究结果可为BDE-28的风险管控提供毒理信息。

