超声破碎和胰蛋白酶酶解奶牛胎盘制备还原性多肽方法的建立与优化
沈留红 朱颍琨 张 钺 尤留超 钱柏霖 石 湉 董 可 张帅杰 吴禹熹 余树民 曹随忠 王 娅*
(1.四川农业大学 动物医学院/动物疫病与人类健康四川省重点实验室/奶牛疾病研究中心,成都 611130;2.成都市动物疫病预防控制中心,成都 611130;3.四川育强本草生物技术有限公司,成都 611130)
胎盘组织含有激素、免疫球蛋白、多肽、环肽、甾体、胶原蛋白和多种氨基酸等大量生物活性成分[1-2],具有抗氧化、抗疲劳和促进恢复等作用[3],广泛用于治疗慢性疾病[4-6]。中医临床传统利用方法是采集新鲜胎盘,蒸煮干燥后碾碎入药。也有研究通过改变蒸煮条件,增加炮制材料等方式有效提高胎盘制品生物学活性和总物质含量[7]。多肽是目前胎盘成分研究的热点之一,猪、牛、羊和鹿等动物胎盘组织均含有或可提取多种具有抗癌、抗氧化和免疫调节活性等功能的多肽分子[8-12]。酶解法可获得成分和种类较为明晰,作用方式相对确定的活性多肽[8,13-15]。目前酶解工艺的优化多针对于提升活性,但未必可取得较高提取率[16-17]。因此,为有效利用酶解产物,需对其提取率和活性进行综合优化。奶牛胎盘是奶牛分娩后副产物,其含有多种天然生物活性多肽[18],来源广泛,因酶解制备奶牛胎盘多肽技术尚未成熟多被直接丢弃。因此,本研究拟通过超声破碎法和胰蛋白酶酶解法提取奶牛胎盘还原性多肽,分析各因素对胎盘还原性多肽制备中提取率和还原力的影响,建立奶牛胎盘还原性多肽的最佳提取方法,并以综合提取率作为响应值对各因素水平进一步优化,以期同时获得具有较高还原活性和提取率的奶牛胎盘多肽,为其临床开发应用奠定基础。
1 材料与方法
1.1 试验材料
选择四川省某规模化奶牛场半封闭统一舍饲,体重600 kg左右,2~4胎,体况良好、妊娠足月、自然分娩的健康中国荷斯坦奶牛新鲜胎盘组织,立即使用生理盐水清洗,除去胎盘内残留血液及污物,至胎盘子叶呈粉红色后,于-20 ℃冷冻保存。
1.2 试验试剂及仪器
XC-CDS650超声细胞破碎仪(宁波先倡电子科技有限公司);HH-4数显恒温水浴锅(常州国华电器有限公司);LYOQUEST 冷冻干燥机(阿自倍尔泰事达机电设备上海有限公司);SorvallTMLegendTMXT冷冻离心机、Varioskan LUX全波长多功能酶标仪、BarnsteadTMGenPureTMPro 超纯水机(赛默飞世尔科技中国有限公司)。
胰蛋白酶(250 u/mg,生产批号920T041,索莱宝生物科技有限公司);磷酸二氢钾(KH2PO4)、磷酸二氢钠(NaH2PO4)、三氯乙酸(Cl3COOH)、三氯化铁(FeCl3)、铁氰化钾(K3[Fe(CN)6])、维生素C(VitC)等(均为分析纯,成都科隆化学品有限公司)。
1.3 试验方法
1.3.1奶牛胎盘组织预处理
将冷冻保存的奶牛胎盘组织切割,称量后置于由封口膜密闭烧杯中以免质量损失,37 ℃水浴复温融化,剪刀初步剪碎胎盘组织,为保证其原有分子不致因组织匀浆机产热而分解[19],在冰浴条件下使用组织匀浆机以12 000 r/min破碎至无明显组织碎块。
1.3.2超声破碎法制备奶牛胎盘多肽
冰浴条件下,选择匀浆浓度(50%、40%、30%,M底物∶M总)、超声功率(900、1 350、1 800 W)和破碎时间(2.50、5.00、7.50 min)为因素[20],基于L934正交表对1.3.1所制备匀浆进行超声破碎后,以 6 000 r/min 离心5 min,收集上清,冷冻干燥24 h,所得冻干粉即奶牛胎盘多肽,称量并计算提取率RE(RE=(冻干粉回收质量/胎盘组织匀浆质量)×100%。
1.3.3酶解法制备奶牛胎盘多肽
参照胰蛋白酶(Trypsin)说明书所述最适条件(37 ℃,pH=8.0)以1.3.1所制备匀浆为底物酶解,酶解后沸水浴10 min灭活。将酶解液以 6 000 r/min 离心5 min,收集上清,冷冻干燥24 h,称量冻干粉质量并计算提取率RE。
以Design expert 8.0.6软件,基于Box-Behenken中心响应法设计响应面试验,以酶解时间、底物浓度(M底物∶M总)和酶底质量比(酶底比,M酶∶M底物)为自变量,做三因素三水平共17个试验点,包括5个中心点和12个析因点。参考山羊胎盘酶解条件设计试验[21, 22],分别对各因素编码:记酶解时间(h),底物浓度和酶底比为因素A、B和C,酶解时间3.00、5.00、7.00 h;底物浓度10.00%、30.00%、50.00%;酶底比1.00%、3.00%、5.00%分别对应A、B、C因素水平为-1、0、1。
1.3.4普鲁士蓝法标准曲线的建立及奶牛胎盘多肽还原能力测定
参照参考文献[23],分别将VitC配制为100.000、50.000、25.000、12.500、6.250、3.125 μg/mL标准溶液;另配制10.0%三氯乙酸溶液、10.0%铁氰化钾溶液、0.1%三氯化铁溶液和pH 6.6磷酸盐缓冲液。分别向75 μL各浓度VitC标准溶液先后加入75 μL pH 6.6磷酸缓冲液和1.0%铁氰化钾溶液,充分震荡后50 ℃水浴20 min,加入75 μL 10%三氯乙酸溶液,3 000 r/min离心1 min,制得待测液。取200 μL待测液置于96孔板中,加入 20 μL 0.1%三氯化铁溶液,测定其A700。以标准溶液VitC浓度为横坐标,以A700为纵坐标,使用SPSS 24.0以线性回归方式建立标准曲线。
将胎盘冻干粉用pH 6.6磷酸盐缓冲液稀释为1.0 mg/mL待测液,后续操作同上,测定A700后将其代入标准曲线以获得待测液相当的VitC溶液浓度,记为VitC当量(μg/mg)。
1.4 数据分析与处理
分别以提取率和还原力为响应值,应用 Design 8.0.6 以酶解时间、底物浓度和酶底比为因素建立响应面回归模型,并验证其拟合度和可靠性。
1.5 奶牛胎盘多肽高效提取方法的建立及优化
基于响应面模型,分析各因素对提取率和还原力的影响,依照模型所确定的最优化条件进行平行试验(重复6次),并对实际结果和模型期望值进行对比以验证响应面模型有效性。
对所制备多肽提取率与还原力进行相关性分析,并以每克胎盘所提取多肽的还原能力作为综合提取率E(μg/g)。以E为响应值,建立响应面回归模型,分析其拟合度和可靠性后,基于该模型优化多肽制备条件,并进行平行试验(重复6次),以确认优化结果。
2 结果与分析
2.1 普鲁士蓝法标准曲线的建立
制备100.000、50.000、25.000、12.500、6.250和3.125 μg/mL的VitC标准溶液,使用普鲁士蓝法测得的A700为1.670、0.802、0.367、0.187、0.150和0.097。以VitC浓度为自变量,A700为因变量,使用SPSS 24.0进行线性回归分析,建立截距为0.008(SE=0.002 5),自变量因数为0.0164(SE=0.001)的线性回归模型,即:A700=0.016 4×VitC当量+0.008。相关系数为99.6%,预测效果可靠,标准曲线见图1。
2.2 不同超声破碎条件对奶牛胎盘多肽提取效果的影响
超声破碎法制备多肽的提取率测量和Vitc当量检测结果见表1,A、B和C三因素对提取率和Vitc当量的极差分别为0.18、0.26、0.37和0.54、0.85、3.16,表示三因素中,超声破碎时间对提取率的影响最大,超声功率次之,底物浓度最低。
2.3 不同胰蛋白酶酶解条件对制备奶牛胎盘多肽的影响
基于1.3.3所述试验方法对奶牛胎盘匀浆进行酶解,各酶解体系实际底物质量、加酶量、多肽回收量如表2所示。当A因素水平为-1,B因素水平为0,C因素水平为-1和1及A因素为-1,C因素0,B因素水平为-1和1时,提取率为3.15%、4.03%、4.65%和4.83%,VitC当量为14.82、34.96、11.22和17.83 μg/mg;A因素为0,B因素为-1,C因素水平为-1和1及A因素为0,B因素为1,C因素为-1和1时,提取率分别为3.20%、3.72%、3.03%和4.06%,Vitc当量分别为12.75、12.27、12.44和32.06 μg/mg;三因素均为0时,提取率分别为5.44%、5.50%、5.42%、5.47%和5.67%,VitC当量分别为38.50、36.17、35.24、37.78和38.45 μg/mg;A因素水平为1,B因素水平为0、C因素水平为-1和1,及A因素水平为1,C因素水平为0,B因素水平为-1和1时,提取率分别为3.83%、4.75%、4.89%和4.41%,VitC当量分别为36.42、29.95、11.82和29.87 μg/mg。

图1 维生素C的普鲁士蓝法标准曲线

表1 超声破碎法提取奶牛胎盘多肽正交试验结果
2.3.1不同胰蛋白酶酶解条件对奶牛胎盘多肽提取率的影响
对表2进行以提取率(RE)为响应值的响应面回归分析,所得二次回归方程为:
RE=5.50+0.15A+0.026B+0.38C-0.8AB-0.075AC+0.13BC-0.18A2-0.54B2-1.46C2
式中:A、B、C分别为1.3.3所编码的时间、底物浓度和酶底比。
方差分析结果发现响应面回归模型极显著(P<0.01),失拟项不显著(P>0.05)。模型R2与校正系数R2分别为98.85%与97.37%,即响应值有98.85%可能性与各因素相关,模型描述性较好。其中一次项A、C和二次项B2、C2均极显著影响响应值(P<0.01)。各因素对提取率影响力(F值)为C>A>B(表3)。

表2 胰蛋白酶酶解法制备奶牛胎盘多肽响应面试验结果
注:A、B和C为时间、底物浓度和酶底比。下同。
Note:A,BandCrepresent time, substrate concentration and enzyme-substrate weight ratio.The same below.
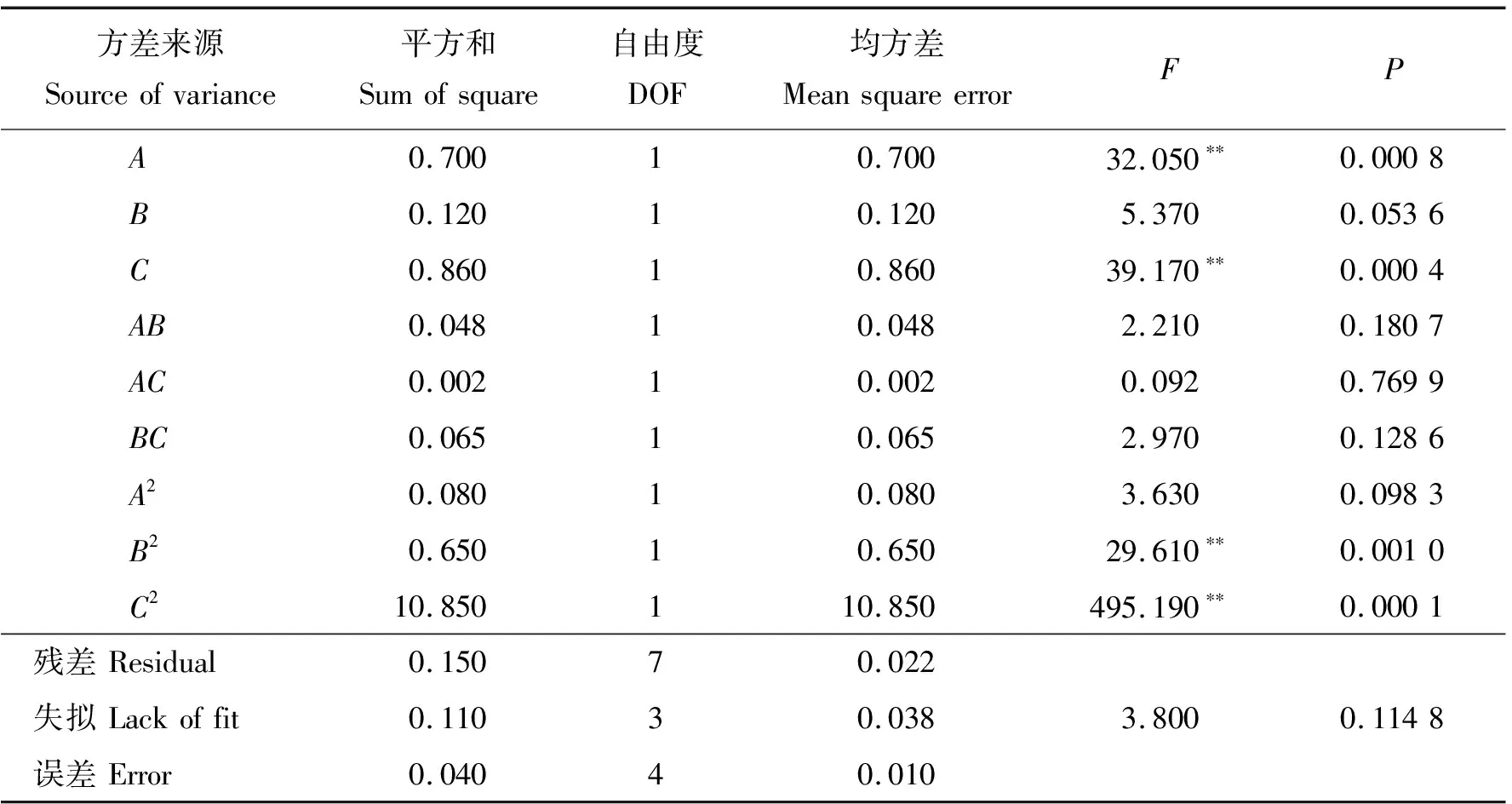
表3 以提取率为响应值的胰蛋白酶酶解奶牛胎盘的回归模型方差分析结果
注:*和**表示该因素对模型有显著和极显著影响,下同。
Note: *and**indicate that the factor has a significant effect and extreme significant effect on the model, respectively.The same below.
酶解结果的响应面曲线见图2:随酶解时间延长,提取率提升速度随之变缓,这说明奶牛胎盘组织几乎被完全酶解(图2(a));随底物浓度上升,同一反应时间的提取率随酶底比上升先上升后下降(图2(b));酶底比随酶底比上升,同一反应时间的提取率先上升后下降,但高酶底比组响应值仍高于低酶底比组,这表明酶解反应在试验区间内某一值达到了饱和,并可能伴有胰蛋白酶的自身酶解现象(图2(c))。
以最大化提取率为目标,获取胰蛋白酶酶解奶牛胎盘理论最佳条件为:反应时间5.78 h,底物浓度30.21%,酶底质量比3.24%,此时的理论提取率为5.55%。为验证模型有效性,以优化结果进行六次平行试验,实际试验条件为:反应时间5.75 h,底物浓度30.00%,酶底比3.00%,实测平均提取率为5.48%,与理论值接近且重复性较好,说明响应面优化结果可靠。
2.3.2不同胰蛋白酶酶解条件对奶牛胎盘多肽还原力的影响
对表2进行以VitC当量为响应值的回归分析,所得二次响应面回归方程为:
VitC当量=37.23+3.65A+5.53B+4.09C+2.88AB-6.67AC+5.02BC-3.94A2-5.58B2-4.27C2
式中:A、B、C分别为1.3.3所编码的时间、底物浓度和酶底比。
方差分析结果发现,响应面回归模型极显著(P<0.01),失拟项不显著(P>0.05)。模型R2与校正系数R2分别为99.14%与98.04%,模型描述性较好。一次项A、B、C,交互项AB、BC、AC,二次项A2、B2、C2因素均极显著影响响应值(P<0.01)。各因素对VitC当量影响力(F值)为B>C>A(表4)。

表4 以Vitc当量为响应值的胰蛋白酶酶解奶牛胎盘回归模型方差分析结果
酶解结果的响应面曲线见图3,酶解过程中随底物浓度提高,相同酶底比下响应值随时间先上升后下降(图3(a));随酶底比提高,相同酶解时间情况下,响应值呈现上升趋势,且底物浓度越高,响应值先上升后下降(图3(b));固定底物浓度时,酶底比与酶解时间的交互作用对响应值呈极显著负相关(P<0.01)(图3(c))。
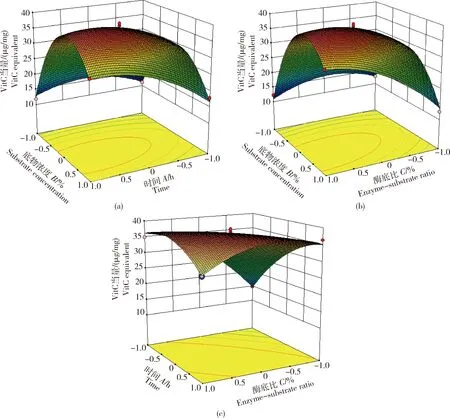
图3 各因素交互作用对胰蛋白酶酶解奶牛胎盘还原能力的影响
以最大化还原力为目标,获取胰蛋白酶酶解奶牛胎盘理论最佳条件为:反应时间5.13 h,底物浓度35.59%,酶底比4.19%,此时理论VitC当量为39.32 μg/mg。为验证模型有效性,以优化结果进行6次平行试验,实际试验条件为:反应时间5.20 h,底物浓度35.60%,酶底比4.20%,实测平均VitC当量为39.67 μg/mg,与理论值接近且重复性较好,说明响应面优化结果可靠。
2.4 奶牛胎盘还原性活性多肽提取方法的优化
2.4.1不同提取方法制备胎盘还原性多肽提取率与还原力的相关性分析
超声破碎法和胰蛋白酶酶解法提取率与VitC当量的相关性分别为0.785(P=0.012)和0.498(P=0.042)。表明超声破碎法和胰蛋白酶酶解奶牛胎盘制备多肽过程中,VitC当量和提取率均呈显著正相关(P<0.05),因奶牛胎盘组织多肽还原力受酶解条件的影响极显著(P<0.01),为同时获取较高提取率和还原力,需以综合提取率对酶解条件进一步优化。
2.4.2胰蛋白酶酶解奶牛胎盘制备还原性多肽的优化
以综合提取率(E)为响应值,对胰蛋白酶酶解法制备胎盘还原性多肽条件进一步优化。结果如下:在A因素水平为-1,B因素水平为0,C因素水平为-1和1,及A因素为-1,C因素为0,B因素为-1和1时,响应值分别为466.83、1 272.54、521.73和861.19 μg/g,A因素为0,B因素为1,C因素为-1和1,及A因素为0,B因素为-1,C因素为-1和1时,响应值分别为376.93、1 301.64、408.00和456.44 μg/g;三因素均为0时,响应值分别为1457.65、1 910.01、2 066.57、2 094.40和2 180.11 μg/g;A因素为1,B因素为0,C因素为 -1 和1时,及C因素为0,B因素为-1和1时响应值分别为1 394.89、1 317.27、578.00和1 612.63 μg/g。建立回归模型,所得二次响应面回归方程为:
E=1 941.75+222.56A+273.53B+212.66C+173.79AB-220.83AC+219.06BC-285.62A2-762.75B2-543.25C2
式中:A、B和C分别为1.3.3所编码的时间、底物浓度和酶底比。
方差分析结果发现,响应面回归模型极显著(P<0.01),失拟项不显著(P>0.05),模型R2为94.29%,校正系数R2为86.95%,模型描述性较好。模型的一次项A、B、C,二次项A2、B2、C2对奶牛胎盘酶解产物的综合提取率影响极显著(P<0.01)。各因素对提取率影响力(F值)为B>A>C(表5)。
固定酶底比情况下,高底物浓度时,响应值随酶解时间延长而上升(图4(a));固定酶解时间情况下,响应值随酶底比升高呈现出先上升后下降的趋势,且酶底比越高,底物浓度对响应值的影响越大(图4(b));底物浓度固定情况下,酶解时间较短时,酶底比越低响应值越低,随酶解时间延长,低酶底比组响应值上升,而高酶底比组响应值先上升后下降,(图4(c))。
以最大化综合提取率为目标,获取胰蛋白酶酶解奶牛胎盘理论最佳条件为:反应时间5.80 h,底物浓度34.96%(M底物∶M总),酶底比3.33%(M酶∶M底物),此时理论综合提取率为2 037.92 μg/g。为验证模型有效性,以优化结果进行6次平行试验,实际试验条件为:反应时间5.80 h,底物浓度35.00%,酶底比3.30%,实测平均VitC当量为2 040.00 μg/g,与理论值接近且重复性较好,说明响应面优化结果可靠。
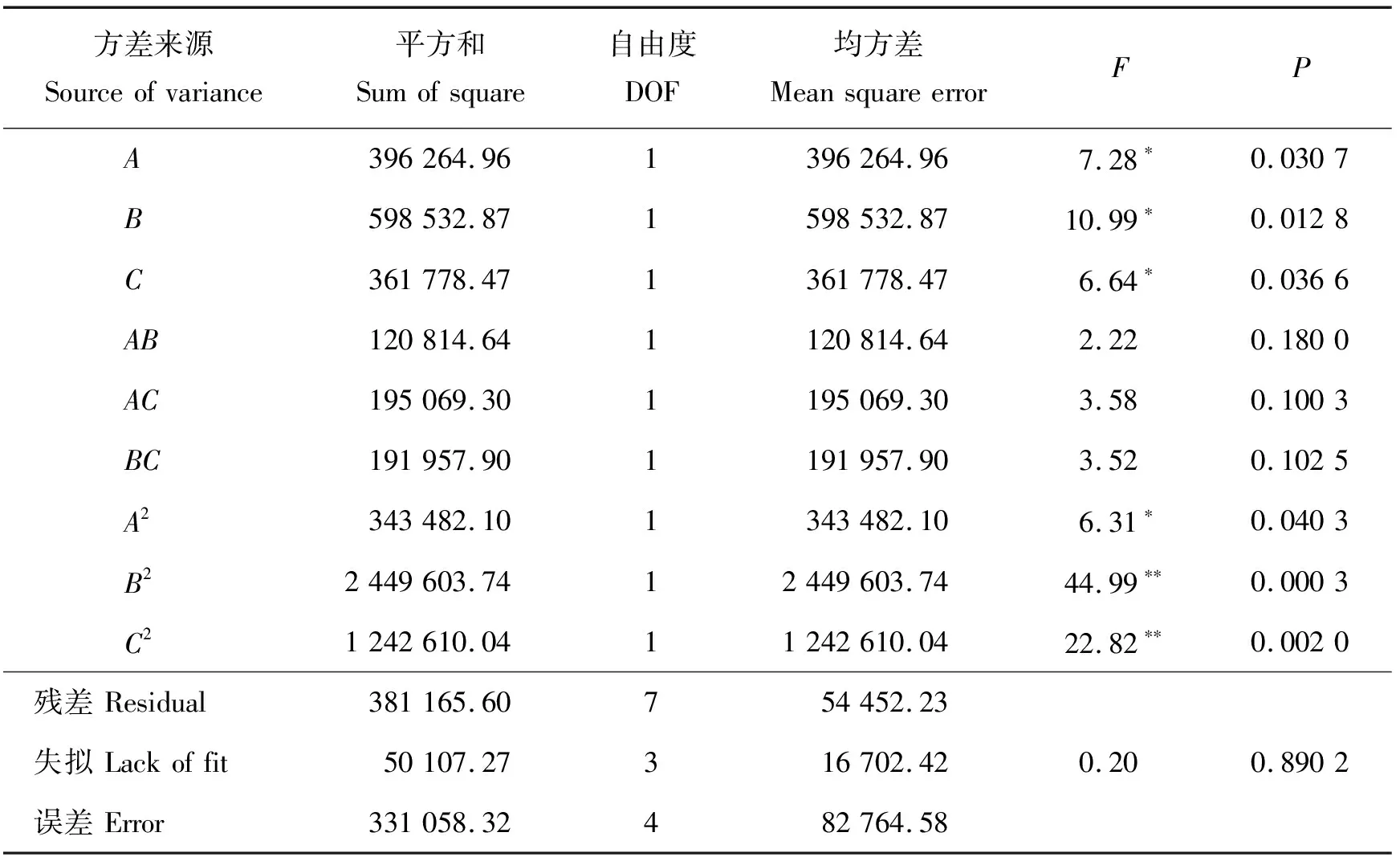
表5 以综合提取率为响应值的胰蛋白酶酶解胎盘试验回归模型方差分析结果
3 讨 论
3.1 不同条件超声破碎对奶牛胎盘组织还原性多肽制备的影响
超声破碎法是通过超声波激活液体中微小泡核,多次震荡后高速崩溃,将其所聚集的能量以高温、高压、高速空化微射流形式释放的方法[24],已被广泛用于提取生物活性分子(如可溶性多肽、多糖、酶、蛋白质和脂肪等)。研究报道超声破碎时间对提取率影响不显著,而超声破碎次数和破碎前溶剂浸泡时间对提取率影响更大[20,25]。然而,本试验结果表明超声破碎时间对提取率影响较大,可能由于本试验在匀浆化后立即进行超声破碎,即超声破碎和溶剂浸提同时发生,导致超声时间因素对提取效果的影响力更大。奶牛胎盘组织中成分复杂,可能被超声波释放的热量破坏[26],因此,本试验为保证奶牛胎盘组织成分稳定性,在冰浴条件下破碎,发现其最佳条件为底物浓度50.00%,功率1 800 W,破碎7.50 min,提取率为9.50 mg/g,VitC当量为2.91 μg/mg,与张维等[25]的结果相近。过高超声功率会导致样品中部分分子化学键产生断裂,易导致提取物生物活性改变[27],而本试验超声破碎法最高收率条件与最高还原性条件一致,均为匀浆浓度50.00%、超声功率1 800 W破碎7.50 min,且提取率与还原力呈显著正相关(P<0.05)。
3.2 不同胰蛋白酶酶解条件对奶牛胎盘组织还原性多肽制备的影响
胰蛋白酶是一种胃肠道消化酶,具有较强特异性,可切断肽链中赖氨酸和精氨酸残基羧基侧。胰蛋白酶的高度特异性,常用于酶解制备多肽。多种动植物组织的胰蛋白酶酶解产物均表现出较强的抗氧化活性[28-30]。胰蛋白酶对组织蛋白的酶解过程中,水解度与抗氧化能力并非呈正相关[17,31], 原因是天然蛋白质分子量大,结构复杂,在同一蛋白中可能存在多个酶切位点,随酶解进行,大分子蛋白被水解为较小肽段,而肽段亦可能被进一步酶解,导致生物活性多肽失活[32]。因此,水解度一般只用于酶解程度监测,不用于多肽活性评估。本试验为综合分析各因素对提取率和活性的影响,以响应面分析法设计试验[33],采用多元二次回归方程来拟合因素与响应值之间的函数关系,建立回归模型分析各因素及其之间的交互作用对试验结果的影响,并寻求最优酶解条件。模型方差分析表明:酶解时间和酶底比对胰蛋白酶法制备胎盘多肽的提取率具有极显著的影响(P<0.01);各因素及其交互作用均对胰蛋白酶法制备胎盘多肽的还原力有极显著影响(P<0.01)。响应面模型显示:以胰蛋白酶酶解奶牛胎盘制备还原性多肽在反应时间5.78 h,底物浓度30.21%,酶底比3.24%时,可获取最高理论提取率,为5.55%;在反应时间5.13 h,底物浓度35.59%,酶底比4.19%时,可获取最高理论VitC当量,为39.32 μg/mg。本研究结果均远高于超声破碎法的最高提取率(0.95%)和最高VitC当量(2.80 μg/mg)。本试验提取率随酶解时间上升趋势逐渐减缓,表明酶解物中可溶性多肽随酶解时间延长而增加,且设计时间内底物酶解较完全,与鞠兴荣等[30]对使用多种蛋白酶水解菜籽时水解曲线相符。与提取率不同,各因素及其交互作用对奶牛胎盘多肽还原力呈现复杂的影响,在反应时间 5.13 h,底物浓度35.59%,酶底比4.19%时获取最高理论VitC当量(39.32 μg/mg),且酶底比与酶解时间的交互作用对胎盘多肽还原能力呈现极显著负相关(P<0.01),表明酶解程度是影响胎盘多肽还原力的重要因素,与向泽敏等[17]和易余艳[31]的结果相符。
3.3 不同胰蛋白酶酶解条件对奶牛胎盘还原性多肽综合提取率的影响
在酶解蛋白制备活性多肽过程中,酶解产物活性受温度、pH、底物浓度、酶底比和酶解时间等众多因素影响,往往呈现复杂的变化规律。由于奶牛胎盘组织中蛋白质含量较高,且具有一定的不溶性蛋白,导致本试验不仅是多底物反应,且是固相-液相之间的酶解反应,由固态蛋白酶解的可溶性肽段若具有酶切位点,则会进一步的被蛋白酶水解。在酶解进程中,不同蛋白与多肽对酶的亲和度差异形成酶解体系中竞争关系,从而对酶解制备多肽的收率和还原力造成较大影响[34]。本试验为通过胰蛋白酶酶解法获取较高活性和提取率的奶牛胎盘多肽,以综合提取率E(μg/g)为响应值,基于Box-Behenken中心响应法进行优化,在反应时间5.8 h,底物浓度34.98%,酶底比3.33%时,获得最高理论综合提取率(2 037.92 μg/g),将其代入提取率与VitC当量曲线,对应值为5.52%和39.08 μg/mg,仍高于向泽敏等[17]对其他动物胎盘的酶解结果,表明以综合提取率E评估酶解奶牛胎盘制备还原性多肽具有一定可靠性。响应面显示,酶解时间-酶底比、底物浓度-酶解时间和酶底比-底物浓度相互作用的F值分别为3.58、2.22和3.52,表明各因素相互作用对综合提取率均有一定影响,且呈现较为复杂关系。此外,酶解实际条件较最佳理论条件差距越大,多肽生物学活性越低,而提取率则与各因素均呈正相关,这可能是本试验中酶解时间与酶底比对综合提取率影响较为复杂的原因。与胎盘多肽还原力不同,随酶解时间和酶底比增加,其综合提取率下降并不明显,可能是由于胰蛋白酶酶切位点具有较强特异性,减少了还原性多肽进一步酶解的结果[35]。此外,本研究对胰蛋白酶酶解法优化结果表明:较高底物浓度在酶底质量比固定时会降低酶解产物对奶牛组织蛋白的竞争作用,从而提高综合提取率;当酶解时间固定的情况下,酶底比可对底物浓度和响应值的相关性造成较大影响,说明较高酶底质量比可加快酶解反应速率,从而加速还原性多肽进一步酶解;在底物浓度固定的情况下,酶解时间较短时,综合提取率随酶底比降低,随酶解时间延长,低酶底比下综合提取率上升,而高酶底比组先上升后下降,说明酶底比决定酶解速率,进而影响相同时间内胎盘多肽的提取率与还原力,对综合提取率影响较大。
4 结 论
超声破碎法和胰蛋白酶酶解法制备奶牛胎盘组织多肽的提取率和还原力均呈显著正相关。超声破碎法提取奶牛胎盘多肽最佳条件为50%底物浓度、超声功率1 800 W,破碎时间7.5 min,此时的提取率为0.95%,VitC当量为2.91 μg/mg;胰蛋白酶酶解法最高提取率的条件为反应时间5.78 h,底物浓度30.21%,酶底比3.24%,此时的理论提取率为5.55%;最佳还原力的条件为5.13 h,底物浓度35.59%,酶底比4.19%,此时的理论VitC当量为39.32 μg/mg;经综合提取率优化后,获取的最佳提取条件为反应时间5.8 h,底物浓度34.98%,酶底比3.33%,此时的理论综合提取率为2037.92 μg/g,将其代入提取率与VitC当量曲线,对应值为5.52%和56.35 μg/mg。

