番茄与黄瓜远缘嫁接愈合口形成过程的组织解剖分析
吴 烨 刘雯倩 胡 茜 高丽红 张文娜
(中国农业大学 园艺学院/设施蔬菜生长发育调控北京市重点实验室,北京 100193)
园艺作物广泛利用嫁接以保持良种品质、快速繁育、调整长势、提高抗性、增加产量和改善品质[1-3]。前人多从激素水平、解剖学层面和营养运输等层面研究远缘嫁接砧穗间互作的生理机理[4-5],但其分子机理尚不明确。随着分子生物学研究不断深入,研究发现嫁接砧穗间及愈合口处存在激素、RNA、蛋白质和脂类等信号分子的韧皮部长距离、细胞间短距离运输[6]及DNA水平转移[7]。这些信号分子构成了砧穗交流互作的主要信息物质,运输过程中它们可调控转录、参与基因表达及蛋白翻译,导致DNA甲基化、基因沉默和基因激活[8-9],进而调控后期植物体生长发育及对逆境胁迫的适应性[10],因此,明确砧穗间运输的具体信号分子,解析其运输如何调控砧穗互作成为了研究中首要函待解决的问题。但由于目前生产中常使用近缘种嫁接,砧木和接穗分别产生的信号分子同源性极高,其运输性鉴定存在着一定困难,如果能够使用不同科、种、属或亲缘关系更远的物种分别作为砧木和接穗进行远缘嫁接,如大豆与南瓜[11]、绿豆与甘薯[12]、大豆与番茄[13]等,不仅可获得近缘或种内杂交不能获得的优良特性,如提高植物观赏价值和产量、抗逆抗病虫性强、生长快和改进果实品质等[14],由于远缘嫁接砧穗亲缘关系较远,性状差异较大,能产生各自物种特异性的信号分子,还便于使用分子生物学等方法鉴定信号分子的砧穗间运输性,为砧穗互作研究的奠定了坚实的基础。
众所周知,嫁接口的愈合是嫁接苗成活的关键,与近缘亲和性嫁接相比,远缘嫁接由于砧穗的解剖结构和生长特性以及遗传特性不同, 引起嫁接接口无法愈合,维管束无法成功连通而嫁接失败[15-16]。因此,为了建立成功的茄科及葫芦科作物的远缘嫁接体系,便于探究二者间砧穗互作及信息交流的分子机理,以推进未来远缘嫁接技术体系的优化和应用,本研究首先针对远缘嫁接愈合及维管束连通过程的解剖结构进行分析,以黄瓜‘新泰密刺’、黑籽南瓜和番茄‘中杂9号’为试验材料,下胚轴斜靠接方法嫁接番茄/黄瓜,近缘嫁接的黄瓜/南瓜和黄瓜/黄瓜作为对照,观测嫁接苗生长形态和嫁接口愈合过程变化,旨在明确远缘嫁接番茄/黄瓜愈合口形成过程中的细胞分裂及分化、细胞融合及维管束组织连通和砧穗间物质交流等过程,初步解释二者嫁接不亲和的解剖学机理。
1 材料与方法
1.1 材料
试验材料包括黄瓜品种‘新泰密刺’(CucumissativusL.),南瓜为黑籽南瓜(CucurbitaficifoliaBouché.)和番茄品种‘中杂9号’(LycopersiconesculentumMill.),为北京市重点实验室中国农业大学园艺学院设施蔬菜生长发育调控研究室保存种子。
1.2 试验方法
1.2.1种子处理与播种
黄瓜、南瓜及番茄种子放入56 ℃温水中玻璃棒搅拌15 min,换上25 ℃常温浸泡4~6 h后放置28±2 ℃黑暗条件下催芽,种子露白1~2 mm后,播种至50孔基质穴盘(54 cm×28 cm,草炭∶蛭石∶珍珠岩体积比=2∶1∶1混合基质)中,覆盖保鲜膜放入光照培养箱培养(相对湿度:85%)。为保证嫁接苗粗度一致,便于下胚轴嫁接成活,播种顺序为番茄子叶展平期,开始播种黄瓜,再一周后播种南瓜。
1.2.2下胚轴嫁接
当番茄幼苗第三片真叶长出,株高5.0~6.0 cm,黄瓜幼苗第一片真叶展开至直径2 cm,株高为4.0~5.0 cm,南瓜幼苗两片子叶完全展开,株高为2.5~3.5 cm,此时三者茎粗一致,约为0.3~0.5 cm。嫁接组合为番茄/黄瓜、黄瓜/黄瓜、黄瓜/南瓜(接穗/砧木)。用刀片将接穗子叶下方斜向上切出上斜仰角约60°斜面,同时保留接穗苗下胚轴长2.0~3.0 cm,斜面长度1.0 cm左右,同时用刀片在砧木子叶下方斜切,保留砧木下胚轴长3.0~4.0 cm,下斜俯角约60°,切面长度与接穗一致,然后将接穗与砧木切面对齐贴紧并用嫁接夹固定。
1.2.3嫁接苗管理
嫁接苗放置育苗套装中,透明塑料盖子上用喷壶充分湿润,育苗基质浇透水,保持育苗装置内小环境的湿度;将育苗装置用保鲜膜密封后放入28±2 ℃ 培养箱中暗培养2~3 d(相对湿度:95%~100%),然后转入弱光培养3~4 d(相对湿度:100%;16 h 28 ℃光培养/8 h 18 ℃暗培养;光强为100~150 μmol/(m2·s)),期间适当通风,之后进行正常光照培养。使用塑料罩保湿并放入28 ℃培养箱暗培养,3 d后揭开塑料罩取下固定夹,之后转入正常光照度继续培养(相对湿度:100%;16 h 28 ℃ 光培养/8 h 18 ℃暗培养;光强:300~600 μmol/(m2·s))。
1.2.4嫁接苗形态变化观察与成活率统计
嫁接后每天观察接穗生长状况,并对嫁接未成活苗的剔除和统计,分别于嫁接后第2、5、8和15 天作为时间点进行拍照,于第8和15天统计嫁接成活率。试验为2018年重复3次的统计结果。
1.2.5嫁接愈合处石蜡切片制作与观察
每种嫁接组合分别于第2、5、8、15 天作为时间点进行取样,每个组合每次取样随机选取嫁接成活苗8株,截取嫁接口上下1 cm长茎段,使用FAA溶液固定,50%、70%、85%、95%和100%乙醇系列脱水,二甲苯透明置换,石蜡包埋,切片,茎段切片厚度8 μm。甲苯胺蓝染色,中性树胶封片制成永久切片观察,光学显微镜(Olympus, CX41),体式显微镜(Leica, M205A)观测嫁接口组织细胞融合及维管束连通情况。
1.2.6嫁接苗维管束连通检测
嫁接15 d后,取嫁接成活苗(接穗顶端有新叶长出),根系浸入0.1% 酸性品红溶液,6 h后使用体式显微镜检测嫁接口,观测茎木质部及地上真叶叶脉、新叶叶脉品红染色情况,方法参考Marsch-Martiínez 方法[17];参照HPTS染色方法[18-19], 嫁接苗地上部分叶片浸入1 mmol/L HPTS(8-hydroxypyrene-1,3,6-trisulfonic acid, 8-羟基芘1,3,6-三磺酸)溶液,12 h后制作徒手切片,CLSM(Leica, SP8)观测嫁接口下方的荧光情况。
2 结果与分析
2.1 不同组合嫁接苗形态变化与成活率
黄瓜分别与番茄、南瓜、黄瓜嫁接,嫁接后第2天砧穗接合在一起,成活率均为80%以上;5 d后嫁接口愈合完成,番茄/黄瓜成活率下降至50%左右;15 d后黄瓜与番茄异嫁接苗由于远缘嫁接的不亲和性逐渐死亡,存活率为17%左右;而黄瓜与南瓜,黄瓜、南瓜和番茄自嫁接始终成活,对照黄瓜自嫁接与黄瓜/南瓜除了部分萎蔫失水外,成活率保持在85%以上。初步摸清了嫁接口愈合的时间点变化(图1和图2)。
2.2 3种组合的嫁接口细胞分化及愈合
黄瓜/黄瓜和黄瓜/南瓜2种组合呈现嫁接亲和状态,嫁接后第2天黄瓜/黄瓜自嫁接的愈伤细胞薄壁细胞正常连接分化(图3(a)~(d));嫁接后第5天愈伤组织继续分裂增殖,建立新的形成层与维管束组织,接穗与砧木间的空隙已经被逐渐填满,砧木接穗二者细胞相互交错生长,愈伤组织薄壁细胞互相连接,成为一体(图3(e)~(h));嫁接后第8天砧穗接口处的薄壁细胞已经分化出新的形成层细胞,且由该形成层分化出新的韧皮部和方形的小口径导管分子,导管筛管相互沟通,愈合过程基本结束(图3(i)~(l));嫁接15 d后嫁接口分化出新的维管束输导组织,砧穗连接为一体(图3(m)~(p))。
异嫁接组合黄瓜/南瓜与黄瓜自嫁接组合基本一致,但黄瓜南瓜组合愈合进展整体较慢。嫁接后第2天仍能清晰看到嫁接口边界隔离层,但细胞由胼胝质及愈伤组织连接,此时基本没有薄壁细胞脱分化(图4(a)~(d));嫁接后第5天,愈伤组织开始增多,但砧穗愈伤组织并未完全连接,仍可看到颜色较深的嫁接口隔离层边界染色线(图4(e)~(h));嫁接后第8天,愈伤组织已经完全连接,维管束组织及薄壁细胞继续融合分化,但从横切面可以看到尚无新生的导管分子(图4(i)~(l));嫁接15 d后输导组织连接,形成统一完整的嫁接体,边界细胞基本消失(图4(m)~(p))。
远缘嫁接组合黄瓜/番茄嫁接后第2天愈伤组织薄壁细胞靠在一起但未完全融合,边界细胞依旧明显,黄瓜与番茄的维管束呈现各自的显著特征,即黄瓜的一套维管束由外韧、内韧和木质部细胞构成,番茄的韧皮部和木质部呈射线分布(图5(a)~(d))。嫁接后第5天,虽然砧木与接穗在嫁接口正常脱分化出愈伤组织,但相互间不能融合,形成隔离层(图5(e)~(h))。嫁接后第8天接穗与砧木木质部与韧皮部薄壁细胞均各自产生有脱分化的大量细胞团,且从纵切面可以看到导管分子纵向排列开始扭曲(图5(i)~(l));第15天,尽管有部分薄壁细胞分化,但不能真正愈合,未发生维管束输导组织分化连通,愈伤组织边界细胞依旧明显(图5(m)~(p)),并且番茄接穗有不定根发生,说明接穗急需吸取空气中的水分及营养物质来维持地上部生长(图5(o))。

(a)、(d)、(g)和(j)为番茄/黄瓜嫁接苗生长情况,右侧图为嫁接口放大;(b)、(e)、(h)和(k)为黄瓜/黄瓜嫁接苗生长情况,右侧图为嫁接口放大;(c)、(f)、(i)和(l) 为黄瓜/南瓜嫁接苗生长情况,右侧图为嫁接口放大;黄色箭头示嫁接口。
2.3 嫁接苗的维管束连通情况
为检测嫁接15 d的番茄/黄瓜嫁接口木质部是否真正连接,用1%的酸性品红浸染砧木根部,检测品红随着根压和蒸腾拉力向地上部分的运输情况,黄瓜/南瓜嫁接苗作为对照。6 h后检测到酸性品红经维管束尤其是木质部由根部吸收,向上运输,在嫁接口处聚集(图6(a)~(c);图7(a)~(c))。且接穗的输导组织中均可以检测到品红染色,发现其定位于木质部细胞(图6(d)~(f);图7(d)~(e))。嫁接口处染色情况证明品红溶液可通过二者木质部连接而运输,且还可以通过愈伤组织连接处边界的缝隙以及细胞融合的间隙扩散至木质部,扩散进入接穗的木质部,并随着蒸腾拉力作用向地上部分运输(图6(g)~(j);图7(f)~(g))。
为检测嫁接15 d的番茄/黄瓜嫁接口韧皮部是否真正连接,韧皮部共质体运输的特异性标记HPTS浸染番茄接穗的叶片,在保证Confocal荧光参数不变的条件下,结果表明12 h后HPTS可以在番茄接穗的叶片经共质体运输至下胚轴(图8(a)~(c)),但并不能通过嫁接口运输至黄瓜砧木(图8(d)(木质部为自发荧光)。但在黄瓜/黄瓜的自嫁接对照中,12 h后可检测到HPTS从黄瓜接穗运输至黄瓜砧木(图8(e)~(f))。
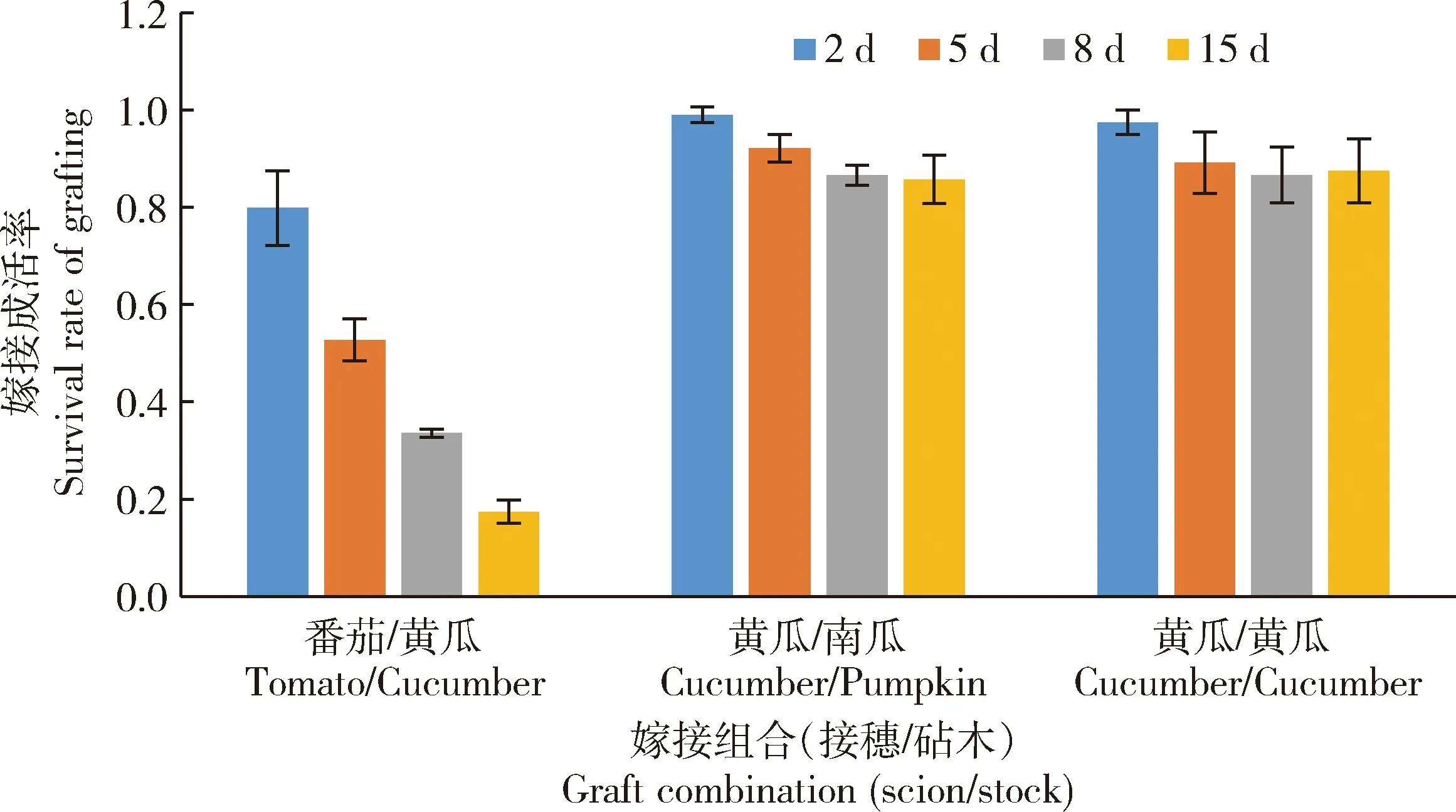
每种组合的平均嫁接株数分别为:番茄/黄瓜92~100,黄瓜/南瓜45~60,黄瓜/黄瓜35~40; 试验为1个月内3次嫁接统计结果
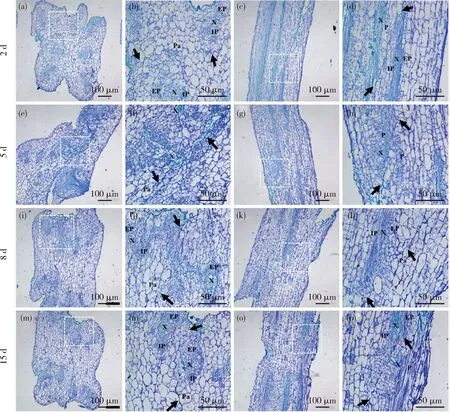
(a)、(e)、(i)和(m)为黄瓜/黄瓜嫁接口横切面图;(b)、(f)、(j)和(n)为(a),(e),(i)和(m)中白框的放大;(c)、(g)、(k)和(o)为黄瓜/黄瓜嫁接口纵切面图;(d)、(h)、(l)和(p)为(c)、(g)、(k)和(o)中白框的放大;黑色箭头指示嫁接口愈伤边界细胞;X,木质部;P,韧皮部;EP,外韧皮部;IP,内韧皮部;Pa,薄壁细胞。

(a)、(e)、(i)和(m)为番茄/黄瓜嫁接口横切面图;(b)、(f)、 (j)和(n)为(a)、(e)、(i)和(m)中白框的放大;(c)、(g)、 (k) 和(o)为番茄/黄瓜嫁接口纵切面图;(d)、(h)、(l)和(p)为(c)、(g)、(k)和(o)中白框的放大;红色箭头指示黄瓜砧木,蓝色箭头指示番茄接穗,黑色箭头指示嫁接口愈伤边界细胞;X,木质部;P,韧皮部;EP,外韧皮部;IP,内韧皮部;Pa,薄壁细胞。
3 讨 论
园艺作物生产中广泛利用嫁接技术,砧木和接穗的亲和性直接影响了植株的生长发育和开花结果、抗性及产品品质[20-21],同时嫁接也是研究植物体内物质运输、成花机制、信号转导、细胞识别机制等基础理论的重要方法和手段[22-24]。砧穗间的互作关系一直是一个热点研究问题[25-26],近年来研究发现嫁接作物的韧皮部含有一系列蛋白质和RNA 分子,可由源器官长距离传递至库,调控根、顶端分生组织、叶片、地下块茎发育,如CmNACP、SHR、GAI、KNOTTED1、StBEL5、PFP-Let6[27-30];调控接穗的顶端分生组织细胞命运,如CmSTM、PbWoxT1[31-32];提高植物抗逆性,如miRNA399、CmGAI、CmWRKYP、CmPP2、Cmlec17、CmPP16、SlSSI[33-35];调控植株开花,如siRNA、FT、CO、TFL、LEAFY等[19,36]。这为砧穗互作的机理研究提供了理论依据,对解决生产中的砧穗不亲和问题及有针对性地园艺作物育种具有重要意义[37-39]。
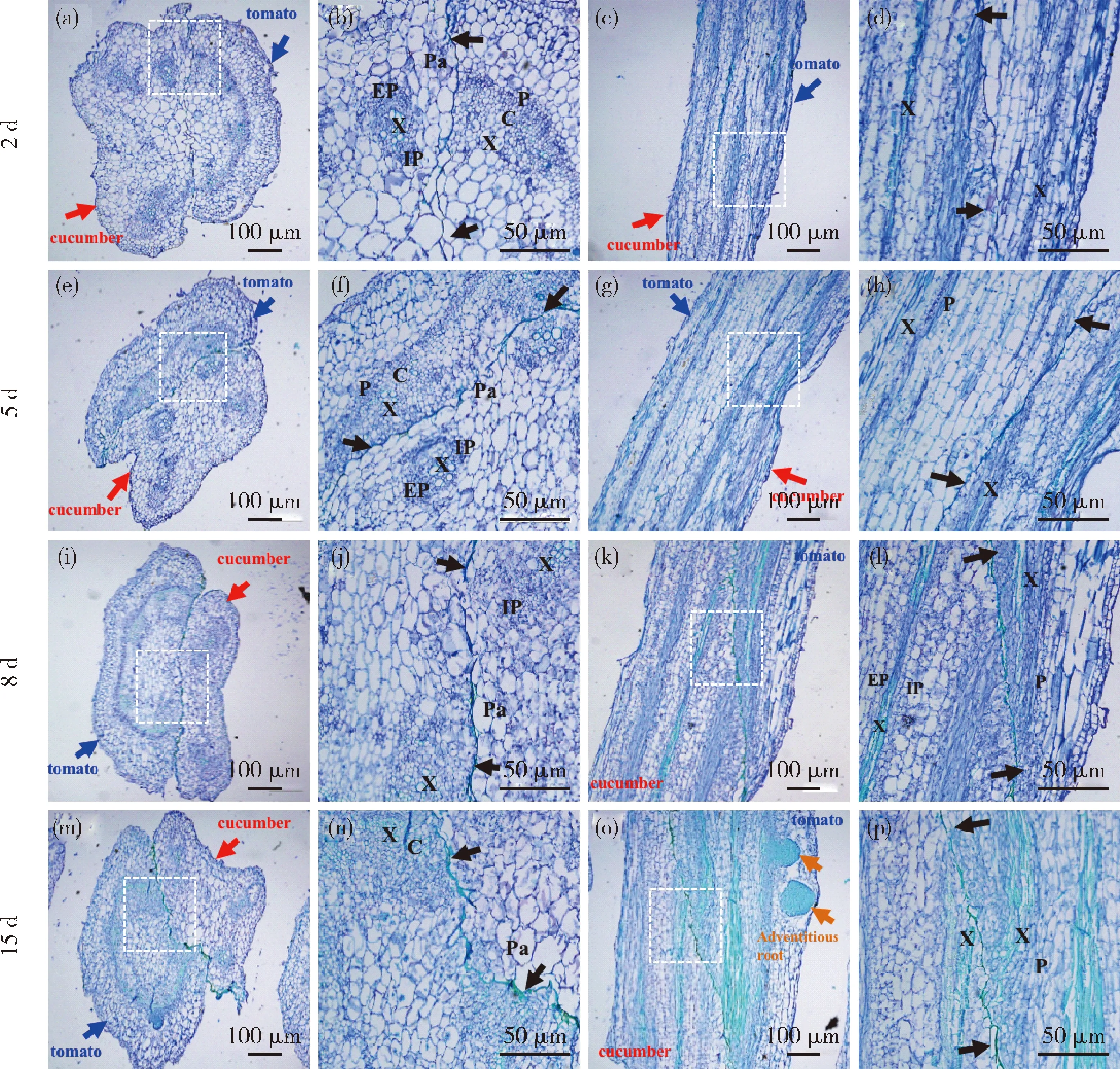
(a)、(e)、(i)和(m)为番茄/黄瓜嫁接口横切面图;(b)、(f)、 (j)和(n)为(a), (e), (i) and (m) 中白框的放大;(c)、(g)、 (k)和(o)为番茄/黄瓜嫁接口纵切面图;(d)、(h)、(l)和(p)为(c), (g), (k) 和 (o) 中白框的放大;红色箭头指示黄瓜砧木,蓝色箭头指示番茄接穗,黑色箭头指示嫁接口愈伤边界细胞,橙色箭头指示番茄接穗的不定根; X,木质部;P,韧皮部;EP,外韧皮部;IP,内韧皮部;Pa,薄壁细胞;C.形成层。
与近缘嫁接相比,远缘嫁接由于砧穗亲缘关系较远,基因组序列差异性较大,更利于DNA、RNA及蛋白质等信号物质的砧穗间运输性鉴定,对砧穗间信息互作的机理研究非常有利,以往研究发现远缘嫁接起源的基因沉默信号长、短距离运输均可引起DNA甲基化及表观遗传变化,如控制影响植株光合能力、叶片性状、逆境胁迫响应等母性遗传的数量性状等砧穗间叶绿体基因组遗传物质交换等[40-41],远缘嫁接更容易导致新的嫁接杂种出现[42],这也为探索有关远缘嫁接产生杂种机制提供了新思路。
远缘嫁接的研究基础首先是需要砧穗完全愈合[43],接合口的融合过程涉及到接穗和砧木之间细胞分裂及分化、胞间连丝形成、形成层分化和连接、木质部及维管束组织重建等过程,广泛应用于近缘同科属植物嫁接[44-46]。本研究中发现黄瓜自嫁接和黄瓜/南瓜亲和性嫁接的嫁接苗嫁接口愈合在解剖学层面上的愈合过程大致为:嫁接后1~3 d形成隔离层,4~6 d愈伤组织出现并增殖,7~9 d愈伤组织分化连接,并开始建成形成层与输导组织,第15天则嫁接部位维管束完全建成,嫁接苗正常生长存活。远缘的番茄与黄瓜嫁接组合在嫁接后呈现不亲和状态,其主要表现为砧木与接穗在切口正常产生愈伤组织并分裂增殖,但薄壁愈伤细胞不融合,这也就导致后期愈伤细胞无法分化,尽管木质部有部分连接,可以保证接穗吸取一定的水分和离子,保证其不萎蔫,但实际中韧皮部输导组织不能形成,接穗的光合同化产物及营养物质不能完全运输,不能维持正常的生命生长活动。在番茄黄瓜的嫁接口愈合过程观察中,从切片上可以看到接口边缘始终存在的深色染色层,初步推断这一隔离层即为砧木与接穗各自愈伤细胞不能正常融合连接的重要原因。

(a)番茄/黄瓜的嫁接口,虚线指示(b)、(d)和(g)的横切部位;(b)黄瓜砧木横切面;(c)黄瓜砧木的纵切面;(d)番茄接穗横切面;(e)和(f)为(d)图黑框的放大;(g)和(i)嫁接口横切面;(h)为(g)黑框的放大,(j)为(i图黑框的放大。Ep,表皮细胞;X,木质部;Ca,愈伤组织。橙色箭头指示酸性品红染色的维管束。

(a)黄瓜/南瓜的嫁接口,虚线指示(b)、(d)和(g)的横切部位;(b)南瓜砧木横切面;(c)南瓜砧木横切面放大;(d)黄瓜接穗横切面;(e)为(d)图黑框的放大;(f)嫁接口横切面;(g)为(f)黑框的放大。X,木质部;Ca,愈伤组织。蓝色箭头指示酸性品红染色的维管束。
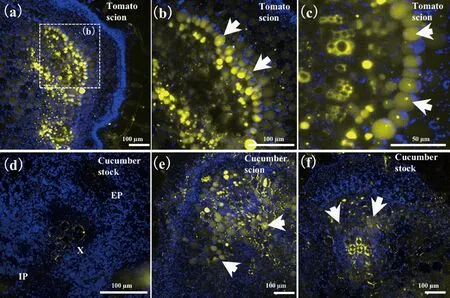
(a)番茄/黄瓜中的番茄接穗横切,虚线框指示(b)的位置;(c)番茄接穗横切放大;(d)番茄/黄瓜中的黄瓜砧木横切面;(e)黄瓜/黄瓜中黄瓜接穗横切;(f)黄瓜/黄瓜中黄瓜砧木横切。EP.外韧皮部;X,木质部;IP,内韧皮部。白色箭头指示HPTS在韧皮部的共质体运输途径。
酸性品红可通过根部吸收,在蒸腾拉力和根压作用下经木质部向地上部运输,常用于检测木质部的连通情况[17]。结果中番茄/黄瓜嫁接体的嫁接口处只是愈伤组织的融合连接,并未完全分化建成木质部细胞,部分品红溶液通过愈伤组织连接处边界的缝隙扩散进入番茄的木质部,并随着蒸腾拉力作用通过茎木质部向接穗运输(图6);HPTS(8-hydroxypyrene-1,3,6-trisulfonic acid, 8-羟基芘1,3,6-三磺酸)分子包含3个磺酸盐基团,在pH<0.7生理条件下携带电性而无法进入细胞,由于细胞膜的不透水性,HPTS常用于共质体及质外体运输的标记,检测韧皮部的连通情况[18],番茄/黄瓜嫁接体显然韧皮部细胞未能够分化连接(图8),初步探明了番茄/黄瓜远缘嫁接体接口愈合的形态解剖学机理。
综上所述,通过本研究的初步结果,建立适当的远缘嫁接体系,研究其当代及后代植株的遗传及变异规律,探索变异来源及方向性;并探索嫁接诱变的机制,找出影响嫁接诱变的影响因素及其作用方式;将来可提供更多关于远缘嫁接诱变分子水平的证据,开拓远缘嫁接诱变的应用领域,对园艺作物种质资源的创制及揭示砧穗间互作的分子机制均具有重要意义。

