甲基绿双波长吸收光谱法测定面制食品中甜蜜素
刘艳,庞向东,陈明朗,江虹
(长江师范学院 化学化工学院,重庆,408100)
食品添加剂的作用主要在于增强食品营养价值、改善食品感官性状、抑制食品中微生物的生长繁殖、防止食品腐败等[1]。随着食品毒理学研究的不断深入,人们对某些食品添加剂可能产生的慢性毒性、致畸、致突变及致癌等危害有了新的认识,这些问题引起了人们的广泛关注[1]。目前,国内外在使用化学制品作为食品添加剂时都非常谨慎。甜蜜素是人工合成的增强甜味功能的食品添加剂,在食品业应用广泛,但过量使用会对人体造成危害[1]。美国和日本明确规定禁止在食品中添加甜蜜素,而中国、欧盟等国虽然准许添加,但对使用量作了严格规定。我国在食品添加剂使用标准(GB 2760—2014 食品安全国家标准)中明确规定,面包和蛋糕中甜蜜素含量不得超过1.6 g/kg,饼干中甜蜜素含量不得超过0.65 g/kg。近年,国内外对甜蜜素的检测方法主要有高效液相色谱法[2-5]、高效液相色谱-串联质谱法[6-14]、气相色谱法[15-17]、气-质联用法[18]、电化学法[19-21]及少量分光光度法[22-23]。其中,前4种方法除前处理较麻烦外,日常运行费用较高;电化学法需特殊的电极材料,实验条件要求较为苛刻。分光光度法因所用仪器价格便宜、操作简便,有较好的稳定性和重复性,并有较高灵敏度,广受分析工作者的喜爱。本试验通过优化反应条件,建立了一种检测甜蜜素的双波长可见吸收光谱(dual-wavelength visible absorption spectroscopy, DWO-VIS)技术,用于面制食品中甜蜜素的检测。
1 材料与方法
1.1 材料与试剂
供试材料为桃酥饼干(1#)、甜薄脆饼干(2#)、老面包(3#)、无夹心面包(4#),重庆某超市及面包店。
甲基绿(纯度99%),山东西亚化学工业有限公司;甜蜜素(纯度99.3%)(GBW(E)100066),中国食品药品检定研究院;HCl(分析纯),重庆川东(化工)集团有限公司;三羟甲基氨基甲烷(Tris)(分析纯),上海吉至生化科技有限公司;超纯水。
1.2 仪器与设备
pHS-3C型酸度计,上海虹益仪器仪表有限公司;EL104型电子天平,上海精密仪器仪表有限公司;U-3010型紫外-可见分光光度计,日本日立公司。
1.3 实验方法
1.3.1 溶液配制
甜蜜素标准溶液:准确称取0.020 12 g 甜蜜素对照品于小烧杯中,加50 mL 超纯水溶解,搅拌,待溶解完全后,转移至100 mL 容量瓶中,用超纯水定容,配成201.2 mg/L储备液;取储备液10.00 mL,用水稀释至100 mL,配成20.12 mg/L 操作液。
甲基绿溶液:准确称取0.458 5 g甲基绿,用水溶解后定容至1 000 mL,配成1.00×10-3mol/L。
Tris-HCl溶液:将0.10 mol/L HCl溶液和0.20 mol/L Tris溶液混合,用酸度计测定调配成pH 3.2~9.7的系列溶液。
1.3.2 样品前处理
取适量1#~4# 面包和饼干,分别粉碎、混匀后,准确称取2 g左右(精确至±0.000 1 g),加50 mL水,于45 ℃ 热水浴中搅拌、浸提10 min,再45 ℃ 超声浸提20 min,过滤,滤液用超纯水定容至100 mL。
1.3.3 反应条件优化
1.3.3.1 最适pH值的确定
室温下,于10 mL 具塞比色管中,加入甜蜜素标准操作液1.00 mL、甲基绿溶液2.00 mL及不同pH的Tris-HCl溶液1.00 mL,用水定容。以试剂空白作参比,扫描吸收光谱,测定616 nm 和652 nm 处的吸光度(A),作A-pH 曲线,即可判断反应的最佳pH。同理,在其他条件不变的情况下,考察0.50、1.00、1.50、2.00、2.50、3.00 mL Tris-HCl溶液在所选定的最佳pH下对吸光度(A)的影响,作A-V最佳pH曲线,即可判断最佳pH下的最佳用量。
1.3.3.2 甲基绿溶液浓度的测定
室温下,于10 mL 比色管中加入甜蜜素标准操作液1.00 mL、所选定的最佳pH及用量的Tris-HCl溶液,再加入不同用量(0.50~4.00 mL)的甲基绿溶液,用水定容。按1.3.3.1中的测定方法测定各溶液的吸光度(A),作A-c(甲基绿)曲线,即可判断甲基绿的最佳浓度。
1.3.3.3 试剂加入顺序
在上述选定条件不变的情况下,改变甜蜜素、Tris-HCl 及甲基绿的加入顺序,按1.3.3.1的方法测定溶液的吸光度(A),依据谱图上测定波长下吸光度值判断试剂加入顺序对反应灵敏度的影响。
1.3.3.4 反应时间及缔合物的稳定性
在上述选定的各项最佳条件下,按1.3.3.1的测定方法测定在5~100 min 内各不同时间下的吸光度,作A-t曲线,即可判断最佳反应时间及缔合物的稳定时间。
1.3.4 标准曲线
准确移取甜蜜素标准溶液0.00、0.20、0.40、0.60、0.80、1.00、1.20、1.40 mL 于10 mL 比色管中,加入1.00 mL Tris-HCl(pH 8.84)溶液及2.00 mL 甲基绿溶液,用水定容。20 min后,扫描吸收光谱,根据吸光度(A)及甜蜜素的质量浓度(ρ)即可作A616-ρ、A652-ρ及A616+652-ρ标准曲线。
1.3.5 实际样品检测及回收试验
精密移取1.3.2制得的1#~4# 待测液各2.00 mL,代替1.3.4的甜蜜素标准溶液,并按1.3.4的方法配制溶液,扫描吸收光谱,用灵敏度最高的DWO-VIS(616 nm + 652 nm)法测定吸光度,依据标准曲线或回归方程即可求得各待测液及原始样品中甜蜜素的含量(n=5)。同时做3 种加标水平的回收试验(n=5),根据回收率和相对标准偏差,即可判断新方法的准确度和精密度。
2 结果与讨论
2.1 甜蜜素与甲基绿的吸收光谱
从图1-A可知,以水作参比,2.01 mg/L甜蜜素溶液在可见光区的吸收信号十分微弱,而2.00×10-5mol/L的甲基绿溶液(pH 8.84)则有很强的吸收信号,最大吸收峰位于628 nm处。从图1-B可知,以试剂空白为参比,当在2.00×10-4mol/L甲基绿溶液(pH 8.84)中加入甜蜜素标准溶液后,光谱曲线在570~700 nm 范围内出现2个较强的正吸收峰,分别位于616 nm(蓝移12 nm)和652 nm(红移24 nm),由此说明,甜蜜素与甲基绿之间发生反应生成了新物质,并产生具有2个较强吸收峰的新吸收曲线。在616 nm 和652 nm波长处,随着甜蜜素浓度的增大,新物质的吸光度随之增大,甜蜜素标准操作液的用量在0.00~1.40 mL 范围内,服从朗伯-比尔定律。故616 nm 和652 nm 均可选作单波长法的测定波长,对甜蜜素进行定量分析。若在616 nm 和652 nm 处用DWO-VIS 法测定甜蜜素,它仍服从朗伯-比尔定律(因吸光度具有加和性),且可提高方法的灵敏度,DWO-VIS 法的灵敏度约为单波长法的2倍。故实验选用DWO-VIS法定量分析甜蜜素的含量。
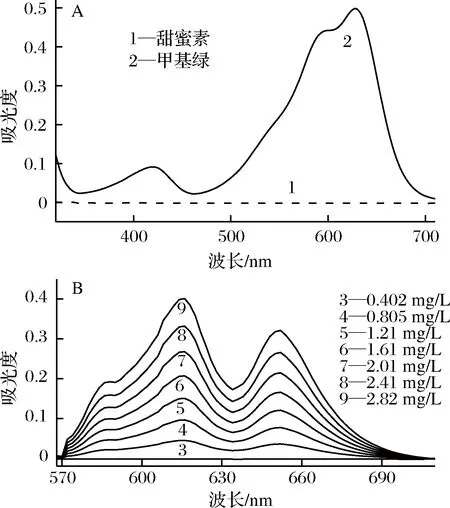
A-甜蜜素溶液与甲基绿溶液;B-不同浓度甜蜜素溶液与甲基绿混合溶液
2.2 反应条件的选择
2.2.1 最适pH值的确定
图2表明,在616 nm 和652 nm 下,pH<7时,体系的吸光度很低,说明此条件下,甜蜜素与甲基绿基本不反应或很少反应;在pH>7的条件下,体系的吸光度随pH值的增大而增大,当增大至pH 8.84时,吸光度达最大,此时反应的灵敏度相对最高,该条件适于甜蜜素与甲基绿进行反应;当pH>8.84时,体系的吸光度随pH值的增大而降低,说明此条件下不适于甜蜜素与甲基绿的完全反应。可见,无论在616 nm 和652 nm处采用单波长法测定还是采用DWO-VIS法测定,反应的最适pH为8.84。继而考察了选定条件及其他条件不变时,pH 8.84 Tris-HCl溶液用量对吸光度的影响,结果表明,最适用量为1.00 mL。后续实验采用选定的最佳pH 值及用量。从图2可知,DWO-VIS法的灵敏度比单波长法高。
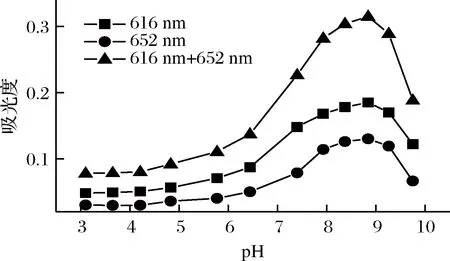
图2 溶液pH对体系吸光度的影响
2.2.2 甲基绿溶液浓度的确定
图3表明,在616 nm 和652 nm 下,甲基绿溶液用量在0.50~4.00 mL 范围内,开始时,随着甲基绿浓度的增大,体系的吸光度随之增大,表明此时甲基绿用量不足,甜蜜素与甲基绿反应不完全;当甲基绿用量增大到2.00 mL 时,体系吸光度达最大,此时反应的灵敏度最高;之后随着甲基绿浓度的再增加,体系吸光度随之下降,说明此时的甲基绿已过量,其自聚作用增强,导致体系的吸光度降低。可见,甲基绿的最适用量为2.00 mL,即最适甲基绿溶液浓度为2.00×10-4mol/L。从图3可知,DWO-VIS 法的灵敏度比单波长法高。
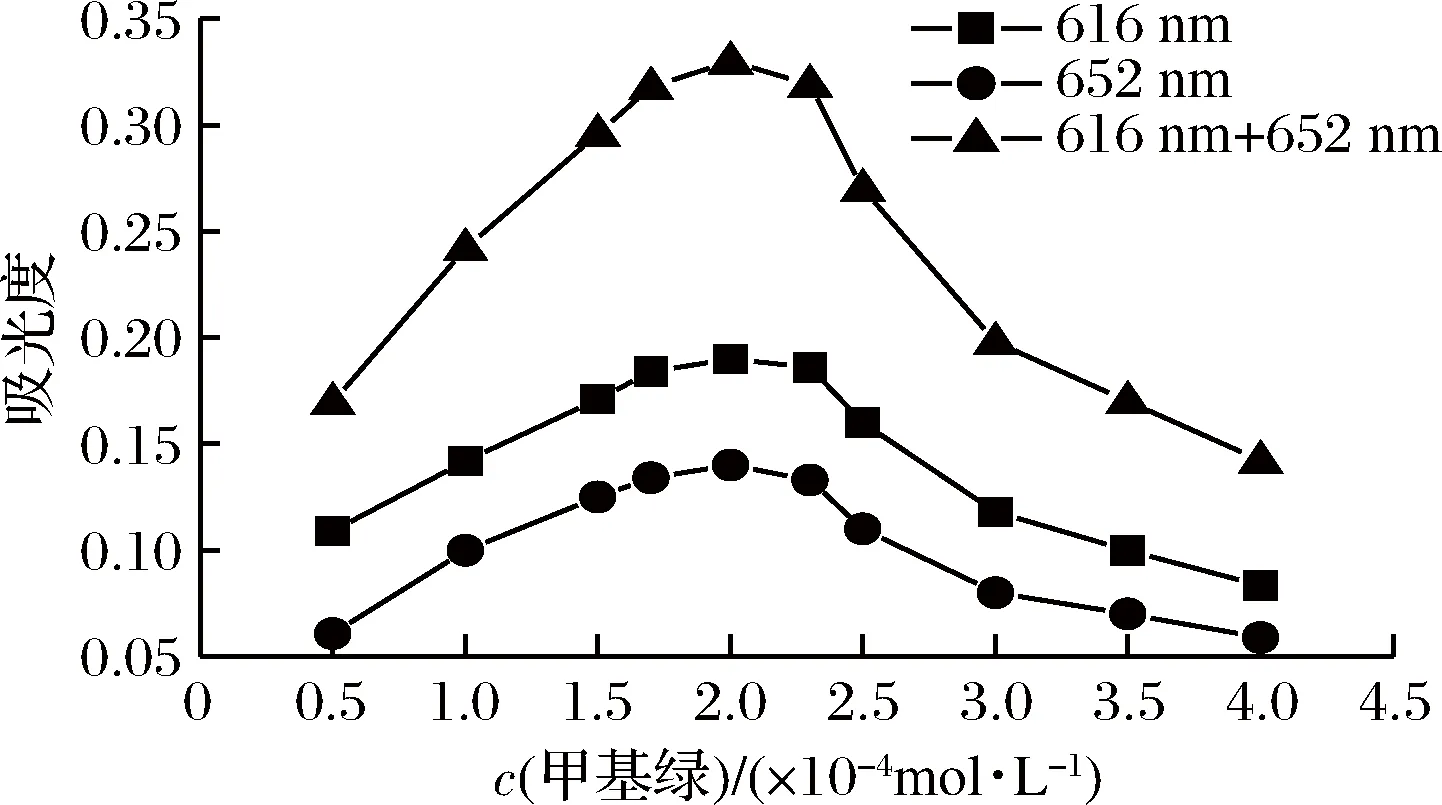
图3 甲基绿溶液浓度对体系吸光度的影响
2.2.3 试剂加入顺序的选择
表1表明,在选定的最佳条件下,改变试剂的加入顺序,对体系的吸光度基本不影响,即这几种试剂可以按任何一种顺序加入,生成的缔合物的吸光度基本一致。后续实验按任意顺序加入各试剂溶液。
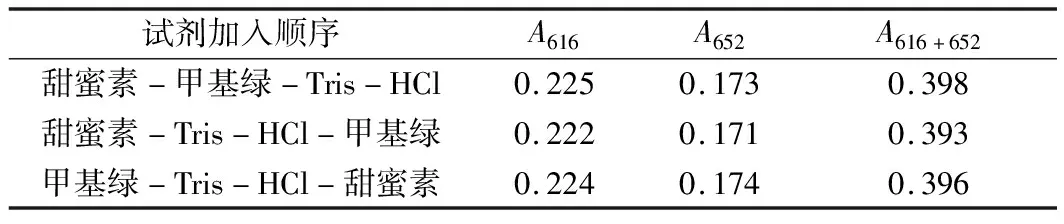
表1 试剂加入顺序对体系吸光度的影响
2.2.4 反应时间及缔合物的稳定性
以616 nm 为例,考察室温下甜蜜素与甲基绿在5~100 min的反应时间内对缔合物吸光度的影响。图4表明,从反应开始到20 min,随着反应时间的增加,体系的吸光度随之增大,表明在这段时间内,甜蜜素与甲基绿的反应不完全;20~80 min 时,体系的吸光度达最大且基本稳定,表明甜蜜素与甲基绿的反应至少需20 min 才能进行完全,生成的缔合物的稳定时间可达1 h;80 min 后,随着反应时间的增加,体系的吸光度逐渐降低,表明80 min 后,缔合物不再处于稳定状态。故实验应选在缔合物的稳定时间段进行测定。
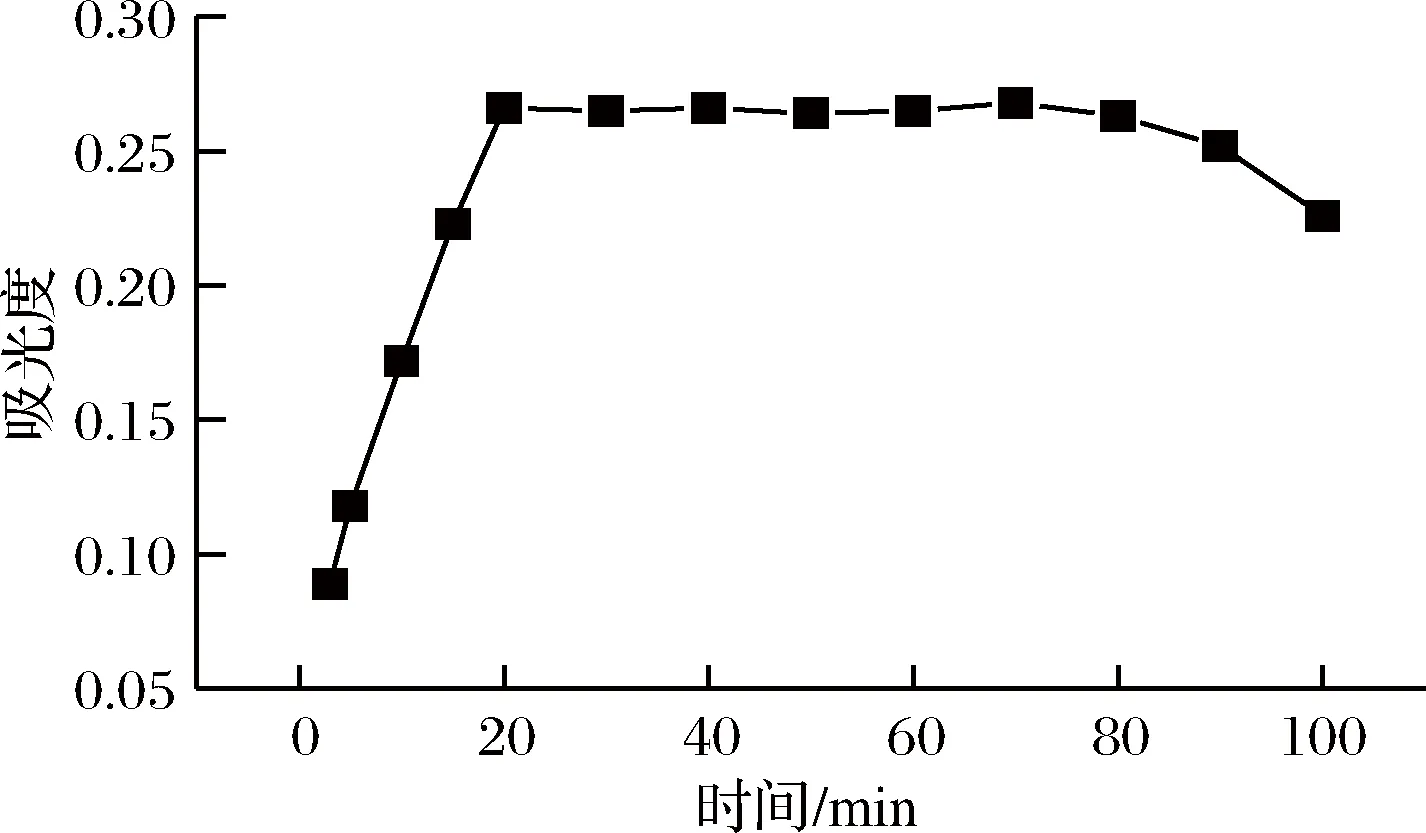
图4 反应时间对体系吸光度的影响
2.3 甜蜜素的标准曲线及相关参数
按1.3.4的方法配制甜蜜素标准系列溶液,扫描吸收光谱,作A616-ρ、A652-ρ及A616+652-ρ标准曲线,相关参数见表2。由表2可见,DWO-VIS法的灵敏度比单波长法高。故后续实验用DWO-VIS法进行测定。
2.4 干扰试验
2.5 样品分析
精密移取1.3.2制得的1#~4# 待测液各2.00 mL,按1.3.5的方法配制溶液并扫描吸收光谱,依据标准曲线或回归方程求出各待测液及原始样品中甜蜜素的含量(n=5)。各样品做3种加标水平的回收试验(n=5)。从表3可知,本法测定结果与GB 1886.37—2015法接近,用F 检验法和t检验法检验新方法的测定结果与国标法间有无显著性差异(置信度P=95%),结果表明,新方法的精密度和准确度均无显著性差异,由此判断新方法准确可靠。
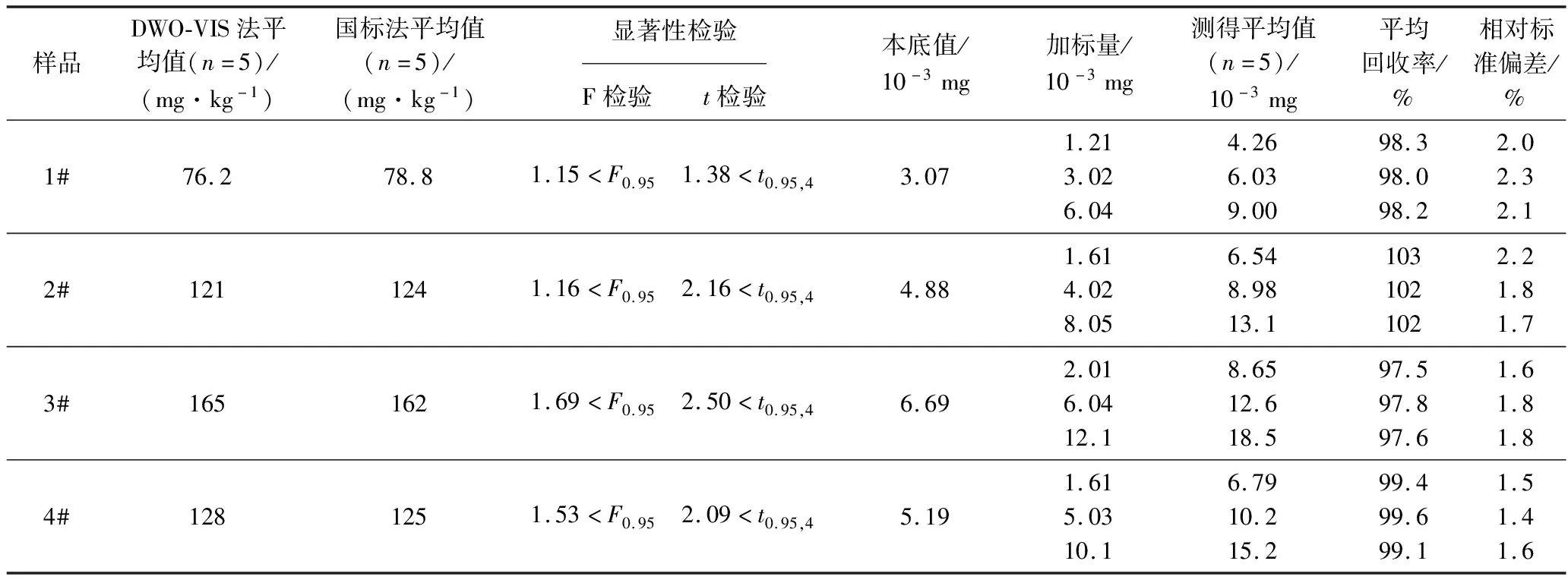
表3 饼干和面包的分析结果及回收试验(n=5)
3 结论
本文采用甲基绿作探针测定甜蜜素的DWO-VIS法,此方法简便、快速、灵敏,并有较高的准确度(回收率为97.5%~103%)和精密度(相对标准偏差为1.4%~2.3%),当置信度为95%时,F检验和t检验(见表3)表明,新方法的精密度及准确度均无显著性差异,说明新方法准确可靠。与国标法GB 1886.37—2015《食品安全国家标准 食品添加剂 环己基氨基磺酸钠(又名甜蜜素)》相比,新方法更环保、低毒、安全。新方法与已报道的分光光度法[22-23]相比,程序更简便、线性范围更宽、线性关系更好,灵敏度更高,并有较好的选择性。该法适于市售饼干及面包中食品添加剂—甜蜜素的批量定量分析。

