PM2.5对AngⅡ诱导人脐静脉内皮细胞凋亡的研究
李岗 邓宇亭 陈冬梅

【摘要】 目的:研究PM2.5和AngⅡ的共同干预下,人脐静脉血管内皮细胞的凋亡率及可能的凋亡机制。方法:体外培养人脐静脉内皮细胞株,分别以不同浓度PM2.5、AngⅡ、PM2.5+AngⅡ处理24、48 h,CCK-8法检测细胞活性,流式细胞术检测细胞凋亡率,Western blot法检测凋亡相关蛋白p-AKT的表达变化。结果:48 h CCK-8结果显示,PM2.5在100.00、200.00、800.00 μg/mL时、AngⅡ在20.00 μmol/L时与对应组别的PM2.5+AngⅡ组比较,差异均有统计学意义(P<0.05)。进一步的流式结果显示,48 h时PM2.5+AngⅡ组凋亡率与单PM2.5或AngⅡ处理比较,差异均有统计学意义(P<0.01,P<0.001)。Western Blot结果显示,PM2.5+AngⅡ处理比单PM2.5或单AngⅡ处理后P-AKT的表达量下调,差异均有统计学意义(P<0.005)。结论:本研究表明体外实验中,PM2.5对AngⅡ诱导血管内皮细胞凋亡具有促进作用,并可能通过PI3K/Akt/eNOS信号通路来实现。
【关键词】 细颗粒物 AngⅡ P-AKT 人脐静脉内皮细胞 凋亡
Effect of PM2.5 on Apoptosis of Human Umbilical Vein Endothelial Cells Induced by AngⅡ/LI Gang, DENG Yuting, CHEN Dongmei. //Medical Innovation of China, 2020, 17(04): 00-006
[Abstract] Objective: To study the apoptosis rate and possible apoptosis mechanism of Human Umbilical Vein Endothelial Cells (HUVEC) under the co-intervention of PM2.5 and AngⅡ. Method: HUVEC were treated with different concentrations of PM2.5, AngⅡand PM2.5 + AngⅡ for 24 and 48 h. The cell activity was detected by CCK-8 assay and the apoptosis rate was detected by flow cytometry (FCM). The expression of apoptosis-related protein p-AKT was detected by Western blot. Result: The results of CCK-8 showed that there were significant differences between PM2.5 at 100.00, 200.00, 800.00 μg/mL and AngⅡ at 20.00 μmol/L and PM2.5 + AngⅡ (P<0.05). The further results of FCM showed that there were differences significantly between PM2.5 with AngⅡ and single PM2.5 or single AngⅡ treatment group in the apoptosis rate (P<0.01, P<0.001). The results of Western Blot showed that the expression of p-AKT in PM2.5 with AngⅡ treatment group was significantly lower than that in single PM2.5 or single AngⅡ treatment group (P<0.005). Conclusion: This study shows that in vitro experiments, PM2.5 can promote the apoptosis effect of AngⅡ to HUVEC. It may be achieved through PI3K/Akt/eNOS signaling pathway.
[Key words] PM2.5 AngⅡ P-AKT Human umbilical vein endothelial cells Apoptosis
First-authors address: School of Basic Medicine, Shenyang Medical College, Shenyang 110034, China
doi:10.3969/j.issn.1674-4985.2020.04.001
近些年,隨着我国城市化进程的加快,大气污染备受关注。其中,颗粒物对人体健康有着严重的危害性[1]。根据粒径大小,大气颗粒物被分成总悬浮颗粒物(total suspended particles,TSP)、可吸入颗粒物(inhalable particles,PM10)、细颗粒物(fine partieles,PM2.5)和超细颗粒物(ultrafine particles,UFP)四类。其中PM 2.5粒直径小、表面积大,吸附的重金属和有毒物质较多,在大气中停留时间长、输送距离远,且可直接到达终末肺泡,在呼吸系统中易于溶解吸收,对人体健康危害最为严重。大量流行病学研究表明PM2.5能增加人体呼吸和心血管系统疾病的发生率,有调查显示雾霾天医院住院人数明显增加,其中主要是以呼吸和心血管系统疾病患者常见[2-3]。血管内皮细胞损伤可引起心血管疾病的发生,这是心血管疾病的一个重要病因[4-5]。而血管内皮细胞损伤的一个重要因素就是血管组织局部RAS系统激活,AngⅡ(血管紧张素Ⅱ)作为该系统的活性肽,当其与受体AT1R结合后对血管内皮细胞功能及结构发挥损害作用。文献[6]表明AngⅡ可诱导血管内皮细胞凋亡,同时也有研究表明暴露于PM2.5中,内皮细胞的AngⅡ浓度能够增加[7]。但并未见PM2.5对AngⅡ诱导血管内皮细胞凋亡作用的相关文献报道,因此通过本实验来探究大气污染物PM2.5与AngⅡ及血管内皮细胞凋亡的相关性,为进一步探究大气污染对心血管疾病的发生机制提供依据,现报道如下。
1 材料与方法
1.1 主要仪器 低温高速离心机(eppendorf,Centrifuge 5804 R),CO2培养箱,显微镜(OLYMPUS,CKX310),酶标仪(TECAN,infinite M200 PRO);流式细胞仪,蛋白电泳仪(BIO-RAD,Mini-PROTEAN Tetra System),电转仪和曝光机。
1.2 主要试剂 DMEM完全高糖培养液(江苏凯基生物技术股份有限公司),TBD胰蛋白酶(Solarbio),细胞活力检测试剂盒(CCK-8)(Eno Gene Cell TM CountingKit-8),Annexin V-FITC/PI凋亡试剂盒(Solarbio),RIPA组织/细胞裂解液(Solarbio),BCA蛋白浓度试剂盒(Solarbio),彩虹180广谱蛋白Marker(Solarbio),SDS-PAGE凝胶制备试剂盒(Solarbio),ECL Plus荧光检测试剂(Solarbio),抗P-AKT抗体(EnoGene,E1A0016),HRP标记的羊抗兔IgG(EnoGene)。
1.3 实验方法
1.3.1 PM2.5的制备 在辽宁省沈阳市交通要道(周围无明显污染源)使用120F型大流量粉塵采样器(采样流量:1 000 L/min)进行大气PM2.5采样,采样时间选择冬季采暖季节,每天连续采集24 h,含尘滤膜于-20 ℃短期保存。采集所用滤膜为恒重的玻璃纤维滤纸,将采有PM2.5的滤膜裁剪成(2×2)cm2大小,于高压蒸汽灭菌后的烧杯中使用三蒸水浸泡,超声振荡10 min后,用六层纱布过滤震荡液,连续浸泡、震荡、过滤3次,将滤液于低温超速离心机中离心(1 000 r/min,4 ℃)弃去上清液,收集底层颗粒物,冷冻后真空干燥,称重后计算粉尘量,低温冰箱保存备用,使用时按照浓度进行制备。
1.3.2 细胞培养 HUVEC用DMEM完全高糖培养液37 ℃、5% CO2培养箱培养取对数生长期用于实验。
1.3.3 CCK-8法检测细胞活性 将细胞制成悬液,以每孔8×103个接种96孔板。实验分为对照组,PM2.5组(PM2.5终浓度分别为50、100、200、400、800 μg/mL),AngⅡ组(AngⅡ终浓度分别为1.25、2.50、5.00、10.00、20.00 μmol/L),PM2.5+AngⅡ组(终浓度为50.00 μg/mL+1.25μmol/L、100.00 μg/ml+2.50 μmol/L、200.00 μg/ml+5.00 μmol/L、400.00 μg/mL+10.00 μmol/L、800 μg/mL+20 μmol/L)。每组设3个复孔。分别于24、48 h后检测结果按照CCK-8试剂盒说明书进行操作,使用酶标仪在450 nm处检测各孔吸光度(OD)值。细胞存活率(%)=处理组OD值/对照组OD值×100%。
1.3.4 流式细胞术检测细胞凋亡 以每孔30×104个接种到6孔板,实验分为:对照组,PM2.5组
(400.00 μg/mL),AngⅡ组(20.00 μmol/L),PM2.5+AngⅡ组(400.00 μg/mL+20.00 μmol/L),培养48 h后用胰蛋白酶将细胞消化下来,制成悬液,用预冷PBS洗涤一次,用1 mL Binding Buffer重悬细胞,取100 μL悬液,先在室温避光条件下用5 μL Annexin V-FITC染色10 min,再加入5 μL PI 孵育5 min,最后加入PBS至500 μL,1 h内流式细胞仪检测。
1.3.5 Western Blot法检测凋亡相关蛋白 以每孔30×104个接种到6孔板,分组同上。48 h后,用预冷PBS洗涤,在孔板中加入含PMSF的RIPA细胞裂解液在冰上裂解。4 ℃、11 000 g,离心4 min,取上清,用BCA法测蛋白浓度。后取5 μg蛋白,进行SDS-PAGE分离,分离后用PVDF膜进行转膜,转膜后用5%脱脂奶粉室温封闭,清洗后孵育一抗(抗P-AKT抗体),二抗(HRP标记的羊抗兔IgG),内参,最后用ECL法显色,曝光拍照,用Image J 分析软件分析条带的灰度值,用目标蛋白与GAPDH灰度值的比值来表示蛋白的相对表达水平。
1.4 统计学处理 以GraphPad Prism 6统计软件进行分析,计量资料采用(x±s)表示,多样本组间比较采用多因素方差分析(Two-way ANOVA),以P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
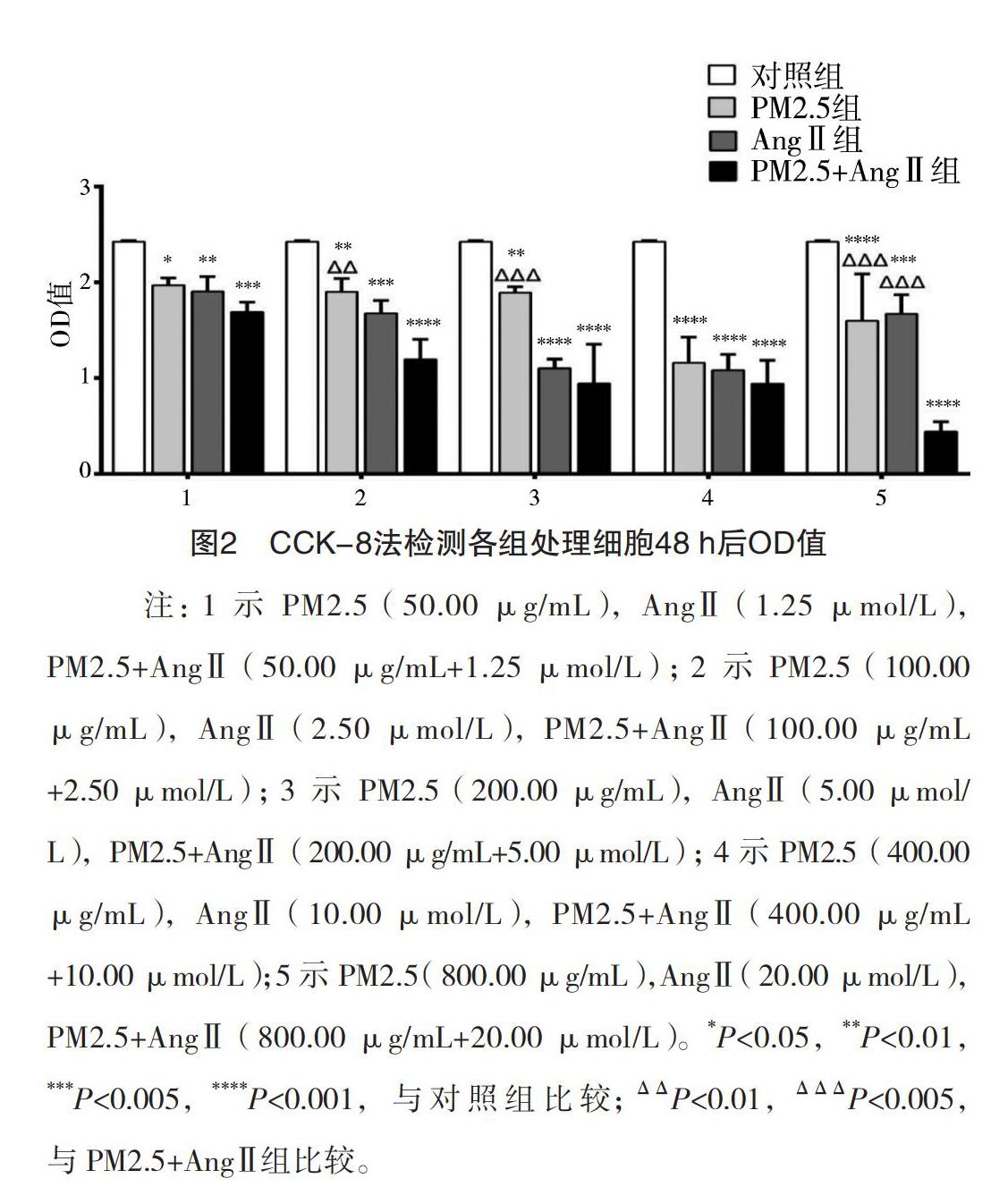
2.1 各组细胞存活率比较 (1)24 h时对照组OD值为(2.620±0.019),PM2.5组(PM2.5终浓度分别为50.00、100.00、200.00、400.00、800.00 μg/mL)OD值分别为(2.384±0.295)(2.173±0.149)(1.992±0.066)(1.789±0.343)(1.656±0.269),AngⅡ组(AngⅡ终浓度分别为1.25、2.50、5.00、10.00、20.00 μmol/L)OD值分别为(2.493±0.087)(2.298±0.088)(2.163±0.373)(2.063±0.204)(1.961±0.170),PM2.5+AngⅡ组(终浓度为50.00 μg/mL+1.25μmol/L、
100.00 μg/mL+2.50 μmol/L、200.00 μg/mL
+5.00 μmol/L、400.00 μg/mL+10.00 μmol/L、800.00 μg/mL+20.00 μmol/L)OD值分别为(2.299±0.077)(2.147±0.181)(1.806±0.094)(1.773±0.044)(1.812±0.509)。各处理组OD值与对照组相比,均低于对照组,差异均有统计学意义(P<0.05)。(2)48 h各处理组OD值为(2.425±0.015),PM2.5组(PM2.5终浓度分别为50.00、100.00、200.00、400.00、800.00 μg/mL)
OD值分别为(1.971±0.074)(1.904±0.135)(1.893±0.059)(1.160±0.270)(1.599±0.489),AngⅡ组(AngⅡ终浓度分别为1.25、2.50、5.00、10.00、20.00 μmol/L)OD值分別为(1.906±0.157)(1.677±0.137)(1.104±0.096)(1.086±0.163)
(1.671±0.201),PM2.5+AngⅡ组(终浓度为50.00 μg/mL+1.25μmol/L、100.00 μg/mL+
2.50 μmol/L、200.00 μg/mL+5.00 μmol/L、
400.00 μg/mL+10.00 μmol/L、800.00 μg/mL+
20.00 μmol/L)OD值分别为(1.691±0.104)(1.196±0.210)(0.942±0.412)(0.940±0.247)(0.443±0.104)。各处理组OD值均低于对照组比,比较差异均有统计学意义(P<0.05)。PM2.5在100.00、200.00、800.00 μg/mL时,AngⅡ在20.00 μmol/L时,与对应组别的PM2.5+AngⅡ处理相比差异均有统计学意义(P<0.05)。见图1、2。
PM2.5+AngⅡ(50.00 μg/mL+1.25 μmol/L);2示PM2.5(100.00 μg/mL),AngⅡ(2.50 μmol/L),PM2.5+AngⅡ(100.00 μg/mL+2.50 μmol/L);3示PM2.5(200.00 μg/mL),
AngⅡ(5.00 μmol/L),PM2.5+AngⅡ(200.00 μg/mL+5 μmol/L);4示PM2.5(400.00 μg/mL),AngⅡ(10.00 μmol/L),PM2.5+AngⅡ(400.00 μg/mL+10.00 μmol/L);5示PM2.5(800.00 μg/mL),AngⅡ(20.00 μmol/L),PM2.5+AngⅡ(800.00 μg/mL+20.00 μmol/L)。*P<0.05,**P<0.01,***P<0.005,****P<0.001,与对照组比较。
PM2.5+AngⅡ(50.00 μg/mL+1.25 μmol/L);2示PM2.5(100.00 μg/mL),AngⅡ(2.50 μmol/L),PM2.5+AngⅡ(100.00 μg/mL
+2.50 μmol/L);3示PM2.5(200.00 μg/mL),AngⅡ(5.00 μmol/L),PM2.5+AngⅡ(200.00 μg/mL+5.00 μmol/L);4示PM2.5(400.00 μg/mL),AngⅡ(10.00 μmol/L),PM2.5+AngⅡ(400.00 μg/mL
+10.00 μmol/L);5示PM2.5(800.00 μg/mL),AngⅡ(20.00 μmol/L),PM2.5+AngⅡ(800.00 μg/mL+20.00 μmol/L)。*P<0.05,**P<0.01,***P<0.005,****P<0.001,与对照组比较;ΔΔP<0.01,ΔΔΔP<0.005,与PM2.5+AngⅡ组比较。
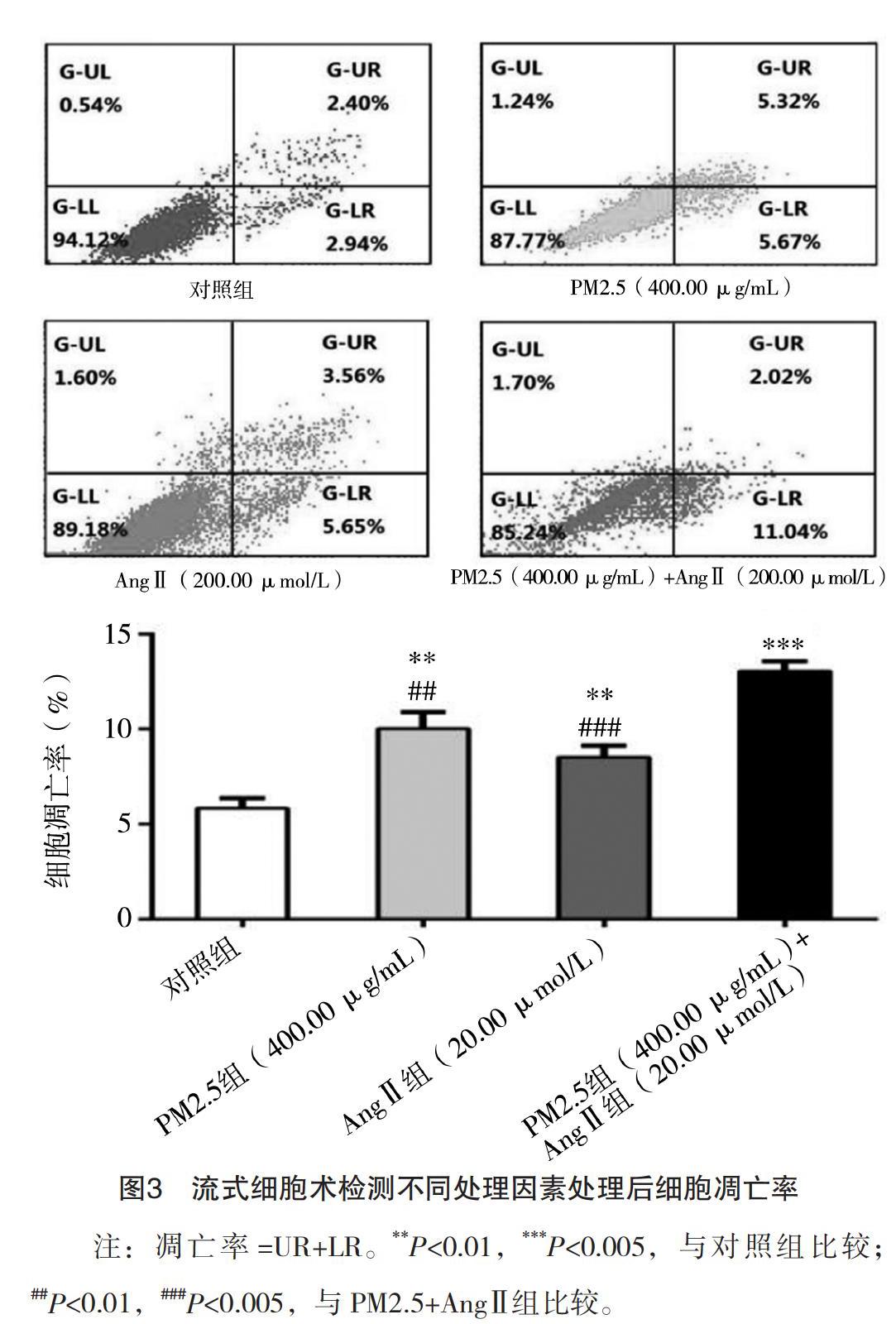
2.2 各组血管内皮细胞凋亡检测 流式细胞术检测结果显示,处理48 h后对照组细胞凋亡率为(5.837±0.527)%,PM2.5(400.00 μg/mL)组、AngⅡ(20.00 μmol/L)组、PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)组细胞凋亡率分为(10.017±0.876)、(8.513±0.612)、(13.047±0.520)%。各组细胞凋亡率与对照组比较差异均有统计学意义(P<0.01,P<0.01,P<0.005),PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)处理组与单用PM2.5(400.00 μg/mL)比差异有统计学意义(P<0.01),PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)处理与AngⅡ(20.00 μmol/L)组相比差异有统计学意义(P<0.005)。见图3。
2.3 凋亡相关蛋白P-AKT检测 48 h后,各组蛋白相对表达量:对照组为(2.094±0.420),PM2.5(400.00 μg/mL)组为(1.566±0.196),AngⅡ(20.00 μmol/L)组为(1.372±0.139),PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)组为(0.604±0.093)。各组与对照组相比,P-AKT的表达量均下降,差异均有统计学意义(P<0.05);PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)处理组与单用PM2.5(400.00 μg/mL)比较,差异有统计学意义(P<0.05);PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)处理组与AngⅡ(20.00 μmol/L)组比较,差异有统计学意义(P<0.05)。见图4、5。
3 讨论
随着城市化进程的加快,大气污染在我国愈加严重。大气污染物的细颗粒物对心血管疾病的影响在近些年的研究中已逐渐被证实。在临床观察统计中显示,大气颗粒物中PM2.5的升高可使多种心血管疾病(高血压、动脉粥样硬化,缺血性心脏病和心力衰竭等)的发病率明显上升[1,8-10]。2010年5月,美国心脏协会(AHA)指出细颗粒物暴露与心血管疾病发病率和死亡率存在明确的因果关系,细颗粒物暴露可视为心血管疾病发病和死亡的可改变危险因素。
血管内皮细胞为单层、裱衬在整个心血管系统内表面的上皮样细胞,是形成心血管封闭管道系统的形态基础,也是血管内膜的保护屏障。内皮细胞能够分泌多种活性物质,具有维持循环系统稳态的功能,包括调控血液与周围组织之间的物质交换、维持正常的血液流動、调控血流、调节炎症反应等。因此,正常的血管内皮细胞功能是维持心血管系统正常运行所必需的。研究表明血管内皮细胞功能与心脑血管疾病的发生和发展有着极为密切的关系,内皮细胞的凋亡则被认为是心血管疾病独立的危险因子[10]。动脉粥样硬化(Atherosclerosis,AS)是心血管疾病中最常见的疾病之一,血管内皮细胞凋亡参与了AS的发生、发展过程[11],被认为是动脉粥样硬化的始动环节。有研究表明PM2.5可通过上皮细胞间隙或借助巨噬细胞直接进入血液循环系统,对心血管能够产生直接毒性作用,PM2.5能直接接触血管内皮细胞引起其功能改变或损伤,最终促进心血管系统疾病的发生发展[11-12]。PM2.5作用于血管内皮细胞,导致内皮功能障碍,从而加速AS进展。内皮细胞损伤的一个重要因素就是血管组织局部RAS激活,该系统的活性肽AngⅡ(血管紧张素Ⅱ)与其受体AT1R结合后对内皮细胞功能及结构发挥损害作用。研究表明,AngⅡ可促进活性氧(ROS)的产生,过量的ROS能够损伤内皮细胞,促使细胞凋亡,导致血管内皮功能障碍[6,13]。
本实验采用体外细胞实验,将PM2.5与AngⅡ分成不同处理组,体外作用于HUVEC。CCK-8法检测各组细胞活性状况,结果显示:24 h时,各处理组OD值均低于对照组,差异均有统计学意义(P<0.05);48 h时,各处理组OD值均低于对照组,差异均有统计学意义(P<0.05);48 h时,PM2.5在100.00、200.00、800.00 μg/mL,AngⅡ在20.00 μmol/L时,与对应组别的PM2.5+AngⅡ处理相比,差异均有统计学意义(P<0.05)。说明在处理达到48 h时,PM2.5对AngⅡ诱导血管内皮细胞凋亡有明显的促进作用。后续实验中采用流式细胞术来检测PM2.5对AngⅡ诱导细胞凋亡的情况,48 h结果显示:各组细胞凋亡率与对照组比较,差异均有统计学意义(P<0.01)。PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)组与AngⅡ(20.00 μmol/L)组相比,差异有统计学意义(P<0.005),说明单独AngⅡ处理细胞后,细胞凋亡数增多,PM2.5+AngⅡ混合处理后,细胞凋亡数进一步升高。PM2.5(400.00 μg/mL)+AngⅡ(20.00 μmol/L)处理组与单用PM2.5(400.00 μg/mL)比较,差异均有统计学意义(P<0.01),说明PM2.5+AngⅡ的混合处理比PM2.5的单独处理,对细胞凋亡的影响更显著,进一步证实PM2.5对AngⅡ诱导血管内皮细胞凋亡具有促进作用。
PTEN(phosphatase and tensin hemology deleted on chromosome ten gene,PTEN)是一种抑癌基因,近些年来随着研究深入,科研人员发现PTEN在心肌肥大、动脉粥样硬化及支气管哮喘等领域也发挥重要的作用[14-15]。PTEN发挥经典的抑制细胞生长作用主要是通过其在膜上的磷酸酶活性抑制PI3K/AKT信号通路来实现。PTEN基因蛋白通过抑制PI3K/Akt的活性而调节细胞的生长,促进细胞凋亡。PI3K/AKT/eNOS信号通路在参与血管再生、心肌细胞代谢等发挥着重要作用[16]。AKT是一种丝氨酸/苏氨酸激酶,与细胞的生长和生存有关。而且Akt是抑制各种应激反应的生存因子,它的作用底物与许多生存相关蛋白,PI3K/AKT信号通路通过激活其下游通路,使AKT被激活为P-AKT,P-AKT通过磷酸化作用参与调节血管内皮细胞的迁移、增殖,参与抑制凋亡等[17-18]。有研究证实PI3K/AKT/eNOS信号通路具有抗氧化、抗凋亡等心肌保护作用,AngⅡ可引起PI3K/AKT/eNOS信号通路的损伤,导致心肌肥厚[19-20]。因此,为进一步探究PM2.5是否通过PI3K/AKT/eNOS信号通路增强AngⅡ对HUVEC的诱导凋亡作用。本实验是体外细胞实验,采用Western Blot法检测P-AKT的相对表达量。结果显示,与对照组相比,经PM2.5、AngⅡ、PM2.5+AngⅡ分别处理后P-AKT的表达量均下降,且PM2.5+AngⅡ组P-AKT的表达量明显低于单独PM2.5组和单独AngⅡ组,差异有显著性统计学意义(P<0.005),与相应的流式结果相符。进一步说明PM2.5对AngⅡ诱导血管内皮细胞凋亡可能是通过PI3K/Akt/eNOS信号通路来实现,具体机制还需进一步探究。
参考文献
[1] Liu S K,Cai S,Chen Y,et al.The effect of pollutional haze on pulmonary function[J].Thorac Dis,2016,8(1):E41-E56.
[2] Qiao L P,Cai J,Wang H L,et al.PM2.5 constituents and hospital emergency-room visit in Shanghai,China[J].Environ Sci Technol,2014,48(17):10406-10414.
[3]段振华,高绪芳,杜慧兰,等.成都市空气PM2.5浓度与呼吸系统疾病门诊人次的时间序列研究[J].现代预防医学,2015,42(4):41-44.
[4]苏恩勇,高传玉.内皮功能障碍与心血管疾病关系的研究进展[J].中华实用诊断与治疗杂志,2018,32(6):108-110.
[5]卿即娜,陈红阳,尹琳洁,等.血管内皮细胞衰老与心血管疾病的相关性[J].中国动脉硬化杂志,2019,27(2):161-168.
[6]位庚,李红蓉,常丽萍,等.血管紧张素Ⅱ诱导血管内皮细胞损伤及中药保护作用[J].中老年学杂志,2017,37(13):3354-3355.
[7]胡家新.PM2.5促进腹主动脉瘤形成机制的研究[D].南京:南京大学,2019.
[8]吴卫东,安珍,贵双俊,等.PM2.5暴露促进动脉粥样硬化发生发展的研究进展[J].山东大学学报(医学版),2018,56(11):18-26.
[9] Li H,Chen R,Meng X,et al.Short-term exposure to ambient air pollution and coronary heart disease mortality in 8 Chinese cities[J].Int J Cardiol,2015,197(15):265-270.
[10] Perez L,Wolf K,Hennig F,et al.Air pollution and atherosclerosis:a cross-sectional analysis of four European cohort studies in the ESCAPE study[J].Environ Health Perspect,2015,123(6):597-605.
[11]华畅,黄亮然,罗艳侠.PM2.5损伤血管内皮细胞的研究进展[J].中国预防医学杂志,2018,19(7):544-546.
[12]高麗云,聂林坤,李潇,等.大气细颗粒物PM2.5对心血管疾病损害机制的研究进展[J].新乡医学院学报,2018,35(7):551-553.
[13]张慧锋,张铎,王婧,等.血管紧张素II对血管内皮活性氧和线粒体功能的影响[J].吉林医学学院学报,2015,36(4):241-243.
[14]闫博阳,赵津璋,陈虹.PTEN在动脉粥样硬化中的表达及对血管内皮细胞增殖凋亡的影响研究[J].中国免疫学杂志,2018,34(5):745-750.
[15]薛锐,夏中元,孟庆涛.PTEN在神经系统损伤、心血管疾病发生发展中的作用研究进展[J].山东医药,2016,56(03):93-94.
[16]范亮亮,马立宁,彭元亮.PI3K/Akt信号通路与心力衰竭[J].生命科学研究,2015,19(1):85-90.
[17]苏志杰,赵丹丹,周凤华,等.定心方经PI3K/Akt通路抑制人脐静脉内皮细胞迁移的研究[J]辽宁中医杂志,2018,45(12):2667-2670.
[18]刘阳,李雪苓,李延恩.银杏叶提取物通过激活PI3K/AKT通路抑制IL-1β诱导血管内皮细胞的凋亡[J].临床和实验医学杂志,2019,18(4):365-369.
[19] Yao H,Han X,Han X.The cardioprotection of the insulin-mediated PI3K/Akt/m TOR signaling pathway[J].Am J Cardiovasc Drugs,2014,14(6):433-442.
[20] Wen Z,Mai Z,Chen Y,et al.Angiotensin Ⅱ receptor blocker reverses heart failure by attenuating local oxidative stress and preserving resident stem cells in rats with myocardial infarction[J].American journal of translational research,2018,10(8):2387-2401.
(收稿日期:2019-06-27) (本文编辑:周亚杰)

