腹腔镜下结肠癌根治术联合术后加速康复对患者胃肠功能影响及认知功能的作用
李胜杰

【摘要】 目的:探讨腹腔镜下结肠癌根治术联合术后加速康复对患者胃肠功能影响及认知功能的作用。方法:将66例结肠癌患者采用随机数字表法随机分为传统治疗组及加速康复组,每组各33例。两组均进行腹腔镜下结肠癌根治术,传统治疗组在术后行传统术后康复治疗,加速康复组在术后行加速康复治疗。比较两组患者术后康复治疗后的腹胀痛分级、胃肠反应分级、首次胃腸排气时间、术后出院时间、短期并发症发生率、MMES评分、S100β含量及NSE含量。结果:加速康复组患者腹胀痛分级、胃肠反应分级、首次胃肠排气时间、术后出院时间、短期并发症出现率、MMES评分、S100β含量及NSE含量均优于传统治疗组(P<0.05)。结论:腹腔镜下结肠癌根治术联合术后加速康复优于术后传统康复治疗,患者术后胃肠功能及认知功能恢复明显,各症状改善,远期疗效可观,值得临床应用与深入研究。
【关键词】 腹腔镜下结肠癌根治术 术后加速康复 胃肠功能 认知功能
Effect of Laparoscopic Radical Resection of Colon Cancer Combined with Accelerated Rehabilitation on Gastrointestinal Function and Cognitive Function in Patients with Colon Cancer/LI Shengjie. //Medical Innovation of China, 2020, 17(04): 0-028
[Abstract] Objective: To investigate the effect of laparoscopic radical resection of colon cancer combined with accelerated rehabilitation on gastrointestinal function and cognitive function of patients with colon cancer. Method: A total of 66 patients with colon cancer were randomly divided into the traditional treatment group and the accelerated rehabilitation group, 30 cases in each group. Both groups underwent laparoscopic radical resection of colon cancer. The traditional treatment group received the traditional rehabilitation treatment after operation, and the accelerated rehabilitation group received the accelerated rehabilitation treatment after operation. The abdominal distention, gastrointestinal reaction, first gastrointestinal exhaust time, postoperative discharge time, short-term complication rate, MMES score, S100 β content and NSE content were compared between the two groups. Result: The abdominal distension and pain grade, gastrointestinal reaction grade, first gastrointestinal exhaust time, postoperative discharge time, short-term complication rate, MMES score, S100 β content and NSE content in the accelerated rehabilitation group were better than those in the traditional treatment group, the differences were statistically significant (P<0.05). Conclusion: Laparoscopic radical resection of colon cancer combined with accelerated rehabilitation is superior to traditional rehabilitation. The recovery of gastrointestinal function and cognitive function after operation is obvious, the symptoms are improved, and the long-term effect is considerable. It can be used in clinical practice.
[Key words] Laparoscopic radical resection of colon cancer Accelerated rehabilitation after operation Gastrointestinal function Cognitive function
First-authors address: Dalian Central Hospital, Dalian 116003, China
doi:10.3969/j.issn.1674-4985.2020.04.006
结肠癌为我国消化系统常见癌症,外科手术为根治本病的最有效手段。传统式结肠癌根治手术在开腹条件下可直观地观察癌变部位、彻底清除癌变病灶,但对患者的创伤较大且术后并发症较多[1]。Jacobs博士早在1991年就通过腹腔镜技术镜下切除了结肠癌,经过二十多年的发展与探索,腹腔镜下结肠癌根治术以日趋成熟,得到国内外的广泛认可[2]。在2008年,NCCN已将腹腔镜下结肠切除术列为结肠癌临床指南中的治疗原则之一,逐渐取代传统式开放手术[3]。但直肠癌患者由于长期受到腹泻、腹痛、胃肠功能障碍等影响,加之肿瘤长期消耗身体逐渐消瘦,予手术治疗后可对患者进一步造成创伤,故对患者术后康复治疗显得格外重要[4]。随着腹腔镜手术治疗结肠癌的认识不断深入,术后加速康复(ERAS)的研究也随之进展。术后加速康复是指在围手术期采用一系列治疗干预措施,意在加快患者手术恢复速度,缩短住院天数及减少术后并发症等[5]。故本研究应用腹腔镜下根治术联合术后加速康复治疗结肠癌患者,并观察其对患者胃肠功能的影响及认知功能的作用,现报道如下。
1 资料与方法
1.1 一般资料 选取2018年6月-2019年6月收入本院普外科病房结肠癌患者66例纳入本研究,均符合《中国常见恶性肿瘤诊治规范》中结肠癌的诊断标准[6]。(1)纳入标准:①通过病理检测确诊为结肠癌的患者,年龄、性别无要求;②同意腹腔镜下手术治疗;③术前检查未发现其他器官转移;④既往无肿瘤病史,无化疗放疗史;④无肠梗阻、穿孔等并发症存在;⑤无凝血功能障碍;⑥患者同意参加,自愿知情。(2)排除标准:①病理提示怀疑者,不能明确诊断者;②合并其他恶性肿瘤;③此前做过腹部相关手术;④术前半个月行止痛相关治疗;⑤合并严重功能障碍威胁生命者;⑥中途接受其他中西医治疗;⑦各种原因导致出血或凝血障碍者,如白血病、继发性上消化道出血、尿毒症等。将66例患者按随机数字表法分为加速康复组与传统治疗组,每组各33例。加速康复组男女比为19︰14,年龄35~74岁,平均(55.28±4.14)岁;传统治疗组男女比为18︰15,年龄36~75岁,平均(56.11±4.29)岁。两组患者年龄、性别比较,差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 两组均行腹腔镜结肠癌根治手术,且行术者均为同一手术组成员。
1.2.2 加速康复组 (1)术后营养支持。术后24 h内控制液体流入,除患者血容量低下外,液体量输入应在2 000~2 500 mL以内,低血容量患者应注意输血及补液;术后早期进食遵从以下两点:其一患者术后过麻醉效应清醒后经口进少量水分,并予口香糖咀嚼,其二予患者术后24 h所需总能量20~30 kcal/(kg·d)的三分之一或二分之一经口服补充(根据患者所能接受程度予肠内免疫营养制剂,若服用后效果差,余下不足由蛋白质冲剂补充,每100 g蛋白质冲剂约补充能量393.2 kcal),最后患者不足能量由肠外营养给予,全方位保证患者能量充足。术后48 h根据患者各指征、症状及依从性,从第2天开始逐步减少肠外营养补充,增加肠内营养供应,并限制液体入量(此时应控制入量在1 000~1 500 mL/d以内),此阶段所需补充总能量与术后24 h内相同。术后72 h及长期根据患者接受程度继续增加肠内营养,争取早日取消肠外营养,直到患者完全恢复正常饮食(此过程应从果汁及粥类等流食开始,逐步过渡到正常饮食),此阶段液体入量应控制在500~1 000 mL/d以内。
(2)术后疼痛控制。采用多位点术后止痛方式:于术中切皮前,关腹前刀口部位静注浓度7.5 mg/mL罗哌卡因(生产厂家:AstraZeneca AB;国药准字H20100105;规格:75 mg/10 mL),行切口部位阻滞。术后应用帕瑞昔布(生产厂家:Pharmacia&Upjohn CompanyLLC;国药准字H20171071;规格:40 mg)静脉注射40 mg/次,2次/d,术后多次行疼痛评分,若疼痛评分超过3分,即再次予帕瑞昔布静脉注射40 mg/次。(3)术后早期活动管理:术后麻醉清醒后即鼓励患者独自站立或在家属搀扶下站立;术后24 h后鼓励患者下床做可耐受的轻微活动,活动时间在2 h左右,嘱患者量力而行;术后48 h及以后在每次固定2 h的地面活动基础上,根据患者耐受程度逐渐增加运动量。
1.2.3 传统治疗组 (1)术后营养支持:禁食水,直到患者胃肠功能正常运转,此期间全程予肠外营养以保证体内所需总能量;胃肠道功能正常后予小剂量流食,开始予肠内营养,总能量保证在20~30 kcal/(kg·d),如不够则剩下能量由肠外营养给予,主要依靠患者自身感觉由肠外营养逐步过渡到肠内营养再到正常经口进食。(2)术后疼痛管理:术中切皮前及关腹前不行切口部位阻滞;术后多次行疼痛评分,若患者疼痛评分超过3分时,予静注帕瑞昔布40 mg/次。(3)术后早期活动管理:术后48 h内不规定患者下地活动,48 h后让患者根据自身情况下地小幅度活动,不限制活动时间。
1.3 观察指标及评价标准 自制腹胀分级、腹痛分级及胃肠反应分级问卷表,均在腹腔镜结肠癌术后每12小时进行一次问卷评级,取最高级别。腹胀分级:0级(0分)无腹胀感;Ⅰ级(1分)轻度腹胀,患者自觉腹内有气体,或见腹部轻度隆起;Ⅱ级(2分)中度腹胀,可伴恶心,影响患者休息;Ⅲ级(3分)中度腹胀,可伴呕吐,患者烦躁不安无法入睡[7]。腹痛分级:0分咳嗽或主被動运动时无疼痛;1分咳嗽或主被动运动时有疼痛;2分深呼吸有疼痛发生;3分静息状态下疼痛;4分静息状态下剧烈疼痛,难以忍受[8]。胃肠反应分级:0级(0分)无胃肠反应;Ⅰ级(1分)恶心无呕吐;Ⅱ级(2分)呕吐恶心1~2次/d;Ⅲ级(3分)呕吐恶心3次/d,影响休息[9]。监测术后首次胃肠排气时间、术后出院时间、短期并发症出现率。认知功能评判:采用MMES精神状态评估表评估术前、术后6 h、术后24 h患者的认知水平[10]。并采用酶联免疫吸附法测定神经功能指标S100β、NSE含量。
1.4 统计学处理 使用SPSS 18.0统计软件进行分析,计量资料采用(x±s)表示,比较采用t检验,计数资料采用率(%)表示,比较采用字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者术后腹胀分级比较 经治疗后加速康复组术后腹胀率为39.39%,传统治疗组术后腹胀率为69.70%,差异有统计意义(P<0.05)。见表1。
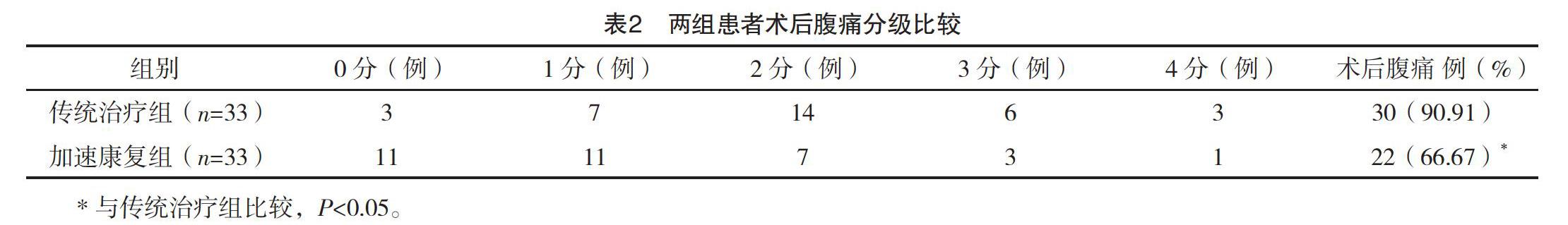
2.2 两组患者术后腹痛分级比较 经治疗后加速康复组术后腹痛率为66.67%,传统治疗组术后腹痛率90.91%,提示加速康复组术后止痛效果优于传统治疗组(P<0.05)。见表2。
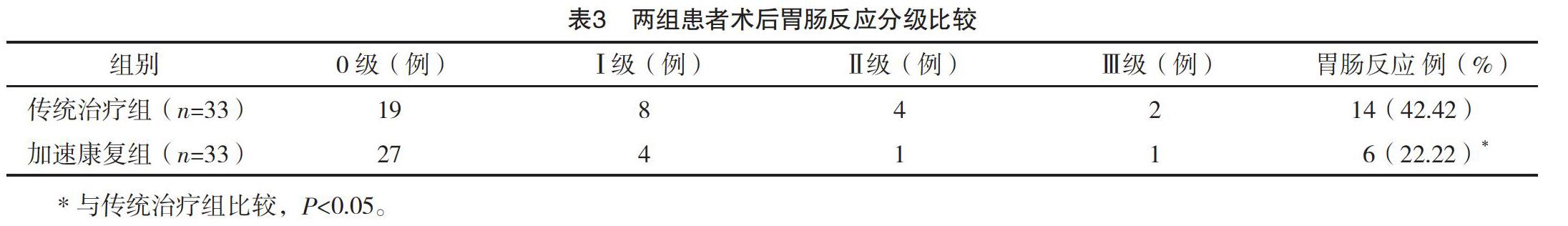
2.3 两组患者术后胃肠反应分级比较 治疗后加速康复组术后胃肠反应率为22.22%,传统治疗组胃肠反应率为42.42%,提示加速康复组术后胃肠功能恢复较传统治疗组更好(P<0.05)。见表3。
2.4 两组患者术后首次胃肠排气时间、术后出院时间、短期并发症发生情况比较 加速康复组术后排期时间及术后住院天数均少于传统治疗组,且并发症出现率远低于传统治疗组(P<0.05)。见表4。
2.5 两组患者MMES评分、S100β、NSE含量比较 术前两组MMES评分、S100β、NSE含量比较,差异均无统计学意义(P>0.05)。术后6、24 h,两组患者MMES评分较术前均有下降(P<0.05),且在术后6、24 h两个时间点传统治疗组MMES评分均低于加速康复组(P<0.05)。术后6、24 h两组患者S100β、NSE含量均高于术前(P<0.05),且在术后6、24 h两个时间点传统治疗组S100β、NSE含量均高于加速康复组(P<0.05)。见表5。
3 讨论
据统计,2012年全球约有70万死亡病例与癌症有关[11]。结肠癌患者长时间受到腹泻,腹胀等症状的困扰,加之恶性肿瘤消耗性疾病的特性,致患者身心疲惫,体重下降,抵抗力低下。虽腹腔镜结肠癌根除术已普及,对患者所造成的创伤也远低于开腹式手术,但仍对患者身体造成不小的打击,故新模式的术后康复起着重要作用。
在传统术后康复理念中,早期3~4 d患者的能量补给只能通过静脉给予,此期间需要禁食水[12],但加速康复理念认为应尽早进行经口进食,后根据患者的耐受程度逐步过渡为正常饮食,在能量补给不足时才应用肠外营养支持[13-14]。大量研究表明,早期的经口进食不仅不会引起术后并发症的发生,还可利于患者术后消化道功能的恢复、免疫力的提升、营养水平的充足,并可抑制炎性变态反应的发生[14-16]。术前患者一般会进行增强CT、胃肠镜以及禁食水等,这些操作及检查均会对肠道功能造成干扰,严重可致肠道蠕动障碍,菌群失调甚至发生转移,形成其他部位感染而引起休克,危害生命[17]。与此同时,患者在受到手术创伤后,处于高度应激状态下,会造成免疫力进一步低下,进而影响整个消化道功能。术后早期经口进食可尽早恢复肠道功能,刺激肠道激素分泌及免疫因子的产生,使肠道恢复正常运转,预防肠道菌群位移,调节肠道免疫机制,对结肠癌患者术后肠道恢复有着重要生理及肠道功能重建的双重意义[18]。术后长期卧床休养可致患者全身肌肉萎缩,消化功能减退,并增加呼吸系统神经系统等并发症的风险,而术后早期活动可有效缩短患者恢复周期,使消化功能不至于减退,有促进肠道蠕动、加快排气、预防并发症发生等优势[19]。且有效的术后止痛可使患者尽早地投入到术后活动中,从而保证术后加速康复的顺利进行。术后疼痛控制为加速康复治疗中重要的一环,因术后患者的活动对疼痛管理有着重要要求,若疼痛控制不理想,患者则无法进行有效的术后活动,进而长期卧床,部分患者因长期卧床又出现各种慢性并发症或慢性疼痛,加速康复的说法也就无从谈起,故术后疼痛控制特别被强调[20]。在术后加速康复中采用的是外科多模式镇痛,其对患者肠道功能的恢复及过渡到经口饮食的过程中起到了保障作用。
在本研究中,术后6、24 h两组患者MMES评分较术前均有下降,说明此时两组患者的认知功能均有下降,但这两个时间点加速康复组水平始终高于传统治疗组,提示加速康复组在认知方面由于传统治疗组,且在术后24 h时,两组MMES评分均有恢复,加速康复组已恢复趋近于正常水平,而相比而言传统治疗组恢复较慢,提示术后加速康复对于恢复患者的术后认知水平优于传统治疗组。在本研究中,加速康复组术后腹胀痛分级、胃肠反应分级及胃肠排期时间显示均优于传统治疗组,提示加速康复组患者术后胃肠功能的恢复更好。
综上所述,腹腔镜下结肠癌根治术联合术后加速康复优于术后传统康复治疗,患者术后胃肠功能及认知功能恢复明显,各症状改善,远期疗效可观,可在临床应用。
参考文献
[1]江弢,孙晶,裘正军.腹腔镜与开放手术治疗结肠癌的远期疗效比较[J].复旦学报(医学版),2011,38(3):211-215.
[2] Jacobs M,Verdeja J C,Goldstein H S.Minimally invasive colon resection (laparoscopic colectomy)[J].Surgical Laparoscopy Endoscopy & Percutaneous Techniques,1991,1(3):144-150.
[3]陸世明.腹腔镜结肠癌根治术与开腹结肠癌根治术临床疗效分析[J].白求恩医学杂志,2013,11(1):293-294.
[4] Osland E J,Memon M A.Early postoperative feeding in resectional gastrointestinal surgical cancer patients[J].World Journal of Gastrointestinal Oncology,2010,2(4):187-191.
[5]黎介寿.营养支持治疗与加速康复外科[J].肠外与肠内营养,2015,22(2):65-67.
[6]中华人民共和国卫生部医政司.中国常见肿瘤诊治规范[M].2版.北京:北京医科大学,中国协和医科大学联合出版社,1991:11-18.
[7]郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002.
[8] OFlynn H,Murphy L L,Ahmad G ,et al.Pain reliefinout patienthy stereoscopy:asurver yofcurrent UK clinical practice[J]. Eur Job stet Gynecol Biol,2011,154(1):9-15.
[9]管忠震.临床肿瘤化疗研究动态—参加第五届欧洲临床肿瘤学大会汇报[J].癌症,1989,8(6):464-469.
[10]王根生,卢锡华,杨青存,等.右美托咪定辅助麻醉对结肠癌患者术中血流动力学及术后认知功能的影响[J].中国临床药理学杂志,2018,34(16):15-18.
[11] Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012[J].Ca A Cancer Journal for Clinicians,2015,65(2):87-108.
[12]汪曉东,李易,李立.结直肠术后早期经口进食的临床研究现状[J].结直肠肛门外科,2009,15(4):287-289.
[13]曹兰玉,魏力,郭婷,等.结直肠癌患者术后早期经口进食的有效性及安全性的Meta分析[J].中国全科医学,2014,17(3):308-313.
[14] Dongping H,Zhufeng S,Jianwei H,et al.Early enteral nutrition in combination with parenteral nutrition in elderly patients after surgery due to gastrointestinal cancer[J].International Journal of Clinical & Experimental Medicine,2015,8(8):13937-13945.
[15] Liu X,Wang D,Zheng L,et al.Is Early Oral Feeding after Gastric Cancer Surgery Feasible? A Systematic Review and Meta-Analysis of Randomized Controlled Trials[J].PLoS One,2014,9(11):e112062.
[16] Takaaki F,Hiroki M,Toshinaga S,et al.Benefit of Oral Feeding as Early as One Day After Elective Surgery for Colorectal Cancer: Oral Feeding on First Versus Second Postoperative Day[J].International Surgery,2014,99(3):211-215.
[17]王波,宋怀宇,杨建荣.肠道屏障功能障碍的干预研究进展[J].世界华人消化杂志,2011,19(21):2251-2256.
[18] Sigalet D L,Mackenzie S L,Hameed S M.Enteral nutrition and mucosal immunity: implications for feeding strategies in surgery and trauma[J].Canadian Journal of Surgery,2004,47(2):109-116.
[19]许剑民,钟芸诗,朱德祥,等.促进术后恢复综合方案在结直肠癌根治术中的应用[J].中华胃肠外科杂志,2007,10(3):238-244.
[20] Scott M J,Baldini G,Fearon K C,et al.Enhanced Recovery After Surgery (ERAS) for gastrointestinal surgery, part 1: pathophysiological considerations[J].Acta Anaesthesiol Scand,2015,59(10):1212-1231.
(收稿日期:2019-12-18) (本文编辑:周亚杰)

