血清CEA水平对EGFR-TKI治疗的非小细胞肺癌患者预后的评估价值


【摘要】 目的:探討血清癌胚抗原(CEA)水平对表皮生长因子受体酪氨酸激酶受体抑制剂(EGFR-TKI)治疗的非小细胞肺癌患者预后的评估价值。方法:选择2017年1月-2018年4月在本院进行EGFR-TKI治疗的非小细胞肺癌患者68例的资料进行回顾性分析。在患者接受EGFR-TKI治疗之前的1个月均对其血清的CEA水平进行检查,按照血清CEA浓度是否高于5.0 ng/mL分为血清CEA正常组38例与血清CEA升高组30例。比较两组生存情况,筛选EGFR-TKI治疗非小细胞肺癌患者预后的影响因素。结果:血清CEA正常组无进展生存时间和总生存时间均高于血清CEA升高组,差异均有统计学意义(P<0.05);年龄≥60岁、吸烟、TNM分期高、血清CEA水平≥5.0 ng/mL是影响EGFR-TKI治疗非小细胞肺癌患者预后的独立因素(P<0.05)。结论:血清CEA水平增高的非小细胞肺癌患者使用EGFR-TKI治疗的预后较差,血清CEA水平可以作为该类患者预后评估的指标,但还需要进行大规模试验的验证。
【关键词】 非小细胞肺癌 靶向治疗 血清标志物 癌胚抗原
The Value of Serum CEA Level in Evaluating the Prognosis of Patients with Non-small Cell Lung Cancer Treated with EGFR-TKI/LI Shuwei. //Medical Innovation of China, 2020, 17(09): -117
[Abstract] Objective: To investigate the value of serum carcinoembryonic antigen (CEA) level in the prognosis of patients with non-small cell lung cancer treated with epidermal growth factor receptor tyrosine kinase receptor inhibitor (EGFR-TKI). Method: The data of 68 patients with non-small cell lung cancer who received EGFR-TKI treatment in our hospital from January 2017 to April 2018 were retrospectively analyzed. CEA levels in serum were measured 1 month before patients were treated with EGFR-TKI, according to whether the serum CEA concentration was higher than 5.0 ng/mL, they were divided into the 38 cases of serum CEA normal group and
30 cases of serum CEA elevation group. The survival of the two groups was compared, the factors influencing the prognosis of patients with non-small cell lung cancer treated with EGFR-TKI were screened. Result: The progression-free survival time and total survival time of patients in the serum CEA normal group were higher than those in the serum CEA elevation group, the differences were statistically significant (P<0.05). The age of patients ≥ 60 years old, smoking, high TNM stage, and serum CEA level ≥ 5.0 ng/mL were independent factors affecting the prognosis of patients with non-small cell lung cancer treated with EGFR-TKI (P<0.05). Conclusion: Patients with non-small cell lung cancer with elevated serum CEA have a poor prognosis when treated with EGFR-TKI. Serum CEA level can be used as an indicator of prognosis in these patients, but large-scale trials are still needed to verify this.
[Key words] Non-small cell lung cancer Targeted therapy Serum markers Carcino-embryonic antigen
First-authors address: Chaoyang Second Hospital, Chaoyang 122000, China
doi:10.3969/j.issn.1674-4985.2020.09.028
肺癌在所有恶性肿瘤中的发病率与致死率排名第一,这其中非小细胞肺癌占据的比例超过85%[1-2]。对于非小细胞肺癌的研究已经持续较长时间,但至今没有一种可以令人满意的治疗方法[3-4]。近些年源自驱动基因实现个体化靶向治疗的概念被成功研發,而分子靶向药物,表皮生长因子受体酪氨酸激酶受体抑制剂(EGFR-TKI)就是其中之一[5]。该类药物与ATP竞争细胞内酪氨酸激酶位点,抑制细胞内酪氨酸激酶磷酸化,抑制EGFR信号传导,阻碍该通路下游的反应发生,达到抗肿瘤的目的。该类药物目前主要有吉非替尼与厄洛替尼两种[6-7]。目前研究结果显示部分血清标志物在肺癌的治疗过程中对于治疗效果的监测具有比较好的指导意义,癌胚抗原(carcino-embryonic antigen, CEA)就是被普遍接受的指标[8]。本研究选择2017年1月-2018年4月在本院进行EGFR-TKI治疗的非小细胞肺癌患者68例的资料进行回顾性分析,对血清CEA水平在EGFR-TKI治疗非小细胞肺癌患者预后中的评估价值进行探讨,现报告如下。
1 资料与方法
1.1 一般资料 选择2017年1月-2018年4月在本院进行EGFR-TKI治疗的非小细胞肺癌患者68例的资料进行回顾性分析,其中男37例,女31例,平均年龄(56.51±13.17)岁,平均BMI(23.16±3.64)kg/m2,腺癌56例,非腺癌12例。(1)纳入标准:经过细胞学或者组织学确诊为非小细胞肺癌;按照医院的方案进行治疗,依从性良好。(2)排除标准:同时合并多种癌症;重要数据缺失,无法计算;合并有消化系统、神经系统、免疫血液系统等疾病。在患者接受EGFR-TKI治疗之前的1个月均对其血清的CEA水平进行检查,按照血清CEA浓度是否高于5.0 ng/mL分为血清CEA正常组38例与血清CEA升高组30例。研究经医院伦理学委员会批准。
1.2 方法 患者均给予吉非替尼片[生产厂家:齐鲁制药(海南)有限公司,批准文号:国药准字H20163465,规格:0.25 g]口服或给予盐酸厄洛替尼片(生产厂家:上海罗氏制药有限公司,批准文号:国药准字J20170030,规格:150 mg)口服,剂量为:吉非替尼片250 mg/d,盐酸厄洛替尼片150 mg/d,直至患者出现疾病进展、无法耐受的副反应或者死亡。
1.3 观察指标 记录患者的一般临床情况,包括年龄、性别、BMI、吸烟、病理类型等。对患者完成为期16个月的随访,比较血清CEA正常组与血清CEA升高组患者的无进展生存曲线和总生存曲线。筛选EGFR-TKI治疗非小细胞肺癌患者预后的影响因素。
1.4 统计学处理 采用SPSS 20.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验。采用Cox比例风险模型进行影响因素分析,生存分析采用Kaplan-Meier法进行计算。以P<0.05为差异有统计学意义。
2 结果
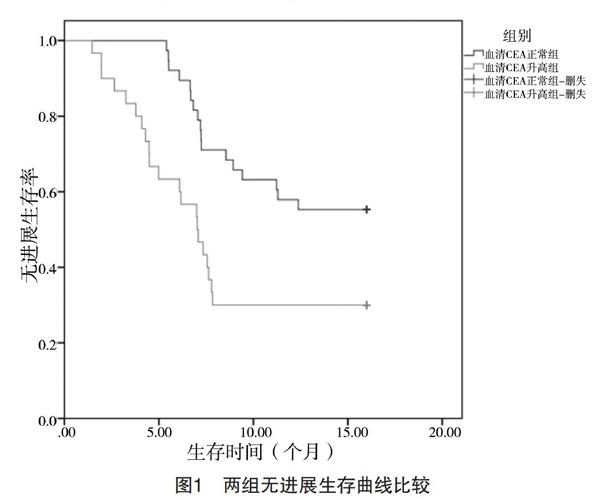
2.1 两组无进展生存曲线和总生存曲线比较 血清CEA正常组无进展生存时间为(12.348±1.365)个月,高于血清CEA升高组的(8.431±1.881)个月,差异有统计学意义(t=9.586,P<0.05);血清CEA正常组总生存时间为(14.739±0.757)个月,高于血清CEA升高组的(11.204±1.853)个月,差异有统计学意义(t=9.822,P<0.05),见图1、2。
2.2 影响EGFR-TKI治疗非小细胞肺癌患者预后的单因素分析 以全部患者的生存时间中位数为截点,将患者分为对照组和病例组(病例组生存时间短于对照组)进行单因素分析,结果显示,年龄、吸烟、TNM分期和血清CEA水平是影响EGFR-TKI治疗非小细胞肺癌患者预后的因素(P<0.05),见表1。
2.3 影响EGFR-TKI治疗非小细胞肺癌患者预后的多因素分析 将患者的生存时间作为因变量,采用Cox比例风险模型进行多因素影响分析,赋值如下,年龄(0=<60岁,1=≥60岁),吸烟(0=否,1=是),血清CEA水平(0=<5.0 ng/mL,1=≥5.0 ng/mL),变量纳入方法为“进入”,结果显示,患者的年龄≥60岁、吸烟、TNM分期高、血清CEA水平≥5.0 ng/mL是影响EGFR-TKI治疗非小细胞肺癌患者预后的独立因素(P<0.05),见表2。
3 讨论
血清肿瘤标记物已经被广泛使用在手术后恶性肿瘤患者的随访工作中。目前已经使用的血清肿瘤标记物种类较多,比如前列腺癌患者的前列腺特异抗原以及肝癌患者的甲胎蛋白与结肠癌的CEA等[9-10]。Gold等[11]于1965年第1次阐述了CEA作为抗原在胃肠癌细胞中的表达情况,而少数良性病变与不良的个人习惯也可能导致体内CEA水平的增高。但是良性疾病所能够引起的CEA的增幅较小。30%~70%的非小细胞肺癌患者会出现异常的血清CEA增高,在腺癌与晚期的患者之中较为常见[12]。在肿瘤的发生和发展过程中会导致血清中的CEA过度表达。国外研究显示,表达过度的CEA可以对肿瘤细胞起到保护效果,避免由于肿瘤细胞与细胞外基质的广泛接触而诱导肿瘤细胞出现凋亡,EGFR与CEA的表达可能与患者的结肠癌出现肝转移相关[13]。Abdel-Aziz等[14]的研究结果显示,超过80%的大肠癌患者血清标本中EGFR与CEA的表达均为阳性。
EGFR-TKI的治疗在近些年的研究热度非常高。但是目前鉴于EGFR基因突变的检测方法、实验室的条件、价格等的制约,在实际临床使用过程中受到了较大的限制。本研究结果中显示,以血清CEA浓度分组的两组患者中,无论是无疾病进展生存率还是总生存率,血清CEA正常组的数据均优于血清CEA升高组,差异均有统计学意义(P<0.05)。在危险因素的计算结果中也显示,治疗前患者血清CEA的浓度是接受EGFR-TKI治疗的非小细胞肺癌患者预后的独立危险因素(P<0.05)。提示血清CEA水平可以作为对吉非替尼或者厄洛替尼治疗效果的预测生物标记物。血清CEA的检查方法成熟,过程快捷,价格低廉,可以取得定量的结果且行多次重复检测,使通过对患者治疗过程中的动态血清CEA检测成为可能。根据之前的结果,吉非替尼和厄洛替尼对于EGFR突变型或者野生型患者的药物治疗效果比较,差异无统计学意义[15-16]。鉴于此,在本研究中并没有把两种药物分别对待。现有分子学研究结果表明,EGFR突变体的下游分子Akt与STAT3/5等的激活过程,在细胞的抗凋亡过程中扮演着极其重要的角色[17]。利用免疫组化技术已经发现被激活的Akt和吉非替尼的治疗效果提升有着密切的联系。
综上所述,血清CEA水平增高的非小细胞肺癌患者使用EGFR-TKI治疗的预后较差,血清CEA水平可以作为该类患者预后评估的指标,但还需要进行大规模试验的验证。
参考文献
[1]徐秋萍,何斐,刘志强,等.性别对非小细胞肺癌预后的影响分析[J].中华流行病学杂志,2017,38(2):244-247.
[2]宋宝英,贾金虎,辛娇娇.棘皮动物微管相关类蛋白4-间变性淋巴瘤激酶与耐药性非小细胞肺癌研究进展[J].中国医药,2017,12(1):150-152.
[3]李春雨,曲仪庆.Twist基因在非小细胞肺癌中的研究进展[J].国际呼吸杂志,2017,37(2):140-144.
[4]毕乙瑶,张莹,艾力曼·马合木提,等.非小细胞肺癌合并静脉血栓栓塞症危险因素研究[J].国际呼吸杂志,2017,37(2):112-115.
[5]李佳旻,洪群英,张新,等.化疗序贯EGFR-TKI治疗晚期非小细胞肺癌EGFR-TKI获得性耐药患者的效果及安全性[J].中华医学杂志,2014,94(30):2342-2345.
[6]张其程,徐克.自噬在EGFR-TKI类肿瘤靶向药物对肺癌的治疗和耐药中作用的研究进展[J].中国肺癌杂志,2016,19(9):607-614.
[7] Mok T S,Wu Y L,Thongprasert S,et al.Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma[J].N Engl J Med,2009,361(10):947-957.
[8]余婧,孙丽.中老年体检人群CCL18和CEA表达水平检测在膀胱癌的应用价值[J].检验医学与临床,2017,14(7):1006-1008.
[9]张亚男,赵宗兴,张亚坤,等.血清肿瘤标记物在肺癌诊断中的意义[J].中国实验诊断学,2014,18(2):219-222.
[10]张黎,姜姗,干银娣,等.血清肿瘤标记物联合检测在肺癌诊断中的应用价值[J].河北医药,2013,35(16):2442-2443.
[11] Gold P,Freedman S O.Demonstration of tumor-specific antigensin human colonic carcinomata by immunological tolerance andabsorption techniques[J].J Exp Med,1965,121:439-462.
[12] Matsuoka K,Sumitomo S,Nakashima N,et al.Prognostic value of carcinoembryonic antigen and CYFRA21-1 in patients with pathological stage I non-small cell lung cancer[J].Eur J Cardiothorac Surg,2007,32(3):435-439.
[13] Ordo?ez C,Screaton R A,Ilantzis C,et al.Human carcinoembryonic antigen functions as a general inhibitor of anoikis[J].Cancer Res,2000,60(13):3419-3424.
[14] Abdel-Aziz M M,Lotfy M,El-Kady I M,et al.Mutant p53 protein in the serum of patients with colorectal cancer: Correlation with the level of carcinoembryonic antigen and serum epidermal growth factor receptor[J].Cancer Detect Prev,2009,32(4):329-335.
[15] Kim S T,Lee J,Kim J H,et al.Comparison of gefitinib versus erlotinib in patients with nonsmall cell lung cancer who failed previous chemotherapy[J].Cancer,2010,116(12):3025-3033.
[16] Maemondo M,Inoue A,Kobayashi K,et al.Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J].N Engl J Med,2010,362(25):2380-2388.
[17] Cappuzzo F,Magrini E,Ceresoli G L,et al.Akt phosphorylation and gefitinib efficacy in patients with advanced non-small-cell lung cancer[J].J Natl Cancer Inst,2004,96(15):1133-1141.
(收稿日期:2019-10-16) (本文編辑:姬思雨)
通信作者:李树维

