背根神经节p-CaMKⅡ表达上调在糖尿病神经痛大鼠中的作用
费雪瑜,邰昭霞,陈卢杭,王涵芝,瞿思颖,何晓芬,方剑乔*,蒋永亮*
(1. 浙江中医药大学第三临床医学院康复医学院,杭州 310053; 2. 浙江省针灸神经病学研究重点实验室,杭州 310053; 3. 浙江中医药大学针灸研究所,杭州 310053)
本实验通过一次性大剂量(65 mg/kg)注射链脲佐菌素(STZ)构建1型糖尿病神经痛(DNP)大鼠模型,通过观察DNP大鼠不同阶段CaMKII的表达情况,明确其在糖尿病神经痛模型产生与维持的不同时期的活化情况,为探索糖尿病神经痛不同阶段的针对性治疗新靶点提供理论支持。
1 材料与方法
1.1 材料
1.1.1 实验动物
选用6周龄的清洁级成年健康雄性SD大鼠41只,体重(180 ± 20)g,购自中国科学院上海实验动物中心【SCXK(沪)2018-0006】,由浙江中医药大学实验动物中心【SYXK (浙) 2018-0012】饲养。所有实验均符合实验动物伦理学要求(伦理审批号为:IACUC-20180723-08)。
1.1.2 主要仪器与试剂
仪器:足底热辐射测痛仪(37360,意大利UGO BASILE),冰冻切片机(NX50 HOP,德国Thermo),A1R共聚焦显微镜(Nikon Elements AR,日本Nikon);试剂:链脲佐菌素STZ(S0130,美国Sigma),兔抗p-CaMKⅡ(ab32678,美国Abcam),CaMKⅡ抑制剂KN93(422708-1MG,美国Sigma),AlexaFluor®488驴抗兔IgG(H+L)(138271,美国Jackson)。
1.2 方法
1.2.1 糖尿病大鼠模型制备
将SD大鼠禁食16 h后,按照65 mg/kg的剂量对模型组大鼠予以一次性腹腔注射STZ溶液,STZ溶解于0.1 mmol/L的柠檬酸/柠檬酸钠缓冲液中,pH调为4.5,所有溶液均现配现用。在STZ注射第7天对大鼠禁食8 h后进行尾静脉采血测定其血糖水平,空腹血糖水平> 16.7 mmol/L的SD大鼠被认为糖尿病模型建立成功[8]。
艺术家用各种各样的材料、工具、题材和表现方法来制作多彩的效果。通过他们不停的实践和创作,肌理的效果也变得多种多样,并且受到了人们广泛的喜爱。肌理技法的使用,不仅让我们在视觉上有很大的冲击力,而且还改善了工笔花鸟画的美感,为现代的工笔花鸟画发展起到了很好的创新作用。
1.2.2 实验分组与流程
本实验主要分两部分进行,(1)观察STZ注射后7、14、21、28 d不同时相DNP大鼠热辐射刺激的缩足反应时间(paw withdrawal latency,PWL)变化及DRG上p-CaMKII阳性细胞表达情况;(2)观察足背注射KN93对DNP大鼠PWL的影响。
(1)取21只健康雄性SD大鼠,选取15只禁食16 h后注射STZ,其余6只大鼠作为正常组注射等量柠檬酸/柠檬酸钠缓冲液,分别观察记录大鼠STZ注射前(Base)、注射后7 d(Day 7)、14 d(Day 14)、21 d(Day 21)、28 d(Day 28)PWL变化情况,上述各时间点各取3只大鼠L4-L6 DRG,采用免疫荧光方法检测p-CaMKII阳性细胞表达情况。
(2)取20只健康雄性SD大鼠,随机分为正常+生理盐水(Control + NS,n=6)组和STZ腹腔注射组(n=14),剔除造模未成功大鼠2只,将STZ诱导成功的DNP大鼠分为模型+生理盐水(DNP + NS,n=6)组和模型+KN93(DNP + KN93,n=6)组。观察KN93或NS干预前和干预1 h后PWL。
1.2.3 热痛阈检测
将大鼠足底对热辐射刺激的缩足反应时间(paw withdrawal latency,PWL)作为大鼠痛阈检测指标。在开始测痛前使大鼠在透明塑料盒中适应30 min,将热辐射刺激放置在左后足正下方的玻璃板下,当大鼠缩足时,刺激自动停止并记录下时间。为防止大鼠后爪受伤,将最长刺激时间设定为20 s,热辐射刺激强度设定为40%,连续测量5次,除去最大最小值,取3次平均值,每次测量间隔5 min。
1.2.4 免疫荧光法检测DRG神经元上p-CaMKⅡ阳性细胞表达
用戊巴比妥钠(80 mg/kg)腹腔麻醉大鼠,预冷生理盐水和4%多聚甲醛依次行主动脉灌注,取出左侧L4-L6 DRG,置于4%多聚甲醛中固定,经15%和30%蔗糖溶液梯度脱水直至组织在4℃下沉底,液氮速冻。用OCT包埋后冰冻切片机切片(10 μm),TBST漂洗10 min × 6次后于37℃恒温水浴箱中封闭1 h,加入兔抗p-CaMKⅡ(1∶800)4℃下孵育过夜,次日37℃复温1 h后用TBST漂洗10 min × 6次,加入AlexaFluor®488驴抗兔IgG(H+L)(1∶800)孵育1 h后用漂洗10 min × 6次(避光),将玻片置于避光环境自然风干后使用抗荧光淬灭剂封片。在A1R共聚焦显微镜下进行拍片,选用Image J图像分析系统计算阳性细胞数。每组3只大鼠,每只大鼠的L4-L6 DRG分别取4 ~ 6张不连续切片,并计算平均阳性细胞数。
1.2.5 药物干预
将KN93溶于生理盐水中,配置为2 mmol/L的KN93溶液,溶液现配现用。干预方式参照Zhou等[9]的方法,选取大鼠左后足足背进行药物注射,每只大鼠注射体积为50 μL。在STZ注射后第14天,DNP+KN93组注射KN93溶液,Control+NS组和DNP+NS组大鼠注射生理盐水。
1.3 统计学分析
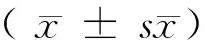
2 结果
2.1 糖尿病模型的建立
本研究通过一次性腹腔注射STZ(65 mg/kg)破坏胰岛β细胞以建立胰岛素缺乏的1型糖尿病大鼠模型,注射后第7天,与正常组相比,模型组大鼠空腹血糖显著升高(P< 0.01),并维持到第28天,结果见图1A;模型组大鼠体重也出现明显降低(P< 0.01),并且这种差异同样维持到第28天,结果见图1B。
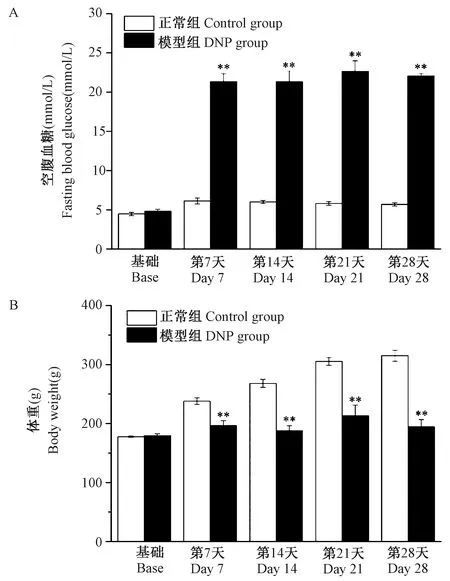
注:与正常组相比,**P < 0.01。图1 DNP大鼠不同时相空腹血糖(A)和体重(B)(n=6)Note. Compared with the control group,**P < 0.01.Figure 1 Fasting blood glucose (A) and body weight (B) in different phases of DNP rats(n=6)
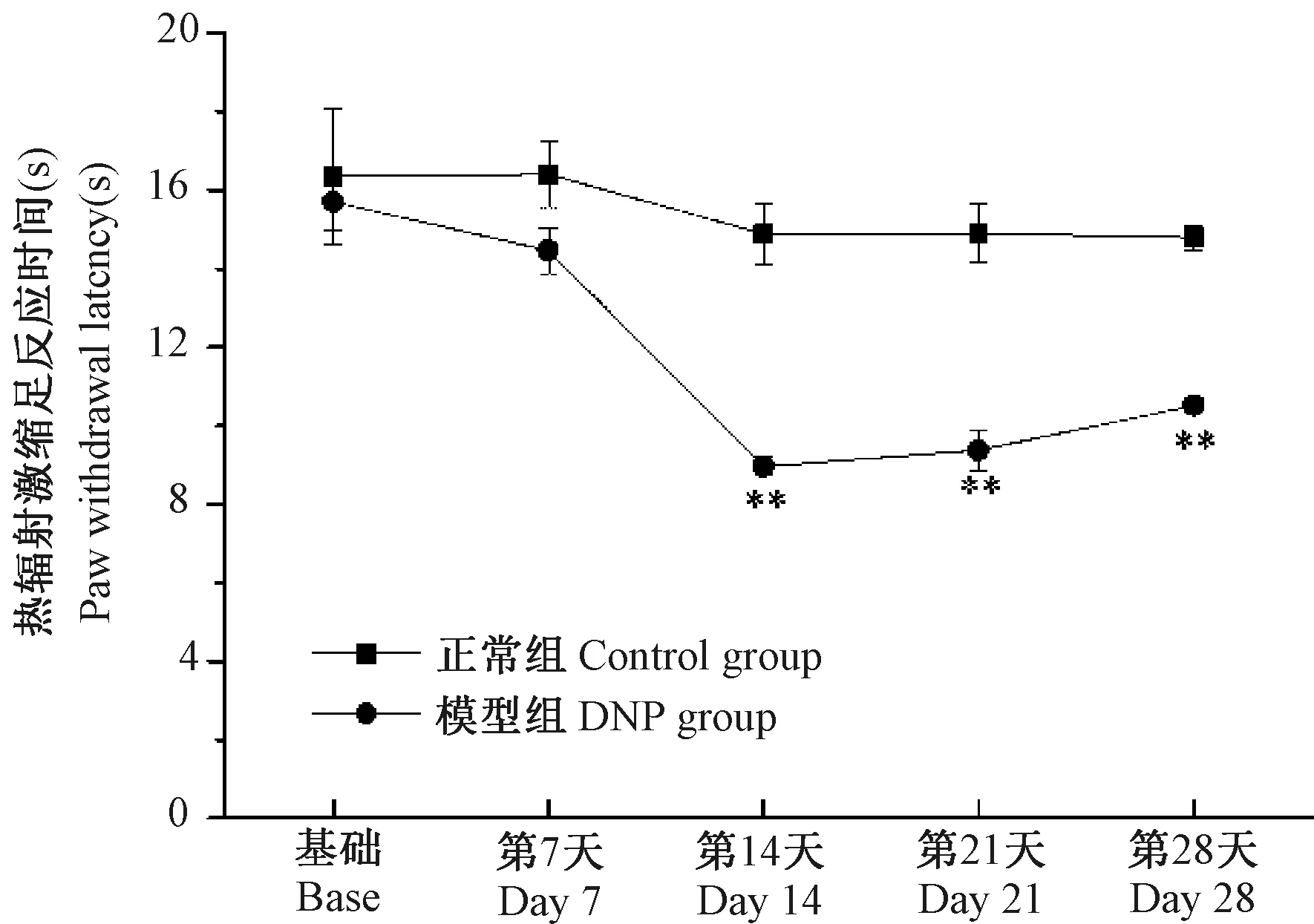
注:与正常组相比,**P< 0.01。图2 DNP大鼠不同时相热痛阈变化情况(n=6)Note. Compared with the control group,**P< 0.01.Figure 2 Changes of PWL in different phases of DNP rats(n=6)
2.2 DNP大鼠不同时间点热痛阈变化情况
STZ注射前,正常组和模型组大鼠PWL无显著差异(P﹥ 0.05);STZ注射后第7天,两组大鼠PWL仍然无显著差异(P﹥ 0.05);STZ注射后第14天开始,与正常组相比,模型组大鼠PWL明显降低(P﹤ 0.01),结果见图2。
2.3 DNP大鼠不同时间点DRG上p-CaMKII阳性细胞表达情况
与正常组相比,STZ注射7,14,21,28 d后,大鼠L4 DRG上p-CaMKII的阳性细胞的表达显著升高(P< 0.05),L5 DRG上p-CaMKII的阳性细胞的表达显著升高(P< 0.01), L6 DRG上p-CaMKII的阳性细胞表达亦显著上升(P< 0.01),且差异有显著性,结果见图3。
2.4 足背注射CaMKII抑制剂KN93可缓解DNP大鼠热痛觉过敏反应
在KN93干预前,与Control + NS组相比,DNP + NS组和DNP + KN93组大鼠PWL明显降低(P< 0.01),DNP + NS组和DNP + KN93组PWL无显著差异(P> 0.05);干预1 h后,与DNP + NS组相比,DNP + KN93组PWL明显上升(P< 0.01),结果见图4。
3 讨论
目前,STZ诱导的糖尿病大鼠模型由于建立相对简单且一次性注射,无论腹膜内或静脉内均可行等优点,已被广泛用于研究糖尿病神经性疼痛的机制并评估潜在的治疗方法,并且已经在动物模型中研究了各种剂量的链脲佐菌素(大鼠或小鼠中35 ~ 200 mg/kg)[10-11]。STZ是亚硝基脲类似物,可以通过其本身含有的部分结构被胰岛β细胞上低亲和力的葡萄糖转运蛋白GLUT2转运,并通过破坏DNA来对胰腺分泌胰岛素的β细胞产生毒性,使胰岛素分泌不足,从而引起血糖的升高[12]。在本研究中,糖尿病大鼠在STZ注射后2周出现热痛阈明显下降,且至STZ注射后4周,模型组痛阈仍然显著低于正常组大鼠,说明糖尿病神经痛模型建立成功。
CaMKII在无活性条件下时其催化结构域的活性受到调节结构域自身抑制序列的抑制[13-14],而当其与钙/钙调蛋白结合并释放催化结构域时,CaMKII可以被激活[15],激活引起Thr286或Thr287位点的自磷酸化,显著增强钙调蛋白的结合亲和力[16]。活化后的CaMKII在调节神经元兴奋性和可塑性,神经递质胞吐,基因转录等方面均发挥了重要作用[17-19]。有研究表明,在瑞芬太尼诱导的术后痛觉过敏模型中,瑞芬太尼注射2 h后大鼠出现机械痛觉和热痛觉过敏反应,免疫印迹结果显示瑞芬太尼干预组DRG上CaMKII的表达显著增加[20]。KN93是CaMKII的抑制剂,它通过竞争CaMKII的钙调蛋白结合位点,抑制痛觉信号通过T型电压门控钙离子通道传递而发挥作用,这些通道位于突触前和突触后神经元膜中,对于控制初级感觉传入神经和脊髓背角疼痛处理区域的亚阈值神经元兴奋性至关重要,可以支持伤害性和神经性疼痛的发生和维持[21]。还有研究发现鞘内注射CaMKII抑制剂KN93可逆转周围神经性疼痛现象[22]。目前,在CaMKII参与的不同类型神经性疼痛的病理生理学中,对于损伤模型[23-24]和炎症模型[25]研究较多,而关于CaMKII在糖尿病神经病变中的作用的研究很少。

注:与正常组相比,*P< 0.05,**P < 0.01。图3 DNP模型大鼠L4-L6 DRG上p-CaMKII表达情况(A)和阳性细胞数统计结果(B)(比例尺=200 μm,n=3)Note. Compared with the control group,*P < 0.05,**P < 0.01.Figure 3 Expression of p-CaMKII (A) and positive cells number (B) on L4-L6 DRG in DNP model rats (Scale bar=200 μm, n=3)
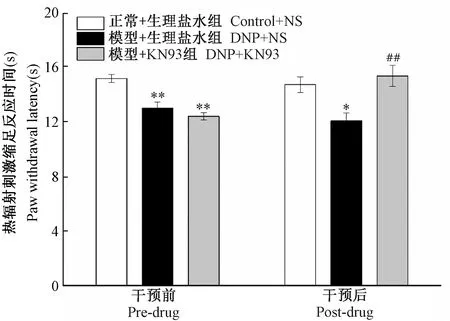
注:与正常+生理盐水组相比,*P< 0.05,**P< 0.01;与模型+生理盐水组相比,##P < 0.01。图4 KN93干预对DNP大鼠热痛阈的影响(n=6)Note. Compared with the Control + NS group,*P< 0.05,**P< 0.01. Compared with DNP+NS group,##P < 0.01.Figure 4 Effect of KN93 on PWL in DNP rats(n=6)
本研究中,我们发现模后7 d时,CaMKII的表达在一定程度上增多,而此时CaMKII自身磷酸化不足以产生痛觉敏化,因此才会出现p-CaMKII表达升高而痛阈未出现明显变化,而模后14 d时,随着CaMKII表达的不断增加,疼痛信号传导增加,逐渐形成外周敏化,出现热痛觉过敏反应,说明p-CaMKII的表达变化与热痛觉阈值呈显著的负相关。KN93为CaMKII的特异性抑制剂,具有较强的水溶性,通过与Ca2+结合位点相互作用,阻止Ca2+与CaMKII结合,使CaMKII无法通过自身磷酸化被激活[26]。在KN93单次注射后大鼠热痛阈明显升高,说明CaMKII抑制剂可抑制大鼠热痛觉过敏反应。因此我们推断糖尿病神经病理痛可能是由于DRG神经元上活化的CaMKII积累到一定程度而产生,且它的发生与维持均和DRG神经元上p-CaMKII的表达密切有关,但其参与糖尿病神经痛的具体机制还有待明确。
——滋阴养胃 少酸宜甜

