奥沙利铂诱导的神经病理性疼痛大鼠模型研究及其在中医方面应用进展
李明珠,王文萍,金圣博
(1. 辽宁中医药大学,沈阳 110032; 2. 中国医科大学肿瘤医院 辽宁省肿瘤医院,沈阳 110042; 3. 辽宁中医药大学附属医院,沈阳 110032)
奥沙利铂是用于消化道恶性肿瘤及妇科恶性肿瘤的常用化疗药物,大约90%的患者在使用此药后会诱发特有的急性化疗后诱导的神经病理性疼痛(chemotherapy-induced peripheral neuropathy,CIPN),临床表现症状为疼痛、麻木,手部、足部和口腔周围的感觉障碍,遇冷引发或加重,10% ~ 15%患者经过多次化疗后出现了累积和慢性CIPN,如感觉丧失和运动障碍,严重影响患者生活质量[1-5]。而中医药凭借独特的辨证论治理论体系,在防治此病有所建树[6-7],是目前研究的热点,但因其治疗机制的探讨和研究,仍亟需加强。因此,在机理研究时选择理想的大鼠CIPN动物模型及检测方法,已成为CIPN的中医防治及病因病机等研究极为关键的步骤。目前机理研究中常选用大鼠CIPN模型,但因尚无明确的分类及应用标准,使现有的动物模型无法得到充分合理的运用,对研究结果的可靠性产生影响。故此文介绍大鼠急性CIPN及慢性CIPN模型的建立方法、评价以及应用,以期为实验中大鼠CIPN模型的选择提供参考,从而构建出更贴合临床实际的动物模型,为中西医防治肿瘤并发症研究创造理想的实验平台。
1 奥沙利铂所致神经病理性疼痛大鼠模型建立的主要方法
大鼠CIPN模型,分为急性模型和慢性模型两种,急性模型采用单次注射一定剂量奥沙利铂所诱导,慢性模型采用多次注射一定总量的奥沙利铂所诱导,常用注射方式为腹腔注射或者鼠尾静脉注射,急性和慢性的造模方式与临床上单次化疗造成急性CIPN模型和多次化疗所造成慢性CIPN模型相一致。注射药物的方式有鼠尾静脉注射和腹腔注射两种方式,腹腔注射主要不良反应为腹膜肿胀[8],但两者均有较好的安全性并简易的操作性。2002年,世卫组织推荐奥沙利铂大鼠使用剂量为每周两次注射2 ~ 3 mg/kg奥沙利铂,直至注射9次,在一些学者研究中发现,奥沙利总使用剂量8 ~ 16 mg/kg大鼠无明显恶化,体重增长速度和正常对照组无显著差异,临床状况良好[9],当单次剂量达到4 mg/kg,累积剂量达到32 mg/kg及以上剂量组,可能出现大鼠死亡[9-10]。即根据奥沙利铂临床成人常用剂量(130 mg/m2),按照动物种属与用药转换公式, 换算出大鼠的用药剂量为20 mg/kg,当剂量达到32 mg/kg换算成人体为180 mg/kg[11]。大鼠接受奥沙利铂注射后会出现一些行为学变化,如摄食减少、消瘦、体重增长变缓等表现,与注射剂量增加和注射间隔时间长短,呈正相关[9],并可以出现四肢末端皮肤颜色略苍白,肌肉萎缩,舔足、抬足活动增加等行为表现,进一步可能出现机械痛阈、冷热痛阈的改变,研究中可以通过如上的表现来判断是否造模成功。以下表格详细叙述常用的急性和慢性造模方式、行为表现及安全性。大鼠均选取SD或Wistar大鼠,雄性或者雌性无明显差别。见表1-3。
2 成模检测方法
奥沙利铂化疗后诱导的神经病理性疼痛的临床表现为自发性疼痛、感觉障碍等,在大鼠CIPN模型中也有所体现,一般通过机械痛阈,冷、热痛阈的改变,来判断造模是否成功及治疗的有效性评价,下面介绍常用的成模的具体检测方法:

表1 大鼠神经病理性疼痛急性模型Table 1 CIPN acute model of rat
注:i.p: 腹腔注射; i.v: 静脉注射; CA:冷痛觉; HH:热痛觉过敏;HHO:热痛觉; MA:机械痛阈;MH:机械痛觉过敏。 (+)表示这种行为是经过评估的,给药奥沙利铂后有类似疼痛的行为,(-)表示这种行为是经过评估的,但在奥沙利给药后不明显。下表同。
Note. i.p,intraperitoneal. i.v, intravenous. CA, cold allodynia. HH, heat hyperalgesia. HHO, heat hypoalgesia. MA, mechanical allodynia. MH, mechanical hyperalgesia. Symbols: (+) indicates presence of pain-like behaviour following oxaliplatin n administration, (-) indicates this behaviour was assessed but not evident following oxaliplatin administration. The same in the following tables.

表2 大鼠神经病理性疼痛慢性模型Table 2 CIPN chronic model of rat

表3 大鼠神经病理性疼痛造模注射方式Table 3 CIPN model injection method of rat
2.1 机械痛阈检测方法及测定
2.1.1 兰德尔压足试验疼痛阈值检测(Randall-Selitto paw-withdrawal test)
在安静、温度(20 ~ 22℃)控制的房间内,上午10:00~下午4:00 时间内,使用Basile Algesy测量仪(芝加哥,伊利诺伊州)检测大鼠的压爪阈值。使大鼠爬进带SLAN的Perspex圆柱形束缚器中,后腿一侧的TED通风孔可自由延伸,实验前使后腿自由伸展和适应10 ~ 15 min,并暴露于试验刺激。采用Selitto压足戒断试验-行为实验方法检测,疼痛阈值定义为大鼠拔出爪子的克数。每只爪子作为一种独立的测量手段,每个实验在单独的一组大鼠身上进行,给药前后测定戒断阈值(即痛阈值),每间隔5 min进行1次伤害感受阈值测量,共测量4次,最后3次的平均值记录为疼痛阈值,戒断压力为200 g[12,22-24]。
2.1.2 冯·弗雷纤维丝疼痛阈值检测(Von Frey hair)
因其简易操作,重复性高,此为最常用的检测方式。在安静、舒适房间内,将大鼠放置于高架金属筛网上,15 min适应环境,从下面使用硬性Von Frey纤维丝(0.6、1、1.4、2、4、6、8、10、15和26 g)对每只后爪刺激最多4 s的时间,从塑料网下面插入,垂直地刺向其双侧后肢足底中部皮肤,缓慢增加刺激压力,直到VFH纤维丝刚刚弯曲。治疗前后对正常大鼠进行测量,试验包括在每只后爪上进行5次重复的VFH测试(频率为每1 ~ 1.5/次),刺激5次出现3次缩足,则此纤维丝的刺激强度即为有效强度;反之,则为无效强度。当某一刺激强度的纤维对于实验动物为有效强度时,则选用低一级刺激强度的von Frey丝进行刺激,直至出现无效强度,那么最小的有效强度则为该肢体的刺激反应阈值(Mechanical withdrawal threshold,MWT)[10,12,14,18,20,22,25-27]。
2.2 机械痛觉过敏测定
2.2.1 兰德尔足压试验(Randall-Selitto)
使用Ugo Basile镇痛仪对大鼠后足施加压力压力,用于量化伤害性阈值的参数是大鼠发出痛苦叫声。进行实验,直到得到两个相似的连续压力值。切断压力为450 g[10,14]。
2.2.2 4 g和15 g Von Frey纤维丝
将大鼠被放置在金属筛网上(20 cm × 17 cm × 13 cm),使用4 g或15 g的Von Frey 纤维丝,垂直地刺向其双侧后肢足底中部皮肤,缓慢增加刺激压力,(每只后爪5次,即每只大鼠10次),(频率为每次1 ~ 1.5 s),每次试验3 min,间隔每只3~ 5 s,计算对刺激的戒断反应次数,后足底撤退频率测定 [即(足底撤退次数/5)×100]。用4 g Von Frey纤维丝引起几乎不痛的刺痛感觉,正常大鼠很少对刺激产生反应,15 g Von Frey纤维丝刺激大约20%会引起戒断反射,因此对4 g或15 g Von Frey 纤维丝刺激的反应表现为机械痛觉过敏[18-19,29]。
2.3 冷痛觉过敏测定(冷痛阈测定)
2.3.1 冷水浴鼠尾撤尾法
将大鼠的鼠尾浸入法在(4℃ 或 10℃)温度下的水浴中进行,老鼠的尾巴浸泡水中,直到尾巴被取出来,记录尾部浸泡时间,每隔5 min进行3 ~ 5次测量,记录平均值,切断时间为15 s。治疗前对正常大鼠进行的测量作为正常参考值[10,12,14,16,24]。
2.3.2 冷板试验测定
每只大鼠被放置在一个透明的塑料盒子(20 cm× 17 cm × 13 cm)中,上面有一个铁丝网,使其适应环境后,用保持在8℃的截形铝锥的尖端与老鼠的后爪子接触,直至大鼠拔出后足,观察大鼠的后足撤退时间,10次试验(左右足各5次试验),每隔1 min进行一次,切断时间为15 s,以避免对爪子造成伤害[15]。
2.3.3 丙酮试验测定
(1)大鼠置于金属网上,盖以透明的有机玻璃罩(23 cm × 17 cm× 13 cm),测试前先使大鼠适应环境15 min,待梳理探究活动消失后,将一滴(0.05 ml)丙酮放在足底后爪中央,根据反应给予4分制评分:0分=无反应;1分=快速拔出后足;2分=长时间退缩;3分=反复拍打后组或天后足内侧。对每只大鼠两足使用丙酮分别检测3次,得到累积分数,最低得分为0,最高得分为18分[18]。
(2)将50 μL丙酮用微喷雾器3次喷在每只后爪的足底皮肤上,以开始喷洒时为0时,计时40 s,统计大鼠40 s内缩足次数。左右各3次, 共计6次[27][28]。
2.3.4 全自动智能冷板仪(北京众实迪创科技有限公司)
将冷板仪温度设置在4℃,待温度恒定后,将大鼠置于冷板仪上,盖以有机玻璃罩。让其先适应1 min。计数60 s,观察大鼠60 s内反应,其中出现轻微躲避反应如抬足、添足、后退等计1分,强烈的躲避反应如跳起来计2分,无任何反应计0分。统计每只大鼠60 s内总分数[30]。
2.4 热痛觉过敏测定(热痛阈测定)
2.4.1 热辐射鼠后足法
将大鼠置3 min厚的玻璃板上的有机玻璃箱内, 适应环境15 min,热辐射仪照射大鼠后肢足底中部皮肤, 同时开始计时,当出现抬足、舔足,逃避等反应时读辐射仪上的时间。调节照射光源强度,使正常大鼠潜伏期维持在10 ~ 20 s之间;设置自动切断时间为30 s,防止烧伤大鼠皮肤。大鼠双足分别连续测量5次,每次间隔5 s,去除最大和最小值后计算平均值,即为大鼠的热痛阈值。正常大鼠在任何治疗前的测量作为对照[12]。
2.4.2 热辐射鼠尾法
使用辐射热测痛仪UgoBasil (意大利米兰)的甩尾试验和设备测量大鼠的热伤害性阈值。测痛仪由24 V,25 W 聚光灯泡制成,光线经外罩上的聚光漏斗集中照射于鼠尾,漏斗外口直径为3 mm,测痛时外口紧贴鼠尾,当鼠尾产生突然抽搐时,即为甩尾反应阳性,传感器会检测到它,借助秒表记录甩尾反应潜伏时间(以下简称痛阈),秒表记录最低限度为0.1 s。取尾尖部起始的2 cm处测痛,反复测痛3次,记录平均值[25,31]。
2.4.3 热水浴鼠尾浸泡试验
大鼠的鼠尾浸入法在较高(42℃或46℃)温度下的水浴中进行,大鼠的尾巴被浸泡在水中,直到尾巴被取出来,记录尾部浸泡时间,每隔5 min进行3 ~ 5次测量,记录平均值,切断时间为15 s。治疗前对正常大鼠进行的测量作为正常参考值[10,14,24]。
2.5 运动协调性的测试
使大鼠在加速Rta-Rod跑步机(UgoBasile,Stoelting)上进行试验。恒定速度(3.75 r/min),将大鼠单独放置在该装置上,然后棒加速至37.5 r/min,记录大鼠在旋转杆上掉下来的时间,截断时间定为5 min[12]。
3 大鼠CIPN模型在中医科研中的应用
大鼠CIPN模型用于中医治疗奥沙利铂诱导的神经损伤,其机制的研究也具有重要意义。如蔡青等[32]研究发现补阳还五汤可拮抗奥沙利铂化疗大鼠引起的热痛阈值和体重减轻。天佛参能抑制奥沙利铂神经毒性模型大鼠的体重减轻,有效地抑制奥沙利铂诱发的末梢疼痛觉过敏症状,提高MWT值,诱导μ、κ阿片受体表达升高[33]。双筋龙汤可减轻化疗致大鼠周围神经毒性,其机制可能是通过上调大鼠L4-L5后根神经节中NGF的表达来介导的[34]。
多个学者研究表现黄芪桂枝五物汤对奥沙利铂化疗后诱导的神经损伤大鼠有明确防治的疗效,其治疗机理可能与奥沙利铂导致的背根神经节核仁变化的改善、通过下调钠离子通道亚型Nav1.7蛋白及基因表达量的增加相关[35],还可能与降低血清、脊髓中丙二醛的含量来起到抗氧化作用从而保护周围神经元细胞,来达到减轻疼痛过敏及背根神经节的氧化应激反应[36]。在神经保护方面,黄芪桂枝五物汤还被证实可以改善大鼠病理形态及超微结构的病变[37],并对髓鞘变性有确实的保护作用,提高坐骨神经传导速度,缩短病变持续时间[38],其机制可能是通过下调大鼠L4-L5脊髓中NR2B的表达以及上调DRG中pNF-H蛋白水平来介导[39]。
一些中药成分的提取物也证实对此病的防治的疗效及探讨相关机理。成薇婷等[40]研究表明在奥沙利铂围化疗期大鼠注射丹参酮ⅡA 能提高坐骨神经传导速度,缩短病变持续时间,发挥保护外周神经的作用。黄芩苷能显著提高热刺激缩足阈值,对于奥沙利铂导致的热痛觉过敏具有显著的抑制作用,其作用机制可能与抑制脊髓部位的nNOS 合成有关[41]。绞股蓝皂苷可改善奥沙利铂所致大鼠周围神经毒性温度和机械刺激下的行为学改变,其机制与上调NGF水平以及Nrf2信号通路有关[42]。人参皂苷Rg3对大鼠奥沙利铂神经毒性具有一定的保护作用,可增加NGF的表达,减少DRG神经元细胞的凋亡[43]。
温经通络散外用治疗能够明显缓解周围神经毒疼痛,加快坐骨神经传导速度,能有效降低奥沙利铂对坐骨神经的损伤,其治疗作用可能是通过保护神经元细胞,缓解坐骨神经损伤,增加血清神经因子表达,减少足底皮肤P物质表达实现的[44],也可能与抑制脊髓背角星形胶质细胞活化进而介导的伤害性信号传递有关[45]加快坐骨神经传导速度降低对坐骨神经的损伤[46]及提高尾神经SNCV以及NGF水平[47],维持背根神经节内兴奋性氛基酸转运体水平进而抑制背根神经节神经元的调亡、抑制脊髓背角星形胶质细胞活化、及机械性痛觉及冷温度刺激过敏反应有关[48]。见表4。
4 讨论
大鼠CIPN模型造模和检测简单方便,可重复性好等优点成为了国内外研究者常用的模型,具有十分广阔的发展前景,是肿瘤疼痛研究的重要手段和平台,实验研究中可以根据模型的特点以及本身治疗手段特点和实际需要选择适当动物模型,对于研究结果的可靠性具有重要意义。
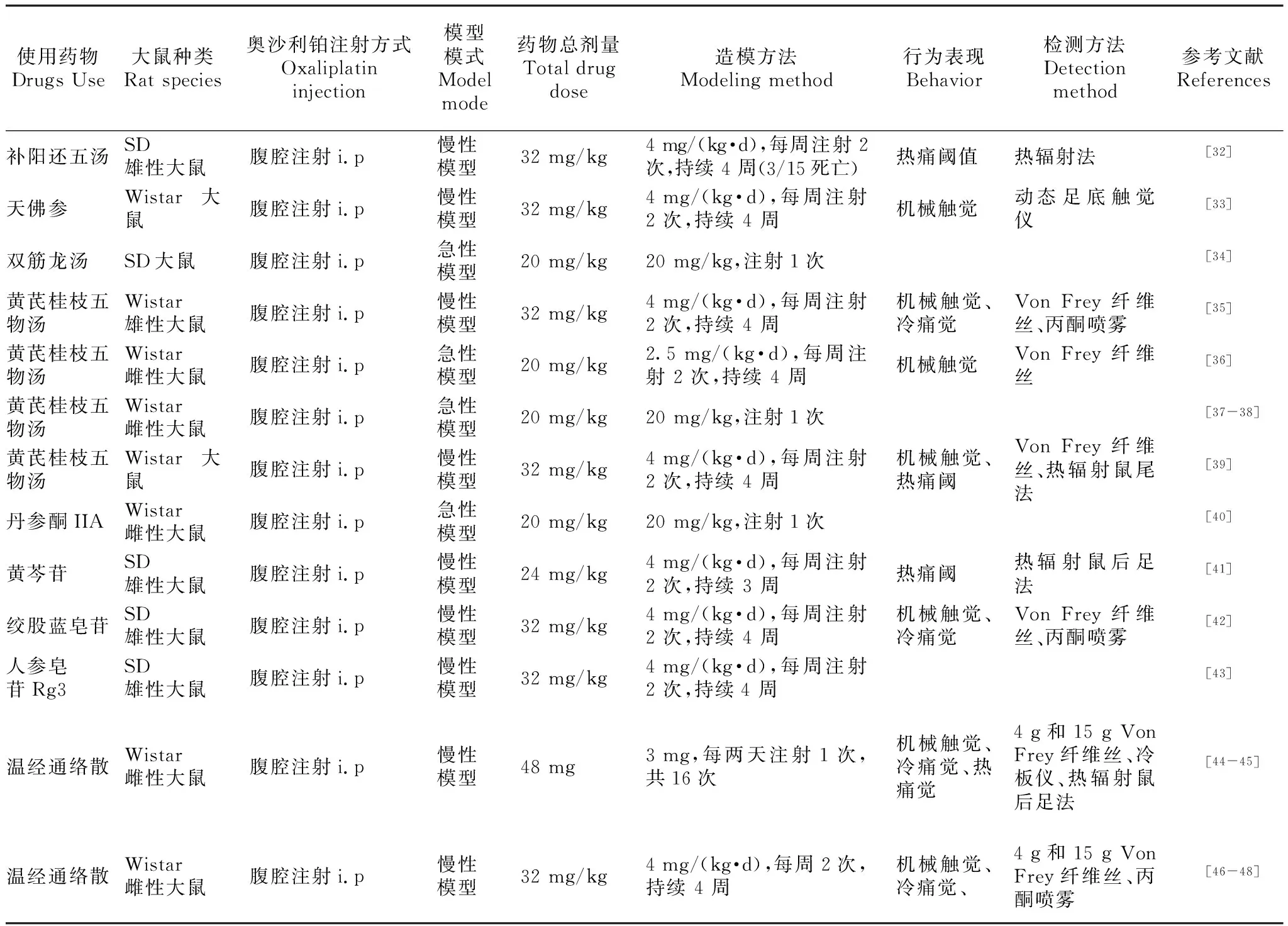
表4 大鼠CIPN模型在中医中应用Table 4 Rat CIPN model applied in Chinese medicine
西药对于奥沙利铂诱导的CIPN没有明确的预防药物,治疗药物为抗抑郁药如度洛西汀及止疼类药物[48],疗效不佳及副反应较大,中医凭借独特的治疗优势辨证论治理论体系,在奥沙利铂化疗后诱导神经病理性疼痛(CIPN)的治疗方面取得了显著疗效,为此需要更精准的动物模型和更为有效的检测方法来深入研究和探索具体作用机制及治疗机理。但目前没有中医相关大鼠CIPN模型的造模体系,如何将大鼠模型和奥沙所致CIPN中医辨证相关的“虚”“寒”“淤”分型相结合,建立中医的相关动物模型,与中医理论相结合,对于中医科研探索此病的治疗机制更有指导意义,进一步完善和建立中医大鼠CIPN模型标准是日待解决问题。发挥中医治疗此病有独特优势,才能在国际发病更有影响力的文章。

