小鼠孵化囊胚及其休眠胚胎程序化冷冻-解冻前后Mgst1基因的差异表达
胡新宇,邢凯,李征,赵志显,常雪蕊,齐晓龙,盛熙晖,王相国,倪和民,郭勇*
(1. 北京农学院动物科学技术学院,北京 102206; 2. 北京市饲料监察所,北京 100107)
在实验用小鼠中,随着1972年Whittingham等[1]将小鼠胚胎成功冷冻并复苏之后,即开启了动物源胚胎程序化冷冻的序章。经前期研究所示,小鼠休眠胚胎的抗冻能力要优于其正常孵化胚胎[2]。通过Affymetrix表达谱芯片对四组胚胎(孵化囊胚、冷冻后孵化囊胚、休眠胚胎、冷冻后休眠胚胎)扫描时发现Mgst1(microsomal glutathione S-transferase 1,微粒体谷胱甘肽S转移酶1)基因在休眠胚胎冷冻前后具有显著差异[3]。Mgst1在肝脏,肿瘤及癌细胞中表达量较高,主要分布于内质网、微粒体和线粒体外膜,能够被氧化应激活化[4-5]。在胚胎干细胞以及其体外诱导分化后都具有较高的表达量[6]。Bräutigam等[7]通过Mgst1 KO/WT小鼠研究发现其后代中没有KO/KO型小鼠的存在,且KO/KO型胚胎无法继续至10 d之后。因此,Mgst1在胚胎前期乃至着床后发育中均具有至关重要的作用。由此,本实验将以Mgst1对于孵化及休眠胚胎抗冻性方面切入,通过对于胚胎中Mgst1的mRNA转录水平的差异表达显著性以及该蛋白在胚胎中表达分布情况,分析休眠胚胎抗冻性优于正常孵化囊胚的原因,为阐明哺乳动物胚胎在相关抗冻机理研究中提供新的理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
本实验用SPF级ICR 7 ~ 8周龄雌雄鼠均购自北京市维通利华实验动物有限公司【SCXK(京)2016-0006】,饲养于北京农学院SPF级实验动物房【SYXK(京)2015-0004】,光照7:00~ 19:00,自由采食饮水饲喂普通维持饲料由北京市维通利华实验动物有限公司提供,饲养环境:昼夜各半循环照明,湿度恒定,温度控制在22 ~ 25℃,所有操作均符合实验动物伦理学要求。饲养两周至性成熟(9 ~ 10周龄),体重约28 g后,即可用于实验。
1.1.2 主要仪器试剂
胚胎冷冻保护剂(货号:101129)购自 ICP Bio Reproduction公司;重组Anti-Mgst1抗体(货号:ab131059)购自Abcam公司;Donkey Anti-Rabbit IgG H&L(FITC)(货号:ab6798)购自Abcam公司;TRIzolTMReagent(货号:15596-018)购自Thermo Fisher公司;qRT-PCR专用UltraSYBR Mixture(High ROX)染料试剂盒(货号:CW2602M)购自北京康为世纪生物科技有限公司。
CO2培养箱:Thermo Scientific Forma 371;普通光学显微镜(Nikon YS2-H);胚胎程序化冷冻仪(Cryobath-FREEZ CONTROL CL-8800i);电子天平(Sartorius,BSA124S);荧光定量PCR仪(安捷伦AriaMx Real-Time PCR System G8830A);移液器[Eppendorf(1 mL、200 μL、100 μL、10 μL)];掌心离心机(百晶,Qspin);单孔水浴锅(北京长安科学仪器厂);贝克曼高速离心机(Allegra 64R Centrifuge);载玻片;盖玻片;计时器。
1.2 方法
1.2.1 超排处理及胚胎获取
选择发情期或发情间期的ICR雌鼠,实验当晚20:00,每只腹腔注射10 IU的PMSG,48 h后,每只小鼠再腹腔注射10 IU hCG,然后与公鼠按1∶1合笼,次日早8:00挑选出见栓小鼠用于后续实验[8]。正常孵化囊胚于小鼠见栓第5天的早8:00,通过用PBS液正、反双向冲洗其双侧子宫获取。休眠胚胎则在小鼠见栓后的第4天早8:00,在彻底摘除小鼠双侧卵巢后,连续3 d颈部皮下注射0.2 mg/mL孕酮(每只0.1 mL),术后第4天早8:00,用PBS液正、反双向冲洗其双侧子宫获取。回收的胚胎用PBS液充分洗涤后,进行常规程序化冷冻处理:将胚胎在15℃中平衡15 min之后,以1℃/min降低至-5℃,平衡30 min,再以0.33℃/min降低至 -36℃。进行37℃解冻复苏2 h后,移入1.5 mL无菌离心管中,放入-80℃冰箱保存。
1.2.2 激光共聚焦检测Mgst1蛋白在胚胎上的分布
当日回收经由PBS工作液清洗的胚胎后,立即放入4%多聚甲醛中固定30 min,PBS清洗3 min × 5次后用0.2% TritonX-100,PBS通透5 min。胚胎充分清洗后转移至Mgst1一抗中4℃过夜。胚胎结合一抗后用0.05%Tween-20,PBS洗涤后置于带有FITC标签的二抗中,37℃孵育1 h,随后用0.05%Tween-20,PBS清洗胚胎并放入PI(碘化丙啶)溶液中37℃浸染3 min,浸染完成后将胚胎用0.05%Tween-20,PBS彻底清洗干净后,胚胎置于带有微量PBS的载玻片上,盖玻片四角点入微量凡士林压片,中性树胶封片,随后于激光共聚焦扫描显微镜中成像检测。
1.2.3 引物设计
根据NCBI基因数据库中小鼠Mgst1(NM_001347489.2)和GADPH(NM_008084.3)基因序列,用Primer3.0软件网上在线设计实时荧光定量PCR引物,引物序列见表1。
1.2.4 qRT-PCR 检测胚胎冷冻前后Mgst1 mRNA 的表达变化
程序化冷冻前后胚胎通过 TRIzol法提取其总RNA,随后放入1 μg反转体系中反转为cDNA,体系见表2。使用荧光定量PCR仪进行实时荧光定量PCR反应,其反应体系为:12.5 μL UltraSYBR Mixture(High ROX),10.5 μL dd H2O,1 μL上下游引物1∶1混合物,1 μL反转体系后所得cDNA。PCR扩增程序:预变性,95℃,30 s;变性,95℃,5 s,退火,59℃,30 s,延伸,72℃,30 s,40个循环,实验重复3次。
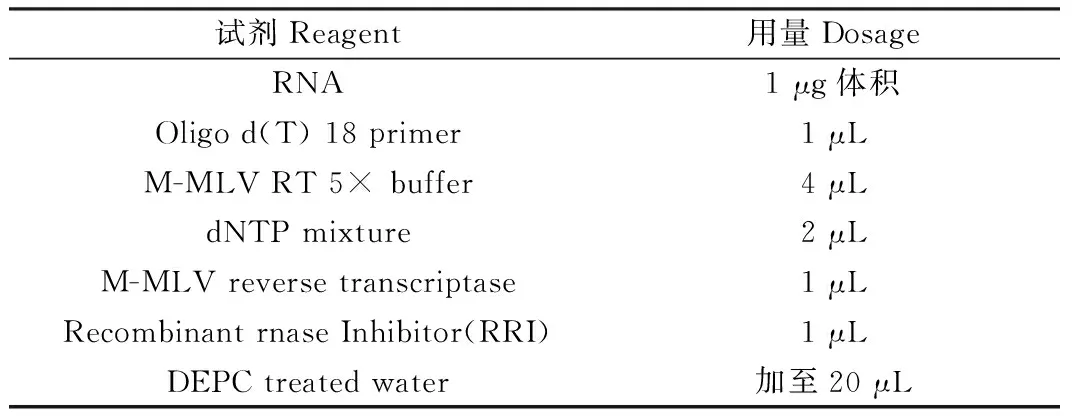
表2 mRNA反转录体系Table 2 mRNA reverse transcription system
注:加入olige dT后,70℃孵育3 min,随后置于冰上3 min。随后依次加入其它物质并在39℃条件下孵育1 h即可得到cDNA。
Note. After adding olige dT, incubate at 70℃ for 3 min, and then place on ice for 3 min. Subsequently, other materials were added sequentially and incubated at 39℃ for 1 h to obtain cDNA.
1.3 统计学分析
所得实验数据用SPSS 22.0 软件进行ANOVA 单因素方差分析,使用GraphPad Prism 7软件制作数据分析图[8]。
2 结果
2.1 Mgst1蛋白在程序化冷冻前后小鼠正常孵化囊胚和休眠胚胎中表达分布
如图1、图2所示,通过共聚焦图像可以发现,Mgst1蛋白在冷冻前后的正常与休眠胚胎中均有表达,其表达区域位于细胞核外,且主要分布于胚胎滋养层中。

注:A:孵化囊胚;B:冷冻后孵化囊胚。绿色荧光代表Mgst1蛋白分布区域;红色荧光代表细胞核位置(× 60,标尺=100 μm)。图1 Mgst1蛋白在孵化囊胚冷冻前、后蛋白表达定位Note. A, Hatched blastocysts. B, Blastocysts hatched after cryopreservation. Green fluorescent signal represents the distribution region of Mgst1 protein. Red fluorescent signal indicates the nuclear location(× 60, Bar=100 μm).Figure 1 Localization of Mgst1 protein expression before and after cryopreservation in hatched blastocysts
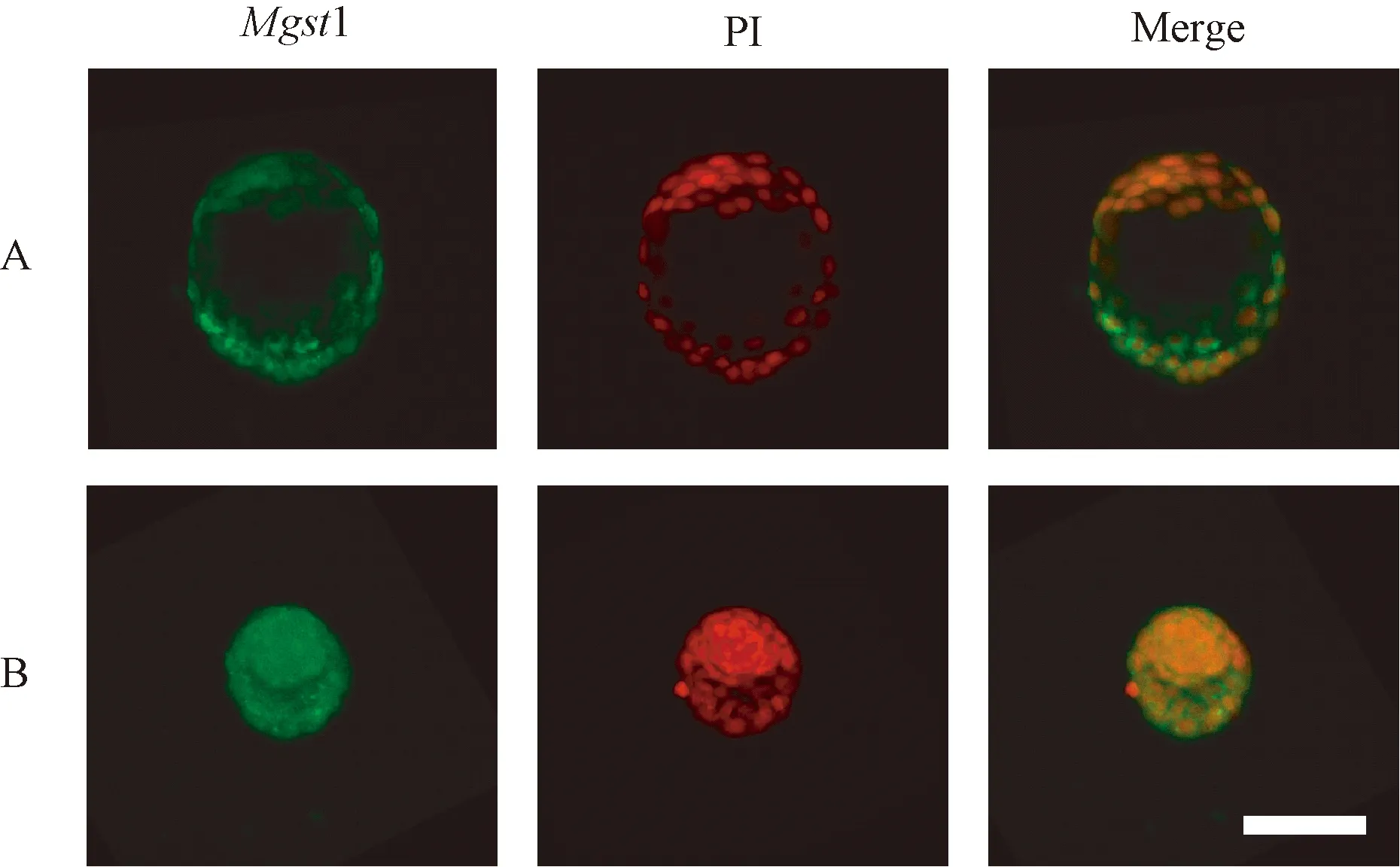
注:A: 休眠胚胎;B:冷冻后休眠胚胎。绿色荧光代表Mgst1蛋白分布区域;红色荧光代表细胞核位置(× 60,标尺=100 μm)图2 Mgst1蛋白在休眠囊胚冷冻前、后蛋白表达定位Note. A, Dormant embryos. B, Dormant embryos after cryopreservation. Green fluorescent signal represents the distribution region of Mgst1 protein. Red fluorescent signal indicates the nuclear location(× 60, Bar=100 μm).Figure 2 Localization of Mgst1 protein expression before and after cryopreservation in dormant blastocysts
2.2 qRT-PCR检测结果
如图3所示,经过程序化冷冻后的囊胚与休眠胚胎分别与其冷冻前的正常囊胚与休眠胚胎相比,Mgst1基因的mRNA的相对表达量均显著性升高(P< 0.05),且经程序化冷冻后休眠胚胎与休眠胚胎相比,Mgst1基因的mRNA的相对表达量极显著性升高(P< 0.01);与此同时,经程序化冷冻后休眠胚胎与经过程序化冷冻后的正常孵化囊胚相比,Mgst1基因的mRNA的相对表达量同样具有显著性升高趋势(P< 0.05)。

注:A:孵化囊胚;B:冷冻后孵化囊胚;C:休眠胚胎;D:冷冻后休眠胚胎。上标相同字母表示差异无显著性,P> 0.05;不同字母表示差异有显著性,P< 0.05。图3 Mgst1基因相对表达量分析图Note. A, Normal hatched blastocysts. B, Blastocysts hatched after freezing. C, Dormant blastocysts. D, Dormant blastocysts after freezing. The same letter indicates that the difference is not significant, P > 0.05. The different letters indicate that the difference is significant, P < 0.05.Figure 3 Relative expression of Mgst1 gene
3 讨论
超低温冷冻保存虽然能够长时间储存优质胚胎。到目前为止,任何发育时期(原核时期、分裂时期、孵化囊胚)的胚胎,与其冷冻前相比,在移植后的存活率较之前仍有着较大差距。
Mgst1(微粒体谷胱甘肽S-转移酶1)是一种膜结合型谷胱甘肽转移酶,主要位于肝脏中,且在内质网以及线粒体内膜中表达量较高[9]。由于其通过谷胱甘肽依赖性转移酶和过氧化物酶的活性,可对于活性中间体(其中包括代谢所产生的亲电中间体和亲脂性氢过氧化物)进行解毒,因此能够降低活性氧对于细胞膜的损伤程度[10]。
通过本实验已经证明,Mgst1蛋白在小鼠的孵化囊胚、休眠胚胎以及经由程序化冷冻后的孵化囊胚和休眠胚胎中均有表达,其说明Mgst1蛋白在胚胎的早期发育及着床过程中有着重要的作用。先前的研究已经证实,Mgst1能够减少氧化应激所产生的细胞凋亡现象[11]。而在细胞冷冻之后,脱水所引起的渗透压剧烈变化以及低温保护剂毒性对细胞膜的损伤均可导致细胞膜功能丧失[12]。因此冷冻后的细胞会产生氧化应激并导致线粒体膜通透性发生变化,其中的线粒体膜间细胞色素释放到细胞质中,进一步激活caspase-9活性,最终导致细胞凋亡[13]。
qRT-PCR结果显示,小鼠的孵化囊胚与休眠胚胎在经程序化冷冻后,其Mgst1基因的表达量均较冷冻之前显著上升。在胚胎着床时,Mgst1在着床位点上表达量较高的胚胎有较高的生物学活性[14],且在其表达量下降人类患者中,胚胎将不能够正常着床[15]。同时,程序化冷冻会对于细胞的生物膜系统构成损害[16],以至于线粒体内膜在程序化冷冻过程中会遭到破坏,进而降低其线粒体本身功能[17],使得细胞抗氧化应激能力大幅度下降[18]。由于细胞自身具有抗氧化机制[19],且Mgst1在氧化应激中有着重要的作用[20]。因此,解冻后的胚胎此时很有可能在处于着床时期的同时经受氧化应激,进而使得胚胎Mgst1基因在短时间之内显著上调。
休眠胚胎,即胚胎滞育现象是动物为了能够更好的在环境中生存而进化出的一种能够保证物种繁育的策略[21-22]。且其与正常孵化囊胚之间有着大量表达差异的基因[23]。在本实验中,Mgst1的mRNA在冷冻后的休眠胚胎中的相对表达量极显著高于冷冻前的正常孵化囊胚与休眠胚胎。这可能是胚胎在经受冷冻氧化应激之后所采取的抗氧化措施。因此,可以推测,Mgst1很可能在胚胎的程序化冷冻过程中起到非常重要的作用。但其在抗冻过程中能否起到决定性的作用,需进行进一步具体探究。

