麝鼠TNFRSF13C和TNFRSF4基因表达分析
廖光珍 毕建鑫 张 钰 白素英
(东北林业大学野生动物与自然保护地学院,哈尔滨,150040)
麝鼠(Ondatrazibethicus),原产于北美洲,属哺乳纲(Mammalia)草食性动物,自20世纪初苏联引进后,被作为毛皮兽而大量饲养,于20世纪中叶传入中国进行人工养殖。成年雄性麝鼠在阴茎基部的腹部中线两侧的皮肤与肌肉之间,有一对能在繁殖期(分泌期)分泌粘稠的乳白色液体的香腺[1]。麝鼠香腺呈现明显的季节变化,在2月开始发育,3月开始进入分泌期,4月达到顶峰,然后继续变化直到8月,9月开始腺体萎缩,10月在阴茎基部附近缩小到黄豆大小,到了11月,结缔组织逐渐取代了腺体[2]。Zhang等[3-5]指出麝鼠香腺的这种季节性发育可能是受到激素与激素受体的调控,Li等[6]则指出钙和TGF-beta信号通路的基因在麝鼠香腺中的季节性差异表达可能与其萎缩有关,而有关肿瘤坏死因子在麝鼠香腺发育中的影响还未见研究。
由活化的巨噬细胞与单核细胞产生的肿瘤坏死因子(tumor necrosis factor-alpha,TNF-α)是一种参与细胞免疫等多种生理调控过程的细胞因子[7-8],其超家族成员(tumor necrosis factor superfamily,TNFSF)能够结合一个或多个TNF受体超家族(TNFRSF)分子[9-10],这些超家族成员的受体和配体是一种影响免疫系统发育、内稳态和适应性反应的信号传导因子[9]。其中,肿瘤坏死因子受体超家族成员13C(TNFRSF13C),也称为BAFF受体,是含有单个细胞外富含半胱氨酸结构域(CRD)的Ⅲ型跨膜蛋白。有研究显示该受体通过与其衔接蛋白TRAF2和TRAF3的相互作用,诱导NF-κB和Bcl-2的抗凋亡信号通路的启动,导致抗凋亡蛋白的形成,从而促进细胞生存[11]。同为TNF受体超家族成员的TNFRSF4(TNF receptor superfamily member 4)也称OX40受体,在与衔接蛋白TRAF2和TRAF5结合后,同样能够促进NF-κB发挥效应[12-14]。本试验利用RT-qPCR技术比较麝鼠TNFRSF13C和TNFRSF4基因在繁殖期与非繁殖期的麝鼠心、肝、肺、肾、睾丸、肌肉和香腺中的转录水平差异,探讨TNFRSF13C和TNFRSF4基因在麝鼠繁殖与香腺发育中可能的影响。
1 材料与方法
1.1 实验动物
在5月初和10月末前往黑龙江省哈尔滨市的麝鼠养殖场,分别购买3只体况相近的1岁龄雄性麝鼠,适应性饲养2 d后采其心、肝、肺、肾、睾丸、肌肉与阴茎两侧的香腺,于液氮中速冻后放入冻存管中,并保存于-80 ℃超低温冰箱中备用。
1.2 RNA提取与反转录
将试验组织放入盛有液氮的研钵中快速研磨后加入适量Trizol试剂(1 mL/100 mg组织),然后利用RNA提取试剂盒(Thermo Scientific,USA)提取组织总RNA。利用DNase I去除总RNA中的DNA残留后,于纯化柱中洗脱RNA。然后利用1.3%琼脂糖凝胶电泳检测总RNA完整性,按照全式金反转录试剂盒说明书进行反转录。
1.3 TNFRSF13C和TNFRSF4基因转录水平检测
利用NCBI设计引物,实验内参基因为β-肌动蛋白(β-actin)基因,引物序列见表1。RT-qPCR反应体系为20 μL:cDNA模板2 μL,上下游引物(10 μmol/μL)各0.2 μL,2×SYBR GREEN I Supermix(ROCHE)10 μL,最后用 H2O补足。所有样品一式3份进行重复孔试验,扩增程序为:95 ℃10 min;95 ℃10 s,60 ℃30 s 40个循环,退火时收集荧光信号。
1.4 数据处理
RT-qPCR扩增后,按△△Ct法计算结果。
内参基因均一化样本差异:△Ct=Ct目的基因-Ct内参基因;2个时期样本表达差异:△△Ct=△Ct处理样品-△Ct对照样品;计算倍数变化=2-△△Ct。
两组间结果比较采用t检验,P≤0.01认为差异显著,P≤0.05认为差异有统计学意义。
表1 本文所用引物信息

Tab.1 Primers used in this study
2 结果与分析
经RT-qPCR检测后发现,肿瘤坏死因子TNFRSF13C和TNFRSF4基因在麝鼠心、肝、肺、肾、睾丸、香腺中繁殖期与非繁殖期的表达差异显著。其中TNFRSF13C基因在麝鼠心、肝、肺、肾、睾丸、香腺中繁殖期的转录水平约为非繁殖期的 2.4、8.2、10.6、2.8、9.6、4.8倍(图1),差异显著(P<0.05);TNFRSF4基因在麝鼠心、肝、肺、肾、睾丸、香腺中繁殖期的转录水平约为非繁殖期的2.2、3.6、4.2、2.3、1.9、4倍(图2),差异显著(P≤0.05);而TNFRSF13C和TNFRSF4基因在繁殖期与非繁殖期的麝鼠肌肉中的mRNA表达水平均没有明显差异(图2,图3)(P>0.5)。熔解曲线结果显示反应过程中未出现明显非特异性扩增(图3,图4)。
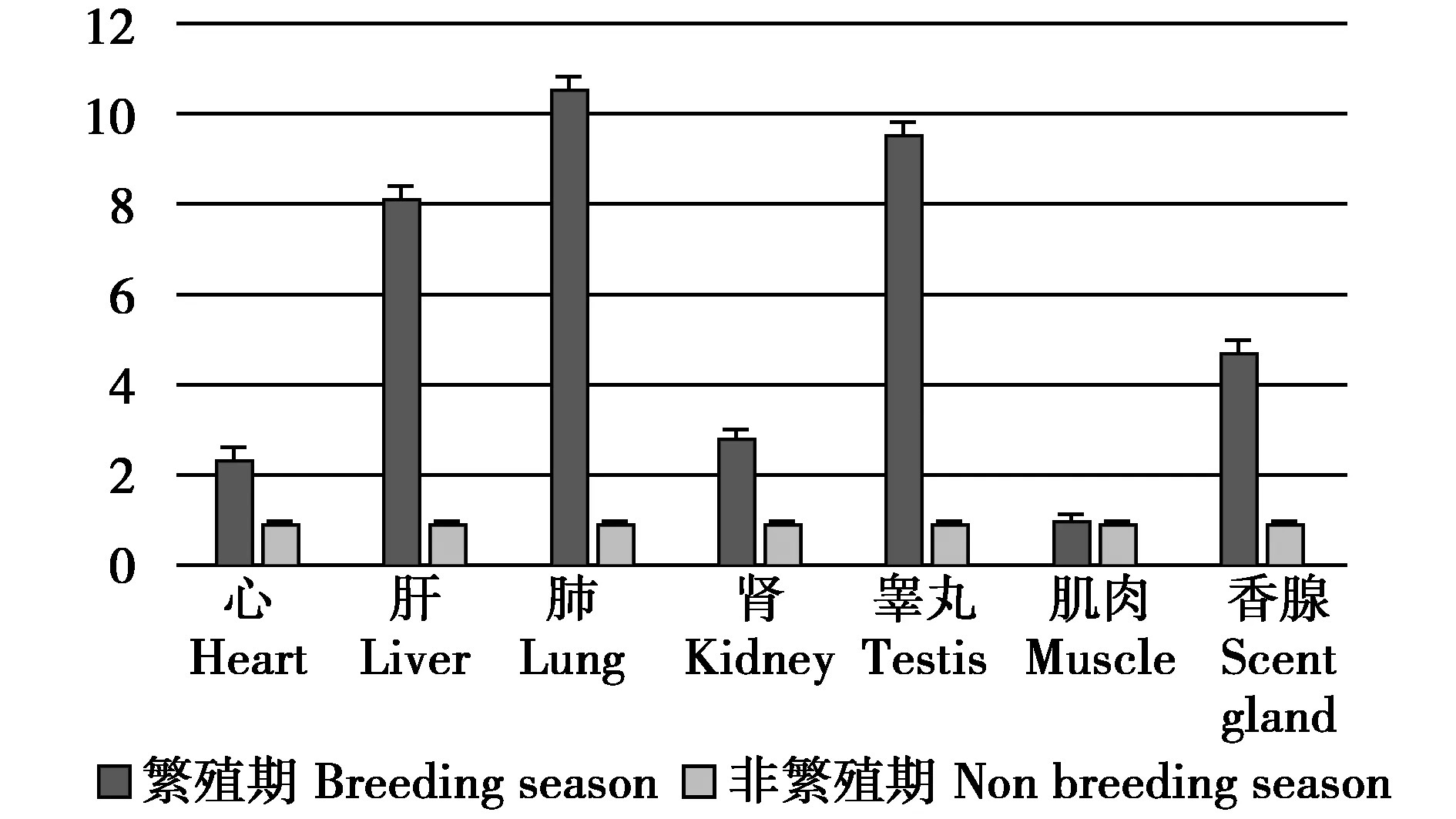
图1 繁殖期与非繁殖期麝鼠TNFRSF13C基因转录水平差异Fig.1 Difference of TNFRSF13C gene transcription level between reproductive and non-reproductive muskrat
3 讨论
通过RT-qPCR检测发现,麝鼠TNFRSF13C和TNFRSF4基因在其心、肝、肺、肾、睾丸、香腺中的转录水平均表现为繁殖期高于非繁殖期,并且差异显著(P≤0.05),由此推测肿瘤坏死因子TNFRSF13C和TNFRSF4可能参与了麝鼠器官发育(香腺)和机体适应变化环境的过程。

图2 繁殖期与非繁殖期麝鼠TNFRSF4基因转录水平差异Fig.2 Difference of TNFRSF4 gene transcription level between reproductive and non-reproductive muskrat
图3 TNFRSF13C基因熔解曲线Fig.3 Melting curve of TNFRSF13C gene
图4 TNFRSF4基因熔解曲线Fig.4 Melting curve of TNFRSF4 gene
麝鼠是季节性繁殖动物,其香腺形态随着繁殖期和非繁殖期的更替而呈现出明显的季节变化——发育或萎缩。繁殖期的样品采集于5月,此时的麝鼠香腺发育成熟,香腺体积膨大并大量分泌麝鼠香。敲除小鼠的研究表明,TNFRSF4促进凋亡抑制因子BCL2、BCL2LL1/BCL2-XL的表达,从而抑制细胞凋亡[15]。TNFRSF13C是TNFSF13C(又称B cell activating factor belonging to the TNF family,BAFF,B 淋巴活化因子)的特异性受体。有研究显示BAFF/BAFF-R可通过诱导NF-κB和Bcl-2的表达激活抗凋亡信号通路[11]。并且,BAFF通过磷酸化PI3K路径可以促进凋亡蛋白Mcl-1表达,另外还促进生物代谢功能[16]。结合实验推测,在麝鼠香腺的发育中,肿瘤坏死因子TNFRSF13C和TNFRSF4表达的上调,促进了抗凋亡蛋白的生成,在促进香腺细胞的生存中起到了重要的调控作用,从而繁殖期的香腺呈现出快速发育,而非繁殖期呈现出快速萎缩的现象。在繁殖期麝鼠香腺中,肿瘤坏死因子TNFRSF13C的相对表达量高于TNFRSF4,说明在抗凋亡能力调控过程中,肿瘤坏死因子TNFRSF13C比TNFRSF4的调控作用可能更强。
已有研究证明,肿瘤坏死因子TNFRSF13C和TNFRSF4与淋巴细胞免疫有关。BAFF(TNFRSF13C)与 B 细胞存活、增殖、发育和成熟均有密切的关系。据认为该受体是BAFF介导的成熟B细胞存活所需的主要受体[11]。此外,BAFF 还发挥共刺激作用促进CD4+/CD2+T 淋巴细胞活化,同时调节细胞体液和细胞免疫应答[17-18]。而TNFRSF4(OX40受体)表达于活化的T淋巴细胞表面,参与T细胞的活化、增殖与迁移。OX40的共刺激分子OX40L则主要表达于活化的抗原呈递细胞表面,如树突状细胞、B淋巴细胞、血管内皮细胞、巨噬细胞,以及某些组织细胞(心、肺、睾丸)[19]。它们所介导的共刺激信号在活化T细胞和促进B-T细胞相互作用过程中发挥重要的作用。敲除小鼠的研究表明该受体在CD4+T细胞应答中的作用,以及T细胞依赖性B细胞增殖和分化中的作用。与TNFRSF4相关的疾病包括免疫缺陷和急性移植物抗宿主病,其相关途径是免疫系统中的细胞因子信号转导和Th2分化途径[15]。麝鼠繁殖期时的心、肝、肺、睾丸中TNFRSF13C和TNFRSF4的转录水平高于非繁殖时期,并且差异具有统计学意义(P≤0.05),说明麝鼠繁殖期的免疫能力强于非繁殖时期。这可能的原因是,10月末的麝鼠已经进入非繁殖期,该时期的哈尔滨天气严寒,麝鼠的食物匮乏,其获得的有限的能量被更多地用于保持体热,所以,免疫力相较食物充足的繁殖期有所下降,是机体适应大自然变化规律的表现。
综上所述,本研究通过TNFRSF13C和TNFRSF4基因的转录水平分析,揭示了这两个肿瘤坏死因子在麝鼠繁殖期和非繁殖期心、肝、肺、肾、睾丸和香腺中的表达差异,可能参与了麝鼠心、肝、肺、肾、睾丸和香腺发育,可以为麝鼠繁殖和提高泌香产量提供依据。

