雄性食蟹猴生殖系统中Ghrelin的分布定位
李 鑫 宋尚桥 马围围 郑 福 曾素先 孙翠翠 严 瑾 黎宗强*
(1.广西大学动物科学技术学院,南宁,530005;2.南宁市江南区沙井街道办事处水产畜牧兽医站,南宁,530033)
Ghrelin是由日本科学家Kojima等[1]于1999年从大鼠胃组织中提取得到的一种28肽。它是第一个作为生长激素促分泌素受体(growth hormone secretagogue receptor,GHS-R)[2]的天然内源性配体而被发现,能促进生长激素(growth hormone,GH)的释放,也是继生长激素释放激素(growth hormone-releasing hormone,GHRH)[3]和生长抑素(somatostatin,SS)[4]之后,调节GH分泌的第3个内源性激素[5]。研究表明,ghrelin在小鼠[6]、人[7]、猪[8]、兔[9]、反刍类[10]、禽类[11]、鱼类[12]等多种动物中均有分布。Ghrelin是一种脑肠肽,主要分布在动物的消化系统、中枢系统中[13]。生殖系统中也有ghrelin阳性细胞的分布,主要分布在睾丸、附睾、卵巢等组织中,提示ghrein在生殖系统中发挥重要作用。Ghrelin除能调节GH分泌外,还参与调节摄食与能量代谢、胃肠和心血管功能、记忆睡眠、内分泌、生殖等多种生物学作用[14]。此外,在炎症、肿瘤等病理过程中也有重要作用。Ghrelin自发现至今,已引起了广泛的关注,成为近年来的研究热点。尽管ghrelin细胞在许多物种中的分布定位已有较多文献报道,然而目前关于ghrelin细胞在食蟹猴体内的分布定位研究,国内外文献报道较少[15]。
本试验以成年雄性食蟹猴为试验动物,采用免疫组织化学技术系统观察研究ghrelin在食蟹猴生殖系统中的分布定位情况,为进一步研究ghrelin在食蟹猴生殖系统中的生理功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
本研究所使用的实验动物为1只成年雄性食蟹猴,是广西玮美生物科技有限公司自繁的F2。食蟹猴(Macacafascicularis)体重4.5 kg,4周岁,身份编号为1007515,除左眼失明外,其他健康状况良好。由于食蟹猴属于CITES附录Ⅱ物种,故动物在出厂、运输、保管、处死等各个环节中均遵守相关法律法规。
表1 动物流转档案登记表

Tab.1 Animal circulation file registration form
1.1.2 主要试剂药品名称
速眠新Ⅱ注射液,一抗,SABC免疫组化染色试剂盒,DAB显色试剂盒,多聚赖氨酸,苏木素染色液,伊红染液,无水乙醇、二甲苯,甘油,30%过氧化氢,盐酸,切片石蜡,氯化钠,多聚甲醛,磷酸二氢钠,磷酸氢二钠,柠檬酸,柠檬酸钠。
1.1.3 主要仪器设备
电子天平,微波炉,PH计,切片机,万用电炉,水浴锅,显微镜,显微摄像系统,形态分析系统,恒温箱,冰箱,移液枪,石蜡包埋机,病理级显微载玻片,显微镜盖玻片,中性树胶。
1.2 方法
1.2.1 组织取材与固定
将食蟹猴按0.3 mg/kg进行速眠新臀部肌肉注射麻醉,分离出颈动脉,剪开一个“V”形小口放血,待血液放掉大约1/3后,用0.9%的生理盐水从颈动脉进行灌注冲洗,同时将同侧颈静脉也剪开,待颈静脉流出的液体呈清亮透明时,再换用4%中性多聚甲醛灌注固定,直至触摸动物的四肢及腹部内脏僵硬为止。然后对灌注后的动物进行组织取材,所采集组织块大小约为1.0 cm×1.0 cm×0.5 cm。将采集到的样品经生理盐水清洗后,继续置于4%中性多聚甲醛溶液里进行固定,固定时间为12—24 h以上。样品置于4 ℃冰箱中保存备用。
1.2.2 制作石蜡切片
流水冲洗入组织中的甲醛溶液、脱水、透明、浸蜡、包埋、修整蜡块及切片、展片、贴片及烤片。
1.2.3 石蜡切片HE染色步骤
常规脱蜡至水、苏木精染色、伊红染色、脱水、透明、封片与干燥。
1.2.4 免疫组化SABC法染色步骤
(1)常规脱蜡至水:步骤同HE染色。
(2)热修复抗原:将切片浸入0.01 M枸橼酸盐缓冲液中,微波炉中高档加热至沸腾后调至低档保持10 min,断电。室温冷却后,PBS浸洗2 min×3次。
(3)封闭内源性过氧化氢酶:3% H2O2室温孵育10 min以灭活内源性过氧化氢酶,PBS浸洗2 min×3次。
(4)滴加5% BSA封闭液:37 ℃孵育30 min,甩去多余液体,不洗。
(5)滴加一抗:一抗为兔多克隆抗体。用PBS将一抗按1∶1 000稀释,37 ℃孵育2 h,或4 ℃过夜。PBS浸洗2 min×3次。若一抗在4 ℃冰箱过夜,则需先在37 ℃温箱复温30 min,再进行后续操作,以免组织脱片。
(6)滴加二抗:二抗为兔IgG。37 ℃孵育1 h,PBS浸洗2 min×3次。
(7)滴加试剂SABC:37 ℃孵育30 min,PBS浸洗5 min×4次。此步骤要增加清洗次数及时间,以尽量洗净组织中残留的试剂,以免影响后续显色反应。
(8)DAB显色:将DAB显色试剂盒中的A、B、C试剂各取1滴,加入1 mL蒸馏水中混匀后滴加至玻片。室温下显色,显微镜下控制反应时间,一般为3—5 min。蒸馏水洗涤以终止显色。
(9)复染:苏木素复染1 min,1%盐酸-乙醇分化液分化2 s,自来水冲洗干净并返蓝。
(10)常规脱水透明,中性树胶封片,显微镜观察。
阴性对照组用PBS液代替一抗,其余操作步骤与免疫组化染色组相同。每个组织随机做3组切片,每组分免疫组化组、阴性对照组两个比较。此外每个组织另做一张HE染色片,便于更准确地对实验结果进行比较描述。
1.2.5 图像采集及分析
将不同方法处理后的切片用SmartV 350D显微摄像系统进行拍照观察。每个组织样本取3张切片,每张切片的阳性区域随机取3个视野。结果判定标准:对照组切片染色为阴性,视野内无阳性染色,只看到淡染的细胞核以及少许棕色背景染色。Ghrelin阳性细胞被染为棕色到棕黑色,细胞呈集中或散在分布。
2 结果
2.1 Ghrelin阳性细胞在睾丸中的分布定位
光镜下观察,睾丸组织中曲细精管管壁为各级生精细胞,管腔游离面可见大量精子附着(图1-D黑色箭头所示),表明该食蟹猴已达到性成熟。免疫组化染色发现,阳性显色在睾丸组织中广泛分布(图2-A)。高倍镜下将图像进一步放大发现,在曲细精管的管壁各层生精上皮中均有ghrelin阳性产物表达(图3-B黑色三角所示),在曲细精管管腔中呈强阳性表达(图2-B1),呈棕黑色染色反应。此外,在睾丸间质细胞中也可检测到较低的ghrelin表达(图2-B2)。阴性对照组仅见较淡的背景染色,而未见阳性细胞分布(图2-C)。
2.2 Ghrelin阳性细胞在附睾中的分布定位
光镜下观察,附睾头部含有许多睾丸输出小管,且管腔中含有大量的成熟精子(图2-D)。免疫组化染色结果显示,睾丸输出小管中可见广泛的显色反应(图2-A)。高倍镜将图片进一步放大发现,在睾丸输出小管的管壁上皮细胞中(图2-B1)有ghrelin阳性产物的表达,但表达量不高,细胞质被染为淡棕黄色。而管腔中则有较高水平的表达,且集中分布在精子尾部中(图2-B2),呈棕褐色显色,其他部位则未见ghrelin阳性产物的表达。阴性对照组仅见较淡的背景染色,而未见阳性细胞分布(图2-C)。
2.3 Ghrelin阳性细胞在输精管中的分布定位
光镜下观察,输精管的管壁较厚,管腔内含有大量的精子(图2-D)。免疫组化染色发现,输精管中可见大量的显色物质(图2-A)。高倍镜下将图片进一步放大发现,在输精管管壁的黏膜上皮中有微弱的ghrelin产物表达(图2-B1),阳性细胞染色呈淡棕黄色,而管腔中的表达量较高,且集中分布在精子尾部中(图2-B2),呈棕褐色显色反应。阴性对照组仅见较淡的背景染色,而未见阳性细胞分布(图2-C)。
2.4 Ghrelin在精囊腺中的分布定位
光镜下观察,食蟹猴精囊腺的结缔组织被膜深入腺体内,将其分割为许多的腺小叶,精囊腺黏膜表面有许多皱襞,腺腔较大(图2-A)。HE染色发现精囊腺的腺上皮为假复层柱状上皮,腺腔中充满大量弱碱性被伊红深染的分泌物(图2-D)。免疫组化染色发现,精囊腺内可见散在显色反应区域(图2-A)。高倍镜下将图片进一步放大发现,显色反应只发生在精囊腺的腺腔之中(图2-B箭头所示),而精囊腺实质的染色结果(图2-B)与阴性对照组(图2-C)无明显差异。可以判定,精囊腺腺腔中的显色反应为背景色。由于细胞结构中没有发现阳性染色物质,表明食蟹猴的精囊腺中无ghrelin阳性细胞的分布。
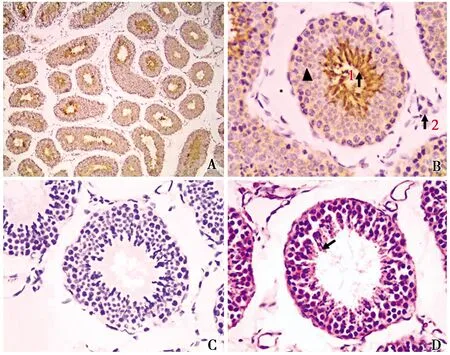
图1 Ghrelin阳性细胞在睾丸中的分布定位Fig.1 Location of ghrelin positive cells in testicles↑▲阳性表达(Positive expression);精子附着(Sperm attached) A.IHC组 The IHC group(×100);B.曲细精管 Song of seminiferous tubule(×400);C.对照组(×400)The control group;D.HE组 The HE group(×400)
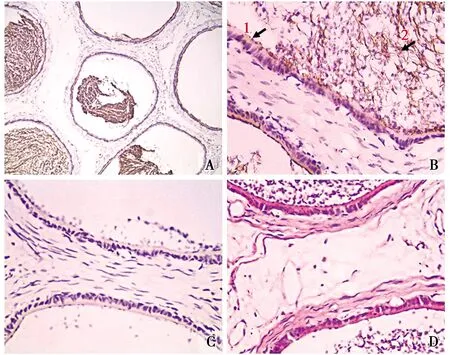
图2 Ghrelin阳性细胞在附睾中的分布定位Fig.2 Location of ghrelin positive cells in epididymis阳性表达(Positive expression) A.IHC组 The IHC group(×100);B.睾丸输出小管 Testicular output tubule(×400);C.对照组(×400)The control group;D.HE组 The HE group(×400)
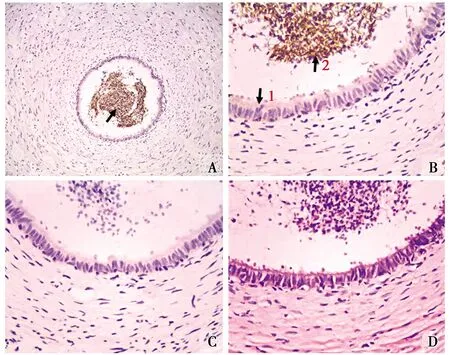
图3 Ghrelin阳性细胞在输精管中的分布定位Fig.3 Location of ghrelin positive cells in the vas deferens显色物质(Color material);↓↑阳性表达(Positive expression) A.IHC组 The IHC group(×100);B.输精管 Vas deferens(×400);C.对照组(×400)The control group;D.HE组 The HE group(×400)
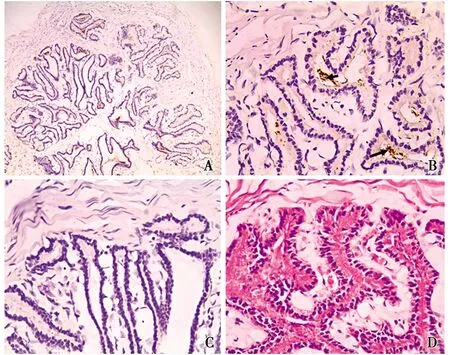
图4 Ghrelin在精囊腺中的分布定位Fig.4 Location of ghrelin distribution in seminal vesicles疑似为阳性表达的背景色(Suspected background color of positive expression) A.IHC组 The IHC group(×100);B.精囊腺 Seminal vesicle gland(×400);C.对照组(×400)The control group;D.HE组 The HE group(×400)
3 讨论
早期研究发现,在人和大鼠睾丸的成熟间质细胞内有ghrelin的表达,在人睾丸支持细胞中ghrelin表达水平较低[16]。Tena-Sempere等[17]研究发现,在幼龄大鼠和青春期前大鼠的睾丸组织中ghrelin的表达水平较弱,而在性成熟大鼠的睾丸间质细胞中表达水平较高。进一步研究发现,去除大鼠睾丸组织中的间质细胞后,大鼠睾丸中没有ghrelin阳性产物的表达,而恢复睾丸间质细胞后又可重新检测到ghrelin阳性细胞。可见,大鼠睾丸组织中的ghrelin阳性产物可能主要来源于睾丸间质细胞。Gaytan等[18]检测到在人和大鼠的睾丸支持细胞、间质细胞及输精管中均有ghrelin蛋白的表达,在生殖细胞的早期生精细胞中有分布,精子细胞则没有。王艳梅等[19]在小鼠中的研究发现,ghrelin主要表达在正常小鼠的睾丸间质细胞中。而经过X线照射后,小鼠睾丸的精原细胞、精母细胞及早期的精子细胞中均有ghrlin的表达,并推测ghrelin这种表达方式的改变可能参与小鼠辐射急性损伤后的修复过程。徐金霞[20]研究了小鼠生后不同发育阶段睾丸组织ghrelin的表达,结果显示从1到16周龄小鼠的睾丸组织中均有ghrelin的表达,且这种表达具有阶段性和选择性的特点。Ghrelin在小鼠睾丸中主要分布于被膜、睾丸间质和支持细胞中;此外,在睾丸曲细精管、生精细胞、精子细胞、管腔中也有不同程度、不同阶段的表达。
本研究表明,在食蟹猴睾丸组织中,ghrelin广泛分布于曲细精管的各层生精细胞及睾丸间质细胞中,附睾及输精管中也有分布,这些研究结果与前期研究结果相一致。而在食蟹猴精囊腺中未发现有ghrelin阳性细胞的分布,由于ghrelin在副性腺中的分布研究相关文献报道较少,故无法与其他动物进行比较分析。
本研究发现,ghrelin在睾丸组织中有较高剂量的表达,提示ghrelin可能参与生精上皮的发育及促进精子的发生。附睾及输精管的实质细胞内表达量较低,但管腔中均呈高剂量表达,且集中分布在精子尾部中。推测,睾丸、附睾及输精管中的ghrelin阳性细胞释放ghrelin进入管腔,并附着到精子上,进而参与精子的成熟。可见,ghrelin在雄性动物的生殖系统中可参与调节精子的生成与成熟过程,并由此发挥调控动物生殖生理的重要作用。然而,动物的生殖调控机制是多方面的,有关ghrelin对生殖机理的调控机制还有待进一步探讨研究。
4 结论
免疫组化染色发现,ghrelin阳性细胞在食蟹猴的生殖系统中有分布。Ghrelin免疫阳性细胞被染为棕色到棕黑色,主要分布于睾丸、附睾及输精管中,精囊腺中无ghrelin阳性细胞分布。Ghrelin阳性细胞在组织中多呈散在分布。细胞大小不一、形态各异,多呈圆形、卵圆形、锥体形、长柱形及其他不规则形。

