强化曲中毕赤酵母与地衣芽孢杆菌的相互作用研究
霍颖玙,冯儒志,黄洲明,李 勇,周宗艾,邱树毅
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.贵州大学酿酒与食品工程学院,贵州贵阳 550025;3.海南正生堂食品科技有限公司,海南海口 570216;4.贵州仁怀宏盛酒业有限公司,贵州仁怀 564501)
酒曲在白酒酿造过程中起着至关重要的作用。中国的酱香型白酒制曲工艺是高温制曲,“高温”的特点同时也加速了化学反应、生物化学反应、褐变反应与美拉德反应的进行,生成了大量的香气成分。这使得酿造出的白酒酱香风味浓郁。
高温大曲中芽孢杆菌的数量占很大的比例[1]。芽孢杆菌在酱香型白酒生产过程中担任着产香功能细菌的角色,它可以分泌如蛋白酶、淀粉酶、纤维素酶等丰富的酶系,这些酶系推动了小麦,高粱等原料分解,形成丰富的氨基酸与糖类,从而促进酱香风味的生成[2-3]。利用纯培养技术,将功能性细菌加入制曲过程中进行培养,制作功能性强化大曲,可以达到丰富风味物质以及提高白酒风味质量的目的。孟天毅等[4-5]对生产车间的强化高温大曲进行了分析,结果表明,强化大曲中的微生物与成品曲基本一致,且强化大曲的酱香风味更加突出,而成品曲则是曲香突出;强化大曲产酒酱香更加浓郁、酒体爽净,而成品曲则显得更加丰满、醇厚。杨涛等[6]将酱香大曲中所分离到的地衣芽孢杆菌、枯草芽孢杆菌、解淀粉芽孢杆菌等按一定比例混合制成三级种子液,后在拌料阶段加入到制曲过程,试验所得强化大曲的液化力、蛋白质水解力均有明显提高,并且大曲中游离氨基酸含量有所增加,运用到酿酒阶段时,糟醅的各项理化指标均有提升,酿制酒液的品质优良。
酵母菌有利于白酒的呈香作用[8-11]。但在高温制曲过程中,由于温度的升高不利于酵母菌的生长。王晓丹等[7]曾在酱香型白酒的酒醅中筛选出毕赤酵母,并发现其拥有较强的产酒产酯能力。所以,对于制作强化曲来说,如何将功能芽孢杆菌与功能酵母菌同时利用到强化曲的制作中,丰富强化曲的风味物质,提高酒曲的品质至关重要[12-18]。同时研究在酒曲制作过程中芽孢杆菌与酵母菌的相互作用,以及有益代谢物的产生可以帮助我们更好的了解微生物之间在酒曲发酵过程中的作用。
1 材料与方法
1.1 材料、试剂及仪器
1.1.1 菌种
地衣芽孢杆菌、毕赤酵母均由本课题组从贵州茅台镇酱香型白酒生产用曲中分离筛选得到。
1.1.2 试剂及培养基
干酪素(分析纯)、无水碳酸钠(分析纯)、磷酸二氢钾(分析纯),天津市海光化学试剂厂;福林酚(分析纯),北京索莱宝生物科技有限公司;三氯乙酸(分析纯)、冰乙酸(分析纯)、乙酸钠(分析纯),重庆北碚精细化工厂;磷酸氢二钾(分析纯),成都市科龙化工试剂厂。
YEPD培养基、LB培养基、孟加拉红培养基、营养琼脂培养基购于化学试剂商店。
小麦粉培养基:5 g 小麦粉中加入100 mL 水,振荡混匀,自然pH,121 ℃灭菌20 min。小麦粉,山东杨湖酒业有限公司。
1.1.3 仪器设备
离心机,美国贝克曼库尔特有限公司;Stable Flex 纤维头(DVB/CAR/PDMS),美国Supelco 公司;7890A-5975C 气相色谱质谱(gas chromatography-mass spectrometer,GC-MS)联用仪,安捷伦科技有限公司;FA1004 电子天平,上海箐海仪器有限公司;KQ-300DE 数控超声波清洗器,昆山市超声仪器有限公司。
1.2 试验方法
1.2.1 种子液的制备
毕赤酵母种子液:从PDA 培养基中挑取1 环活化好的酵母菌菌苔于YPD 培养基中,30 ℃、180 r/min振荡培养48 h。
地衣芽孢杆菌种子液:从营养琼脂培养基中挑取1 环活化好的芽孢杆菌菌苔于LB 培养基中,以37 ℃、150 r/min培养24 h。
1.2.2 芽孢杆菌对酵母细胞生长的影响
选取葡萄糖、蛋白胨和地衣芽孢杆菌发酵液作为组分,设计培养基如表1 所示。取0.5 mL 酵母种子液加入2 mL 无菌离心管中,于8000 r/min 离心10 min,去除上清液,并在沉淀中加入0.2 mL 无菌水,混匀后全部接入50 mL 酵母生长培养基中(接种量1%),于180 r/min 条件下培养24 h,并测定生物量。

表1 酵母生长培养基
1.2.3 地衣芽孢杆菌与毕赤酵母共培养研究
取1.0 mL 酵母或0.5 mL 芽孢杆菌种子液加入2 mL 无菌离心管中,于8000 r/min 离心10 min,去除上清液,并在沉淀中加入0.2 mL无菌水,混匀后全部接入50 mL小麦粉培养基中,于30 ℃、180 r/min条件下培养,每24 h取样用于测定菌落数。
1.2.4 毕赤酵母与地衣芽孢杆菌制作强化曲研究
毕赤酵母与地衣芽孢杆菌不同比例下混合发酵。地衣芽孢杆菌与毕赤酵母以1∶0.1、1∶0.5、1∶1、1∶5、1∶10 的接种比例同时接种于小麦固态培养基。接种后地衣芽孢杆菌的数量为5×106CFU/g,放于30 ℃培养箱中静置培养。
1.2.5 样品生物量测定
称取10 g 样品放于盛有90 mL 无菌生理盐水的三角瓶中,充分振荡30 min,取1 mL 充分稀释,吸取稀释液涂布于培养基中,培养计数。
1.2.6 粗酶液的制备及酶活测定
250 mL 三角瓶中加入10 g 样品,再加100 mL蒸馏水,在40 ℃的条件下水浴1 h,每15 min 搅拌1次,然后用定性滤纸过滤,将开始的5 mL 弃去,之后过滤滤液为测定酶活所需的粗酶液。
酸性蛋白酶活力检测:参照SB/T 10317—1999《蛋白酶活力测定法》对样品的酸性蛋白酶进行测定。
淀粉酶活力检测:采用改良Young J.Yoo 法[19]。
1.2.7 大曲理化指标的测定
参照QB/T 4257—2011《酿酒大曲通用分析方法》中的测定方法对大曲水分、淀粉、酸度、液化力、糖化力、酯化力、发酵力进行测定。
1.2.8 GC-MS分析实验
采用顶空固相微萃取(HS-SPME)技术结合GC-MS分析麦曲中挥发性成分[20-22]。
样品处理:取麦曲粉0.2 g加入5 mL水中,超声波处理30 min。GC-MS 条件:安捷伦6890N 气相色谱配备5975 质谱仪。毛细管柱DB-Wax(30 m×0.25 mm i.d.×0.25 μm),进样口和检测器温度均为250 ℃,载气为He,流速2 mL/min。程序升温:起始温度50 ℃,保持2 min,然后以2 ℃/min的升温速率升温到85 ℃,保留0.1 min,再以5 ℃/min 的升温速率升温到230 ℃,保持2 min。电子轰击能量70 eV,离子源温度230 ℃。质谱分析用数据库为Wiley275.L(Agilent公司)和NIST库。
2 结果与分析
2.1 芽孢杆菌对酵母菌生长影响情况(表2)
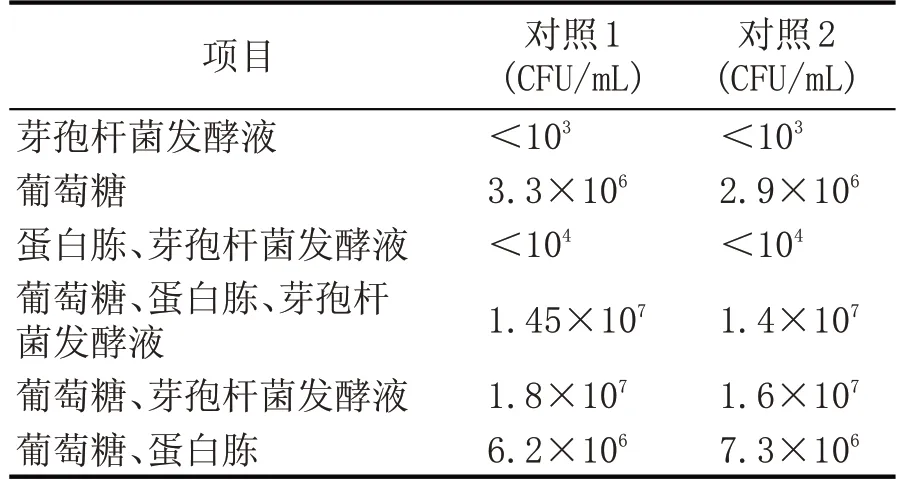
表2 毕赤酵母的生物量情况
根据表2 可知,地衣芽孢杆菌FBKL1.0199 对所选酵母的生长无抑制作用。毕赤酵母在只有地衣芽孢杆菌发酵上清液的培养基中有微弱的生长能力,但加入微量的葡萄糖和蛋白胨后生长能力获得了极大的提高,菌落总数从之前的不足103CFU/mL增加到1.45×107CFU/mL,除此之外,葡萄糖的添加也对毕赤酵母的生长有促进作用。在只有蛋白胨和发酵液的培养基中毕赤酵母的菌落总数小于104CFU/mL,而在此培养基的基础上添加了葡萄糖后,菌落总数增加到1.45×107CFU/mL。而且在只有葡萄糖的培养基中,毕赤酵母的菌落总数可达到3.3×106CFU/mL,添加微量氮源可以使酵母数量增加。由此可知,即使有地衣芽孢杆菌的存在,只要提供了毕赤酵母生长的营养成分,酵母还是可以很好的生长。
2.2 地衣芽孢杆菌与毕赤酵母共培养规律研究(图1)
在混培养体系中,毕赤酵母的最高生物量均在发酵中期,为2.96×109CFU/mL。毕赤酵母数量在培养的前72 h 内持续增加,之后便持续下降,在发酵终点毕赤酵母数量为1.14×109CFU/mL。发酵24 h 时,在混酵体系中毕赤酵母比例为16.87%,发酵中期毕赤酵母比例可上升到31%~34%,发酵终点时毕赤酵母比例又降到了12.33%。可见,在混培养体系中,毕赤酵母与地衣芽孢杆菌的混酵过程以地衣芽孢杆菌的增殖为主。在混培养体系中,毕赤酵母菌与地衣芽孢杆菌可以共同培养,地衣芽孢杆菌的增殖速度大于毕赤酵母菌的增长速度。同时研究表明,在小麦粉与水组成的小麦粉培养基中,地衣芽孢杆菌与毕赤酵母不存在明显的相互抑制的情况,所以可以将其利用于强化麦曲的制备,以达到提高麦曲品质的目的。
2.3 强化曲发酵过程中毕赤酵母与地衣芽孢杆菌生物量的变化(图2、图3)
地衣芽孢杆菌在发酵过程中一直呈生长优势,每隔2 d 以102左右的生长速率增长。在不添加毕赤酵母的实验组中,发酵14 d 以后,样品的地衣芽孢杆菌菌落总数可达到1.1×1017CFU/g。除此之外,在地衣芽孢杆菌与毕赤酵母以1∶10 的接种比例接种的实验组中,同样在发酵14 d 以后,地衣芽孢杆菌菌落总数可达到5.6×1016CFU/g。由此可知,添加毕赤酵母对地衣芽孢杆菌生长情况影响不大,地衣芽孢杆菌仍为混合培养体系中的优势菌。毕赤酵母在混合体系中培养的14 d 内,酵母菌总数始终维持在108~109CFU/g。混合体系发酵前期,生长速率较缓慢,在中期加速增长,发酵后期生长速率减慢,这可能是因为在发酵前期,小麦中的营养物质毕赤酵母还不能直接应用,所以酵母生长速度缓慢。但是随着地衣芽孢杆菌的生长,其代谢出来的酶将小麦中淀粉等营养物质分解成毕赤酵母可利用的糖类物质,满足酵母的生长条件,故而在中期生长迅速。在发酵后期由于营养物质的利用减少,生长速率也慢慢减少了下来。所以在混合培养体系中,地衣芽孢杆菌与毕赤酵母都可增长,地衣芽孢杆菌的产酶能力,对毕赤酵母的生长也有益处。所以,在强化曲的制作过程中,地衣芽孢杆菌与毕赤酵母都有一定的生物量,他们的生长对各种代谢产物的产生提供了可能。
2.4 发酵过程中混合体系酶活变化情况(图4、图5)
如图4、图5 所示,对照组为只添加芽孢杆菌的纯培养发酵体系。在不同比例的混合发酵体系中,地衣芽孢杆菌迅速生长,产生大量的代谢产物。其中在发酵前8 d,酸性蛋白酶的酶活快速增加。在这之后增长速度减小,最后曲线趋于平稳。在发酵结束时,酸性蛋白酶的酶活可达到1100~1300 U。添加酵母比例大的样品,在发酵前4 d时,酸性蛋白酶活远低于添加酵母比例小的样品。但在发酵后期,酶活迅速增长,最后与对照组相差不大。发酵前期,大量的酵母菌占据了生长优势,随着发酵的进行,地衣芽孢杆菌的迅速增长,进而产生了更多的代谢产物,提高了酶活。而且,与对照组相比,酶活的变化趋势并没有太大的差异。酵母菌的添加对酸性蛋白酶酶活的影响并不大。同样,对于淀粉酶的生长情况也没有太大的影响。淀粉酶酶活在发酵期的前8 d 迅速增长,发酵到第8~10 天时酶活趋于平稳,第10 天至发酵结束淀粉酶活缓慢降低,在发酵结束时,淀粉酶酶活可达到530~630 U。可见,地衣芽孢杆菌在混培养体系中可以不受酵母菌生长的影响,产生有利于小麦分解的酸性蛋白酶与淀粉酶。
2.5 麦曲的理化指标检测结果(表3)
不同接种比例的强化曲酸度变化不大。其中酸度最高的为接种比例为1∶5 时,达到3.3。接种比例为1∶0.5 时的样品酸度值最小,为2.5。只添加细菌发酵的对照组酸度值可达到3.79,而只添加酵母菌发酵的对照组酸度值仅有0.37,传统大曲的酸度为1.39。可见,酵母菌并不会对强化曲的酸度有太大的影响,而且酵母菌的存在稍微降低了强化曲的酸度,但添加细菌制作的强化曲的酸度略大于传统大曲的酸度。
淀粉的消耗与芽孢杆菌的添加相关。原料小麦中的淀粉含量为74.47 g/100 g,而强化曲的淀粉含量均在40.9~42.55 g/100 g。在只添加酵母菌的对照组中,淀粉含量为65.4 g/100 g,而只添加细菌发酵的对照组淀粉含量最少,为32 g/100 g。由此可见,芽孢杆菌越多对淀粉的消耗量越大。因为,芽孢杆菌可分解多种酶类,对原料淀粉进行水解代谢成小分子产物,以便于微生物后续的发酵利用。
各个接种比例的强化曲糖化力都相差不大。只添加酵母发酵的强化曲未检测出糖化力。而只添加细菌发酵的对照组糖化力最高为88U,其中传统大曲的糖化力为268 U。所以,强化曲的糖化力主要来源于细菌的代谢作用。细菌除了代谢产生蛋白酶与淀粉酶以外,还会代谢产生糖化酶。故而,添加细菌发酵的强化曲有一定的糖化力,但糖化力不高。
在添加细菌发酵的强化曲中均有检测出液化力,而只添加酵母菌发酵的对照组中,未检测出液化力。且不同的接种比例的样品,液化力并没有太大的变化。其中传统大曲的液化力为0.58,强化曲的液化力高于传统大曲的液化力。酵母的添加对液化力没有太大影响,细菌对强化曲的液化力有主要贡献意义。
接种比例为1∶10 的样品发酵力最高,为1.2。不同的接种比例之间,随着酵母菌添加量的增加发酵力逐步上升。只添加细菌的对照组中发酵力最低,仅有0.68。而且,传统大曲的发酵力为0.55,强化曲的发酵力高于传统大曲。由此可知,强化曲的发酵力主要来源于酵母菌的生长。酵母菌有较强的产酒精能力、较高的耐酒精能力与耐酸能力。它在酒化酶的作用下可以将糖转化为酒精。
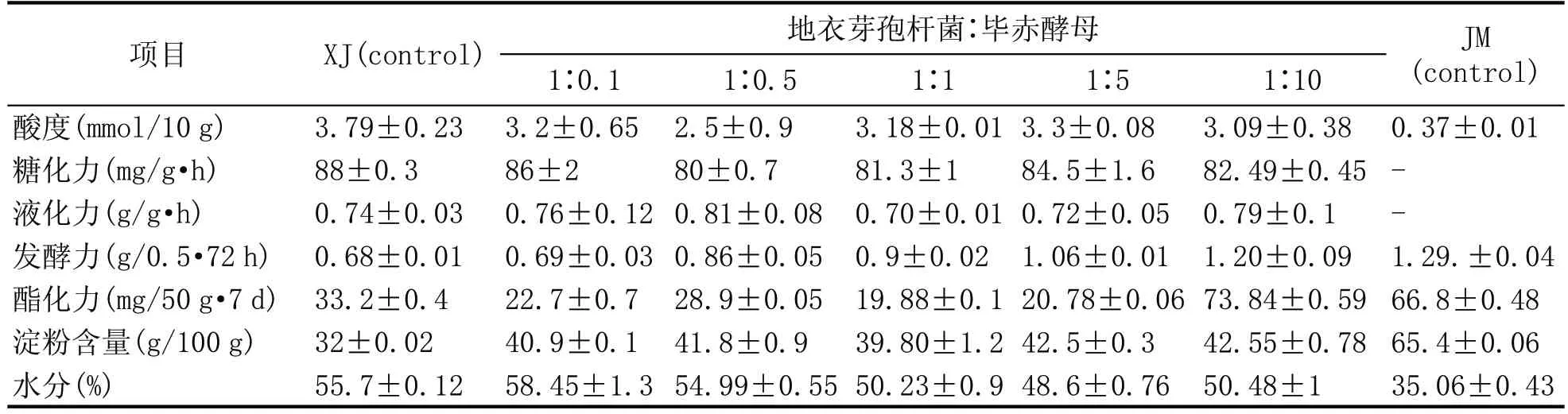
表3 强化麦曲的理化指标
当接种比例为1∶10 时,强化曲的酯化力最高达到73.84。而不添加酵母以及添加酵母含量较低的样品中酯化力均在33 以下。只添加酵母的对照组中酯化力为66.8,传统大曲的酯化力为60.3,添加酵母菌制作的强化曲酯化力高于传统大曲的酯化力。酵母菌的生长对酯化力有贡献作用。酵母菌对酯、酸有酯化能力,可以形成大曲的酯类香气。大量的酵母菌可以代谢产生酯化酶。而细菌可以代谢产生酸类物质,给酵母菌提供原料,促进酯化反应。
综上所述,对发酵结束后的几组强化麦曲进行理化指标的检测分析,根据上表的数据可知,添加功能酵母发酵培养以后,对所得麦曲的酯化力有一定的提高作用,只添加细菌培养的麦曲酯化力为33.2 U,而添加酵母菌进行发酵以后酯化力可以提高到73.84 U。对于发酵力而言,酵母的添加对麦曲的发酵力有提升,从不添加酵母的0.68 提升到1.2。而添加酵母几乎对酸度、糖化力、液化力的理化指标没有什么影响。毕赤酵母的添加对强化曲的品质影响随着毕赤酵母添加量的增加而逐步增大,地衣芽孢杆菌与毕赤酵母的混合比例1∶10 时制作出的强化麦曲的理化指标影响效果较为明显。
在初始含水量一致的情况下,随着酵母菌添加量增加,水分含量会随之小范围降低。其中,仅添加酵母菌发酵的对照组水分含量最低,为35.06%,远低于只添加细菌发酵的对照组水分含量55.7%。强化曲的水分含量高于传统大曲的水分含量。由于所检测的传统大曲是在白酒实际生产中所用的高温大曲,而强化曲样是在实验室培养的,所以水分含量普遍偏高。
2.6 GC-MS风味物质分析结果
将地衣芽孢杆菌与毕赤酵母混合比例为1∶10的发酵之后的麦曲样品进行HS-SPME 结合GCMS 分析。麦曲GC-MS 总离子图见图6。成分分析见图7。
由图6、图7 可知,麦曲中共检测到17 种物质,醛类物质1 种,醇类物质4 种,酸类物质2 种,吡嗪类物质4 种,呋喃类物质1 种,酚类物质3 种,醚类物质1 种,未检测出酮类物质。其中,吡嗪类物质含量最高,可达到19.268%,以四甲基吡嗪为主,百分比含量为16.365%。
其次是醛类化合物,所占百分比含量为5.519%,其中以苯乙醛为主,所占百分比含量为5.281%。酸类物质占总体风味物质的4.068%,醇类物质的百分比含量为7.334%。
总体来说,此麦曲检测出来风味物质较少,这可能是因为该强化曲的发酵过程全程是控制在双菌发酵的。强化曲中菌落的单一性导致了风味物质产生较少。但是,吡嗪类物质的百分比含量较高,可达19.168%,吡嗪类物质对白酒的酱香风味是有贡献意义的。除此之外,2,3-丁二醇不仅是白酒中重要的风味物质,又是重要的中间化合物前体,可氧化为3-羟基丁酮和2,3-丁二酮,同时这两种物质也是白酒中的重要风味物质。高级醇苯乙醇和4-羟基-苯乙醇是白酒中助香剂和醇甜的主要成分,是白酒中风味物质。可见功能菌种的加入,对于丰富麦曲中的酱香风味是有意义的。
3 结论
研究了在小麦培养基中,地衣芽孢杆菌与毕赤酵母的相互作用。设置了多个菌种混合比例,以不同的菌种添加比例去制作强化麦曲,研究可以提高强化麦曲的品质的最佳接种比例,也跟踪分析了在强化麦曲制作过程中微生物生物量,以及代谢产物产生情况。毕赤酵母菌的存在并不会对地衣芽孢杆菌的生长产生影响。在强化麦曲的制作过程中,地衣芽孢杆菌的生长一直处于一个上升的趋势,酵母菌的生长则处于一个先上升后降低的趋势。对强化麦曲进行GC-MS 风味物质分析可知,麦曲的风味物质虽然种类很少,但是在已检测出来的风味物质中,吡嗪类物质百分比含量最高,可达到19.268%,其中四甲基吡嗪百分比含量为16.365%。

