甲磺酸伊马替尼片在中国健康受试者中的餐后生物等效性研究
苏钰文,徐玲燕,徐延,郑枫,肖大伟
(1.南京医科大学药学院,南京 211166;2.南京医科大学附属逸夫医院临床药理研究中心,南京 211166;3.中国药科大学药学院,南京 211166;4.南京大学医学院附属鼓楼医院,南京 210008)
甲磺酸伊马替尼是高度特异酪氨酸激酶抑制剂[1],能选择性结合于c-Kit受体,血小板衍化生长因子受体,Bcr-Abl 受体及干细胞因子受体等的三磷酸腺苷结合位点,阻止磷酸基团从三磷酸腺苷向蛋白底物的转移,使之不能催化底物酪氨酸残基的磷酸化而激活下游效应分子的信号转导,进而阻止细胞的持续增殖,并恢复细胞的正常凋亡程序[2]。
甲磺酸伊马替尼片商品名为格列卫®(Gleevec),由瑞士诺华制药公司研发并于2001年经美国食品药品管理局(Food and Drug Administration,FDA)批准在美国上市[3-4],主要用于费城染色体阳性的慢性粒细胞白血病加速期、急变期或α-干扰素治疗失败后的慢性期患者,以及不能手术切除或发生转移的恶性胃肠道间质肿瘤患者,是首个分子靶向型抗癌新药[4-5]。该品种于2002年在中国上市销售。本研究以上市的甲磺酸伊马替尼片(格列卫®)为参比制剂,考察餐后状态下,中国健康受试者单剂量口服国产甲磺酸伊马替尼片的生物利用度,评价两种制剂的人体生物等效性,为国产甲磺酸伊马替尼片在我国药品监管部门注册和临床用药提供依据。
文献报道人体血浆伊马替尼人体浓度测定方法较多,多为高效液相色谱(HPLC)或高效液相色谱-串联质谱(HPLC-MS/MS)方法,但血浆样本用量和预处理方法等方面有较大差异。如杨丽玲等[6]建立了HPLC法同时测定人血浆中伊马替尼和伏立康唑浓度方法,300 μL血浆经高氯酸沉淀蛋白后HPLC进样分析,线性范围为310~20 000 ng·mL-1,此方法定量下限远高于人体血浆伊马替尼浓度,难以达到人体血浆中伊马替尼药代动力学或生物等效性研究要求。韩勇等[7]采用HPLC-MS/MS同时检测人血浆中伊马替尼及代谢物,200 μL血浆经甲醇沉淀蛋白后进样分析,线性范围达50~10 000 ng·mL-1。ZHANG等[8]建立了HPLC-MS/MS同时测定人血浆中伊马替尼及其活性代谢物N-去甲基伊马替尼的方法,200 μL血浆经乙腈沉淀蛋白后经Gemini-NX 3 μm C18柱分离,线性范围达10~2000 ng·mL-1。本研究借鉴上述方法并优化,采用UPLC-MS/MS,大大缩短了分析时间,同时提高了检测灵敏度;血浆样本以甲基叔丁基醚液液萃取,使用量减少至50 μL。本方法的建立和验证为考察甲磺酸伊马替尼片的人体药代动力学和生物等效性提供了分析基础和保证。
1 材料与方法
1.1药品、试剂和仪器 甲磺酸伊马替尼片受试制剂,中国某药企生产,规格:每片100 mg,批号:20160601;甲磺酸伊马替尼片(格列卫®)参比制剂,瑞士诺华制药有限公司生产,规格:每片100 mg,批号:WC484。甲磺酸伊马替尼对照品,南京优科制药有限公司提供,批号:20160401,含量99.9%;内标伊马替尼-d8,由TLC Pharmachem提供,批号1224-030A2,含量:99.2%;甲醇、乙腈(Merck,色谱纯);甲酸(Dikma,色谱纯);甲基叔丁基醚(Tedia,色谱纯);其他试剂均为色谱纯。Triple Quad-4500三重四级杆质谱仪,美国Applied Biosystes/Sciex公司产品;UPLC 30-AC XR超高效液相色谱,日本岛津公司产品;XS3DU百万分之一电子天平,Mettler Toledo公司。
1.2受试者选择 本研究经南京大学医院附属鼓楼医院伦理委员会审查并批准,所有受试者对本研究内容知情并自愿签署知情同意书。受试者均进行全面身体检查未发现异常,排除药物依赖史、药物过敏史,受试者在入组前3个月内未服用过药品,入组后试验期间禁止饮酒。本研究共入组24例健康志愿者,评价餐后(清淡饮食)两种制剂的生物等效性。入住南京大学医院附属鼓楼医院Ⅰ期病房试验期间,统一标准饮食。受试者入选标准:①≥18周岁男性或女性(女性≥8例);②19 kg·(m2)-1≤体质量指数<26 kg·(m2)-1;③经体格和生命体征检查、实验室检查、心电图及胸片检查,无异常或异常无临床意义者;④签署知情同意书。排除标准:①对试验药物或其辅料过敏者;②患有神经精神、心血管、消化、肾脏或血液系统疾病或有相应病史者;③HIV抗原/抗体阳性,乙肝阳性或丙肝抗体阳性,梅毒螺旋体阳性者;④烟酒嗜好者,药物滥用史者,吸毒史者;⑤过量饮用浓茶、咖啡及含咖啡因的饮品;⑥妊娠期或哺乳期妇女,3个月内有生育计划者;⑦试验前3个月有入院史,或经历大型手术,有献血史或失血超过400 mL,或参加过其他的药物临床试验;⑧试验前14 d内使用过药物;⑨研究者认为不适宜参加该临床试验的其他情况。
1.3分组、给药方法与血样采集 考虑到甲磺酸伊马替尼片受食物影响较小,且与食物同服可以显著降低药物胃肠道不良反应,因此本研究拟采用餐后(清淡饮食)条件下进行生物等效性研究。本试验为单中心、随机、开放、两周期交叉、餐后单次给药试验,采用2×2交叉试验设计,清洗期为14 d。试验前1 d,采用简单随机的方法将24例受试者分配到TR组和RT组,每组12例。受试者于给药前一天至少空腹10 h后,于给药前0.5 h进食标准餐(清淡饮食)后,以240 mL温水口服受试或参比制剂4片(每片100 mg)。所有受试者于0 h(给药前)和给药后1,2,2.5,3,3.5,4,5,6,8,12,24,36,48,72和96 h臂静脉取血4 mL于K2-EDTA抗凝采血管,分离血浆-80 ℃冰箱保存待测。
1.4测定方法
1.4.1色谱条件 色谱柱:ZIC®-HILIC(150 mm×4.6 mm,5 μm,200 A,Merck公司);柱温40 ℃;进样量:5.0 μL;流速:0.4 mL·min-1;流动相A相:0.4%甲酸水溶液(氨水调节pH值至3.2);B相:乙腈;梯度洗脱(A相:B相):30:70,0.0~2.0 min;30:70-50:50,2.0~2.1 min;50:50,2.1~3.1 min;50:50-5:95,3.1~3.2 min;5:95,3.2~4.1 min;5:95-30:70,4.1~4.2 min;30:70,4.2~5.5 min。
1.4.2质谱条件 采用正离子电喷雾离子源(ESI),多反应监测模式。喷雾电压:5000 V,气帘气:35 psi,碰撞气:8 psi,电离温度:500 ℃,雾化气(Gas 1):50 psi,辅助气(Gas 2):50 psi。伊马替尼和内标伊马替尼-d8检测离子对、去簇电压和碰撞能分别为m/z 494.3217.3,m/z 502.3225.2;170 V,170 V;35 eV,35 eV。
1.4.3血浆样本处理 精密量取血浆样本50 μL,加入20 μL伊马替尼-d8内标溶液(1 μg·mL-1),混匀后加入650 μL甲基叔丁基醚,涡旋3 min,4 ℃条件下10 000 r·min-1离心5 min,取上清液200 μL至96孔板中,35 ℃氮气流下吹干。300 μL乙腈水溶液(7:3)复溶,4 000 r·min-1离心5 min,取上清液5 μL UPLC-MS/MS进样分析。
2 结果
2.1方法学验证及结果
2.1.1专属性 分别取6份不同来源的空白血浆;伊马替尼(15.0 ng·mL-1)和内标工作液以流动相稀释后;空白血浆加入伊马替尼(5.00 ng·mL-1)和内标工作液;3名受试者第一周期给药后36 h血浆样本按“1.4.3”项下处理后UPLC-MS/MS分析,得色谱图1。伊马替尼及内标伊马替尼-d8保留时间分别为1.24 min和1.25 min。空白血浆中伊马替尼和内标伊马替尼-d8保留时间峰面积分别小于定量下限浓度水平伊马替尼峰面积的20%,伊马替尼-d8峰面积的5%。表明,空白血浆中内源性物质不存在干扰。
2.1.2标准曲线与定量下限 取浓度分别为50.00,100.00,500.0,2 500,5 000,10 000,15 000和25 000 ng·mL-1伊马替尼工作液各5 μL于eppendorf离心管,35 ℃氮气流下吹干后,分别加入空白血浆50 μL,涡旋混匀后,配制成相当于伊马替尼血浓度分别为5.00,10.0,50.0,250,500,1 000,1 500和2 500 ng·mL-1的样品。每分析批2条标准曲线,至少3个分析批,按“1.4.3”项下操作,内标法定量,以待测物浓度(X)与待测物和内标峰面积比值(Y),使用加权最小二乘法(1/χ2)回归分析,得回归方程:Y=0.001 67(±0.000 04)X-0.000 579(±0.000 306),r=0.996(±0.001),表明伊马替尼在5.00~2500 ng·mL-1范围内线性关系良好。该法测定血浆中伊马替尼的定量下限(lower linit of quantitation,LLOQ)为5.00 ng·mL-1。
2.1.3准确度与精密度 取空白血浆50 μL,按“2.1.2”项下的方法配置伊马替尼LLOQ、低(QCL)、中(QCM)、高(QCH)浓度(5,15,150,2 000 ng·mL-1)质控样品,每一浓度各6 份,连续测定3个分析批,根据当日标准曲线计算QC样本的测得浓度,并与理论浓度对比。计算测定方法的准确度及日内和日间精密度,结果表明,日内和日间方法的准确度偏差分别在-19.80%~10.50%和-19.80%~12.50%范围内,日内、日间 RSD 均<15%,符合生物等效性研究的方法学要求,结果见表1。

A.空白血浆;B.流动相中加入伊马替尼和内标伊马替尼-d8溶液;C.定量下限样品;D.3号受试者给药400 mg甲磺酸伊马替尼片后36 h样品。
图1 伊马替尼UPLC-MS/MS色谱图
A.blank plasma;B.mobile phase spiked with imatinib and internal standard(IS);C.sample of lower limit of quantitation;D.sample at 36 h after oral administration of 400 mg imatinib mesylate tablet.
Fig.1TypicalUPLC-MS/MSchromatogramsofimatinib
表1 伊马替尼的准确度和精密度


标示浓度/(ng·mL-1)准确度/%日内(n=6)日间(n=18)精密度RSD/%日内(n=6)日间(n=18)5(LLOQ)4.17±0.194.57±0.554.6211.9915(QCL)14.64±0.5214.63±0.663.574.52150(QCM)146.33±6.25139.39±8.074.275.792000(QCH)2 031.67±100.082 036.67±96.044.934.72
2.1.4提取回收率与基质效应 提取回收率考察中,取空白血浆50 μL,按“2.1.2”项下的方法配置伊马替尼低、中、高(15.0,150,2 000 ng·mL-1)浓度样本;另用流动相配置相同浓度的伊马替尼;每一浓度各6 份。以血浆样品测定的峰面积除以同浓度标准溶液峰面积所得的百分率计算提取回收率。结果显示,伊马替尼低、中、高浓度提取回收率(%)分别为(101.70±5.03)%、(100.67±6.02)%和(94.30±3.86)%,内标提取回收率(%)为(100.98±10.87)%,且RSD均<15.0%。基质效应考察中,分别使用6份不同来源的空白血浆(空白血浆除不加内标外,按“1.4.3”项下处理后加入含伊马替尼和内标流动相复溶)与流动相配置相同浓度的伊马替尼LQC、HQC(15.0,2 000 ng·mL-1)质控样品,分别计算含基质与不含基质(待测物纯溶液)待测物和内标各自基质因子,并以此计算内标归一化后的基质因子,以归一化基质因子的变异程度评价分析方法的基质效应。结果见表2,待测物经内标归一化的基质因子的RSD%均小于15%,表明无明显基质效应。
2.1.5稳定性实验 伊马替尼溶液稳定性分别考察了伊马替尼储备液(1.00 mg·mL-1)和工作液(250 ng·mL-1)在室温下放置约19 h的稳定性(CV%,7.48%),于-20 ℃下放置约32 d(CV%,-0.89%)和61 d的稳定性(CV%,3.32%)。结果表明,伊马替尼溶液稳定性良好。同时考察了伊马替尼-d8内标工作溶液(1.00 μg·mL-1)在室温下放置约20 h的稳定性(CV%,-4.41%)。结果表明,伊马替尼-d8内标工作溶液室温稳定性良好。伊马替尼血浆基质稳定性分别考察了低、高浓度(15.0,2000 ng·mL-1)血浆样本在室温下放置约19 h稳定性,处理后样品在自动进样器放置67 h稳定性,血浆样品3次冻融循环(-20 ℃~室温和-80 ℃~室温)稳定性,血浆样品于-20 ℃和-80 ℃条件下长期存储约32 d和60 d的稳定性。结果表明,伊马替尼在血浆基质中各种储存条件下稳定性均良好。
表2 伊马替尼的提取回收率与基质效应

2.2人口学资料 本研究共入组24例健康受试者(男15例,女9例)。受试者年龄(24.7±4.5)岁,身高(166.04±8.37)cm,体质量(62.25±8.86)kg,BMI(22.48±1.68)kg·(m2)-1。
2.3血药浓度-时间曲线 24例受试者餐后口服甲磺酸伊马替尼片受试制剂和参比制剂400 mg后血浆中伊马替尼的平均血药浓度-时间曲线见图2。
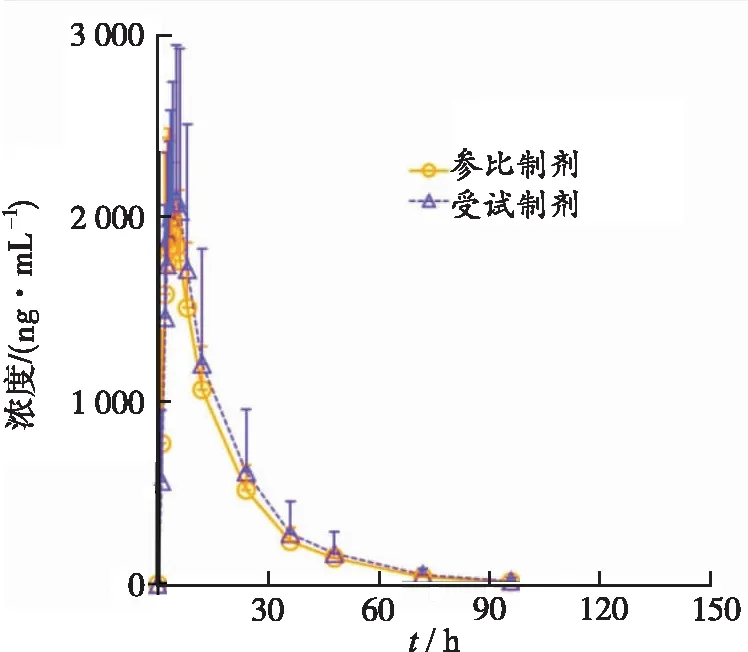
图2 24例受试者餐后口服甲磺酸伊马替尼片受试和参比制剂400 mg后伊马替尼平均血药浓度-时间曲线
Fig.2Meanplasmaconcentrationvs.timecurvesofimatinibafterasingleoraldoseoftestandreferenceformulationsat400mgin24healthyvolunteersunderfedconditions
2.4主要药动学参数 受试者餐后口服甲磺酸伊马替尼片受试和参比制剂400 mg后,血浆中伊马替尼主要药动学参数见表3。以参比制剂为标准对照,受试制剂的相对生物利用度为107.44%。
2.5生物等效性评价 甲磺酸伊马替尼片受试与参比制剂餐后给药后的Cmax、AUC0-t和AUC0-inf的几何均值的比值分别为106.88%,107.64%和107.67%,90%CI分别为95.52%~119.59%,97.07%~119.35%和97.10%~119.39%。受试和参比制剂血浆中伊马替尼的药代动力学参数Cmax、AUC0-t和AUC0-inf的几何均值比值的90% CI皆在生物等效性评价接受的(80.00%~125.00%)范围内,符合生物等效性判断标准,说明受试制剂甲磺酸伊马替尼片(规格:100 mg)与参比制剂甲磺酸伊马替尼片(规格:100 mg,商品名:格列卫®)具有生物等效性,见表4。
2.6不良反应观察 整个试验过程由研究医生和护士进行观察,相关人员均经过GCP培训并考核合格。试验期间,用药后受试制剂共有7例受试者发生不良事件(29.17%,7/24),4例受试者发生不良反应,包括1例腹泻,1例头晕和恶心,2例恶心。服用参比制剂共有7例受试者发生不良事件(29.17%,7/24),5例受试者发生不良反应,包括1例丙氨酸氨基转移酶升高,2例恶心,1例恶心、呕吐、腹泻和胃痛,1例头痛和恶心。受试和参比制剂不良事件严重程度多为1级,未发生严重不良事件。受试制剂与参比制剂相比安全性相当,总体耐受性良好。
3 讨论
本试验采用UPLC-MS/MS法测定人体血浆中伊马替尼的浓度,UPLC超高效液相分离系统使伊马替尼和内标伊马替尼-d8的保留时间分别为1.24和1.25 min,可快速、准确地测定人血浆中伊马替尼的浓度。血浆样本前处理采用甲基叔丁基醚液液萃取法简单快速,且药物和内标的回收率高(约100%),线性范围达5~2 500 ng·mL-1(定量下限为5 ng·mL-1),较文献报道检测方法[6-8]极大缩短了分析时间,同时显著提高了检测灵敏度,能满足人体血浆中伊马替尼浓度测定要求。伊马替尼结构中含吡啶环、哌啶环和氮原子等极性较大基团,常规C18色谱柱不易保留,文献报道有采用Waters XTerra RP18色谱柱[8-9]、Hypersil Gold®PFP(五氟苯基)色谱柱[10],其单价高且使用寿命较短,增加了分析成本,本文选用ZIC®-HILIC亲水作用色谱柱以梯度方式洗脱,色谱柱使用寿命长且有效改善了基质效应,同时采用伊马替尼-d8氘代内标,极大提高了方法耐用性。在流动相选择上,乙腈和0.4%甲酸水(pH值3.2)溶液作流动相以梯度方式洗脱,具有更好的分离度和响应,适用于伊马替尼人体血浆浓度测定,也与WOJNICZ等[11]报道方法相似。
餐后状态下,格列卫®(400 mg)药动学参数已有较多报道,KIM 等[12]在韩国受试者中开展了等效性研究,给予400 mg格列卫®后药动学参数分别为Tmax:3(1.5~5) h,Cmax:(1 792±357) ng·mL-1,AUC0-t:(28 485±6 274) h·ng·mL-1,AUC0-inf:(29 079±6371) h·ng·mL-1;OSTROWICZ 等[13]比较了两种规格(100 mg,400 mg)受试制剂和格列卫®(100 mg,400 mg)在白种人中生物等效性,给予格列卫®400 mg后药动学参数分别为Tmax:(4.0±1.38) h,Cmax:(1 439±459) ng·mL-1,AUC0-t:(24 149±778) h·ng·mL-1,AUC0-inf:(24 304±7 957) h·ng·mL-1。本试验评价甲磺酸伊马替尼片受试制剂(400 mg,100 mg/片*4)和参比制剂(格列卫®,400 mg,100 mg/片*4,瑞士诺华制药有限公司)餐后条件下的生物等效性。结果表明,伊马替尼药动学参数与文献报道较为一致[12-13]。
表3 24例受试者餐后口服甲磺酸伊马替尼片受试和参比制剂400 mg后伊马替尼的主要药动学参数
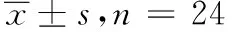

项目tmaxt1/2hCmax/(ng·mL-1)AUC0-tAUC0-inf(h·ng·mL-1)受试制剂3.47(1.98,5.98)14.23±1.452 308.3±873.5939 724.7±18 670.3040 111.0±19 014.95参比制剂2.97(1.98,6.00)14.01±1.992 119.6±597.2035 294.4±7 991.9735 595.0±8 048.28
备注:除Tmax以中位数(最小值,最大值)表示外,其他以均值±标准差表示。
Note:Tmaxis expressed in median(minimum,maximum),Others are expressed as mean±standard deviation.

表4 甲磺酸伊马替尼片受试和参比制剂生物等效性评价结果
有1例受试者在第2周期给药后6 h内呕吐,未纳入等效性评价。
One subject vomitted within 6 hours after drug administration in the second cycle,and was not included in the bioequivalence analysis.
安全性评价方面,最常见的不良事件有胃肠系统如:恶心、腹泻、口腔溃疡、呕吐和胃肠痛等;神经系统如头痛、头晕;及其他如丙氨酸氨基转移酶升高、尿白蛋白酶、尿酮体和尿潜血阳性、穿刺部位反应等。受试制剂与参比制剂均无严重不良事件发生,未发生因不良事件而中止试验的情况,与文献报道基本一致[13-15]。本试验安全性评价结果表明,餐后状态下给予400 mg(100 mg/片*4)甲磺酸伊马替尼片受试与参比制剂的人体耐受性均良好,有较好的安全性,两制剂的不良事件发生情况也类似。本研究的结果可为我国甲磺酸伊马替尼片生物等效性和药代动力学研究提供参考依据。

