COVID-19不同临床分型患者病例资料回顾性分析*
陈敏,安薇,夏飞,杨萍,廖亚玲,方莎莎,许鑫,张明伟
(江汉大学附属湖北省第三人民医院药学部,武汉 430033)
2020年1月7日,新型冠状病毒肺炎(novel coronavjrus pneumonia,NCP)经病毒分型明确为新型冠状病毒[1],2020年2月11日世界卫生组织命名为COVID-19。目前,关于 COVID-19的流行病学、临床特征及用药情况陆续有报道,但关于出院患者资料较少。本研究分析不同临床分型的COVID-19确诊出院病例的流行病学、临床症状、检验结果、影像资料及用药情况,为进一步了解COVID-19临床特征及治疗提供依据。
1 资料与方法
1.1临床资料 参照《新型冠状病毒感染的肺炎诊疗方案(试行第五版,修正版)》[2]的确诊标准,收集湖北省第三人民医院2020年1月24日—2020年2月8日符合COVID-19确诊标准的出院病历资料54份。统计患者的流行病学、临床症状、检验结果、影像资料及用药信息,并随访至2020年2月14日。如果记录中缺少数据或需要澄清,则通过与主治医生和其他医疗服务人员直接沟通获取数据。剔除其他呼吸道病毒,包括甲型流感病毒(H1N1、H3N2、H7N9)、乙型流感病毒、呼吸道合胞体病毒、副流感病毒、腺病毒、SARS和MERS感染的病例。影像资料均来自胸部CT,病原学检测标本采集于上呼吸道咽拭子,并经RT-PCR检测。
1.2方法与分组 参照《新型冠状病毒感染的肺炎诊疗方案(试行第五版修正版)》[2]临床分型标准,将54例患者入院后分为普通组23例,重症组(包括重型及危重型)25例,死亡组6例。记录患者医院或社区暴露史等流行病学资料、人口结构、入院时的体征和症状、合并症、实验室结果、其他呼吸道病原体合并感染、胸部CT表现、药物治疗和临床结果。
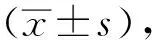
2 结果
2.1COVID-19患者流行病资料 54例确诊患者中,入院时有轻型肺炎2例,普通型肺炎有44例,重型肺炎有8例。入院后分型:普通型23例(42.6%),重症型及危重症型25例(46.3%),死亡6例(11.1%)。有33例进行核酸检测,阳性15例(45.5%),其中普通组、重症组、死亡组患者分别为2例(2/15,13.3%)、12例(12/15,80.0%)、1例(1/15,6.7%);阴性18例(54.5%),其中普通组、重症组、死亡组患者分别为13例(13/18,72.2%)、3例(3/18,16.7%)、2例(2/18,11.1%),差异有统计学意义(P<0.001);有21例未进行检测。医院内感染17例(31.5%),其中医务人员12例(22.2%)。
54例患者中,男27例,女27例,中位年龄58.5岁(43.8~69岁),普通组、重症组及死亡组患者中位年龄差异有统计学意义(P<0.01)。死亡组患者中位住院时间为6.5 d,低于普通组(11 d)和重症组(21 d),差异有统计学意义(P<0.05)。普通组、重症组、死亡组患者合并基础性疾病差异有统计学意义(P<0.01)。具体见表1。
2.2COVID-19患者临床特征 54例COVID-19患者入院时临床症状主要有发热47例(87.0%)、咳嗽41例(75.9%);约50.0%患者出现肌肉酸痛、乏力等症状;38.9%患者出现消化系统症状,如恶性、呕吐、腹泻及食欲不佳等,各组之间差异无统计学意义(P>0.05);普通组、重症组、死亡组患者出现胸闷、呼吸困难及并发症发生率差异有统计学意义(P<0.01)。在潜在的并发症中,以脓毒血症(12.9%)、呼吸窘迫综合征(16.7%)为主。具体见表2。
2.3COVID-19患者实验室检测及影像结果 早期外周血的白细胞及中性粒细胞计数正常或减少,各组之间差异无统计学意义(P>0.05)。入院时患者中位淋巴细胞计数低于正常范围,而C反应蛋白、血清淀粉样蛋白及红细胞沉降率均高于正常范围,其中普通组与重症组患者淋巴细胞计数及血清淀粉样蛋白差异有统计学意义(P<0.05)。54例患者生化指标、血钾、血钙及D-二聚体的中位数均在正常范围内,且各组之间差异无统计学意义(P>0.05)。死亡组与普通组、重症组尿素氮差异有统计学意义(P<0.05)。具体见表3。影像资料显示,入院时有37例(68.5%)患者胸部CT提示小结节状或斑片状影,有11例(20.4%)出现间质性病变。涉及下肺叶感染为53例(98.1%),涉及双肺感染为44例(81.5%)。
2.4COVID-19患者用药情况 54例COVID-19患者均使用了抗病毒药物,其中14例(25.9%)同时使用3种抗病毒药物。抗菌药物联合使用率为100.0%,重症组及死亡组使用碳青霉烯类抗菌药物比率大于80.0%,51.9%患者使用了增强免疫力的药物,85.2%患者使用了糖皮质激素药物。具体见表4。

表1 54例COVID-19患者基本信息
数据以中位数(四分位数,IQR)和n/N(%)表示。P值表示普通组、重症组与死亡组之间的比较,P1表示普通组比重症组,P2为普通组比死亡组,P3为重症组比死亡组。
The data is described as median(interquartile range,IQR) andn/N(%).Pvalue represents the comparison among the normal patient group,the severe patient group and death group.P1 represents the normal patient group vs the severe patient group,P2 represents the normal patient group vs the death group,andP3 represents the severe patient group vs the death group.
3 讨论
人冠状病毒是呼吸道感染的主要病原体之一。迄今为止,共发现7种冠状病毒可以感染人类,包括SARS-CoV、MERS-CoV及SARS-CoV-2,这3种高致病性病毒可引起人类严重呼吸综合征。另外4种冠状病毒可引起轻度上呼吸道疾病,分别HCoV-OC43、HCoV-229E、HCoV-NL63、HCoV-HKU1。尽管目前SARS-CoV-2的传染源尚未确定,但研究发现,SARS-CoV-2与SARS-CoV基因组有79.5%的相似性。从2020年2月12日起,湖北省将临床诊断病例纳入确诊病例,致使湖北省当日新增 COVID-19患者达14 840例(含临床诊断病例13 332例)。然而,随着湖北省疑似病例的减少,《冠状病毒肺炎诊疗方案(试行第六版,修正版)》[3]取消湖北省与湖北省以外其他省份的区别,统一分为“疑似病例”和“确诊病例”两类。本次研究纳入的54例 COVID-19确诊患者中有33例进行了核酸检测,阳性率为45.5%。提示核酸检测存在一定的假阴性,可能造成漏诊,或存在试剂问题、采样等问题。因此,患者的流行病学史、临床症状、影像资料及实验室指标对确诊具有重要意义。
本研究中 COVID-19早期出现发热(87.0%)、干咳(75.9%)的比例与CHEN等[4]所报道的数据接近,但出现消化系统症状(38.9%)的比例高于前期报道。实验室检测指标中,患者C反应蛋白、血清淀粉样蛋白及红细胞沉降率均高于正常范围,而淋巴细胞计数均降低,尤其是在重症组及死亡组患者中降低更明显。提示SARS-CoV-2可能与SARS-CoV一样主要作用于淋巴细胞,尤其是T淋巴细胞。一些研究表明,淋巴细胞总数的大量减少表明冠状病毒吞噬了许多免疫细胞,抑制了机体的细胞免疫功能[5]。T淋巴细胞损伤可能是导致患者病情加重的重要因素。因此,淋巴细胞绝对值降低可作为COVID-19诊断的参考指标。影像资料提示68.5%患者入院时胸部CT提示斑片状磨玻璃样密度增高影。因此,通过正确识别COVID-19患者胸部CT表现,结合患者流行病学史、临床症状和实验室检测指标,能够更加精准地诊断COVID-19感染。
本次收集的54例患者中,31.48%患者存在医院相关性传播,这一结果与文献[6]报道COVID-19医院相关性传播为41%结果接近。中国疾控中心等研究机构联合发表的近9000例COVID-19确诊病例和疑似病例数据显示,新冠肺炎的基本传染数R0则高达3.77[7]。因此,从传染性分析,SARS-CoV-2要比SARS病毒(R0:0.85-3)更强。McLellan团队利用表面等离子共振技术(SPR)发现ACE2蛋白与新型冠状病毒的亲和力竟是SARS病毒的10到20倍[8]。这可能是SARS-CoV-2的传染性增强的主要原因之一。
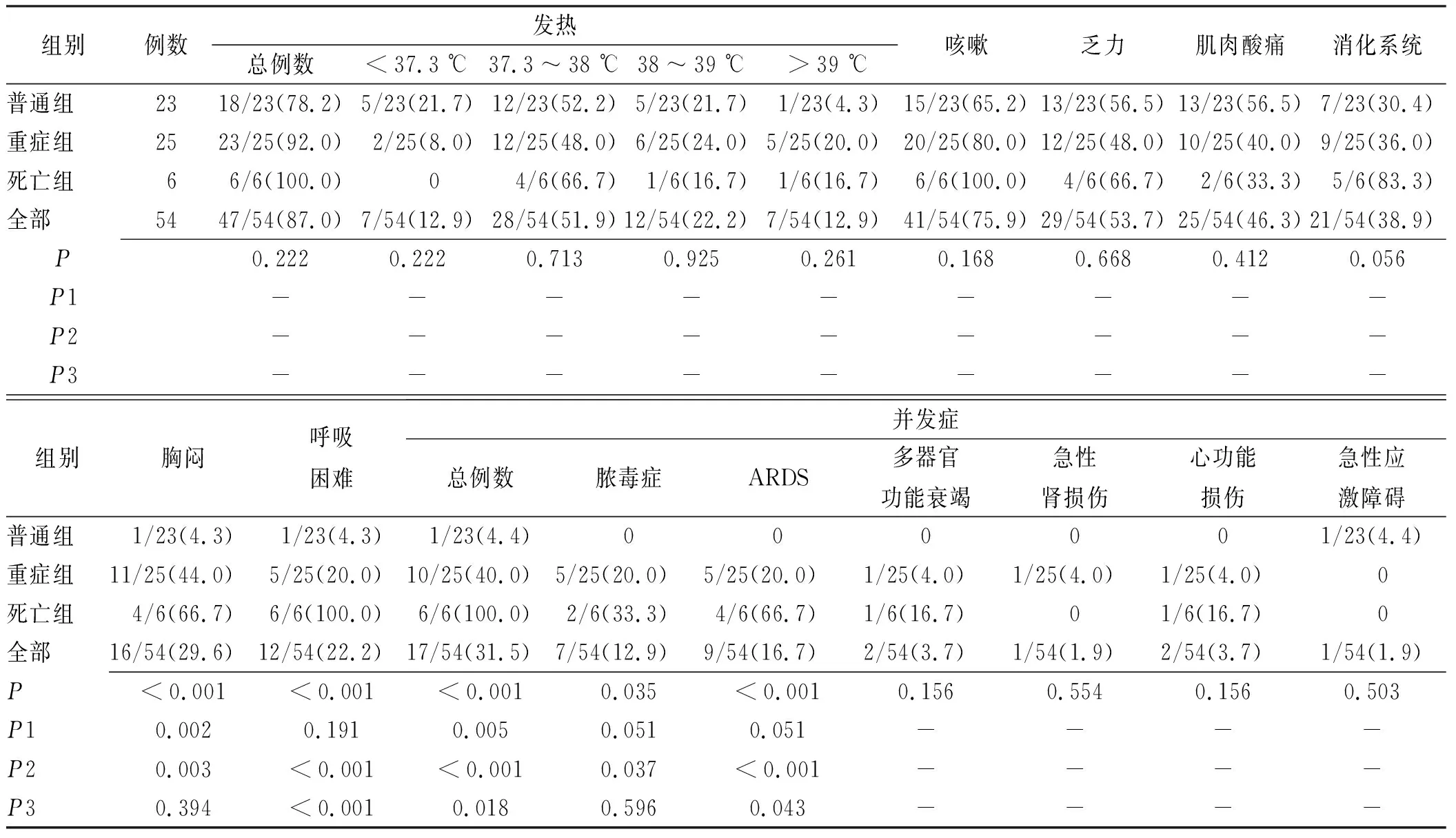
表2 54例COVID-19患者临床特征
数据以n/N(%)表示。P值表示普通组、重症组与死亡组之间的比较,P1表示普通组比重症组,P2为普通组比死亡组,P3为重症组比死亡组。
The data is described asn/N(%).P value represents the comparison among the normal patient group,the severe patient group and death group.P1 represents the normal patient group vs the severe patient group,P2 represents the normal patient group vs the death group,and P3 represents the severe patient group vs the death group.
本研究 COVID-19患者药物治疗主要参考《新型冠状病毒感染的肺炎诊疗快速指南(第一版)》[9]及新型冠状病毒的肺炎诊疗方案(试行第三版)》[10]。因此,抗病毒药物主要为奥司他韦、阿比多尔及洛匹那韦/利托那韦片,其中25.9%患者同时使用3种抗病毒药物。随着对COVID-19抗病毒治疗的不断认识,抗病毒药物治疗方案也在不断调整。如奥司他韦不再被推荐用于 COVID-19的治疗,而磷酸氯喹及利巴韦林被纳入抗病毒治疗方案中。尽管目前推荐的抗病毒药物品种繁多,但并不建议同时应用3种以上抗病毒药物。本次收集54例患者中,抗菌药物也存在不合理使用现象,即联合使用抗菌药物比例达100.0%,重症组和死亡组患者使用碳青霉烯类抗菌药物比率均>80%。抗菌药物对病毒并无抑制和杀灭作用,仅在明确合并细菌感染时考虑使用。因此对于COVID-19患者应避免盲目或不恰当使用抗菌药物,尤其是联合使用抗菌药物。本研究中有69.6%普通型患者使用甲泼尼龙。参考《重症新型冠状病毒感染肺炎诊疗与管理共识》[11]推荐,对存在重症高危因素的普通型COVID-19可给予小剂量、短时间的皮质类固醇治疗。而WHO发布的临床指南中建议,除非另有说明,对SARS-CoV-2感染者不推荐使用皮质类固醇[12]。最新临床证据表明, COVID-19接受皮质类固醇治疗,可以抑制肺部炎症,但也会抑制免疫反应,阻止其清除病原体,除临床试验外,不应使用皮质类固醇治疗SARS-CoV-2引起的肺损伤或休克[13]。《冠状病毒肺炎诊疗方案(试行第六版,修正版)》[3]推荐,仅对于氧合指标进行性恶化、影像学进展迅速、机体炎症反应过度激活状态的患者,可酌情短期内(3~5 d)使用糖皮质激素。因此,对于普通型患者不应广泛使用糖皮质激素。有研究报道,甘草酸类制剂及乌司他丁具有类似肾上腺皮质激素的非特异性抗炎作用,而无抑制免疫功能及股骨头坏死等不良反应,推荐用于重症肺炎患者的抗炎治疗[14-15]。但是由于缺乏临床研究,目前这些药物在COVID-19治疗中的有效性及安全性有待进一步观察。
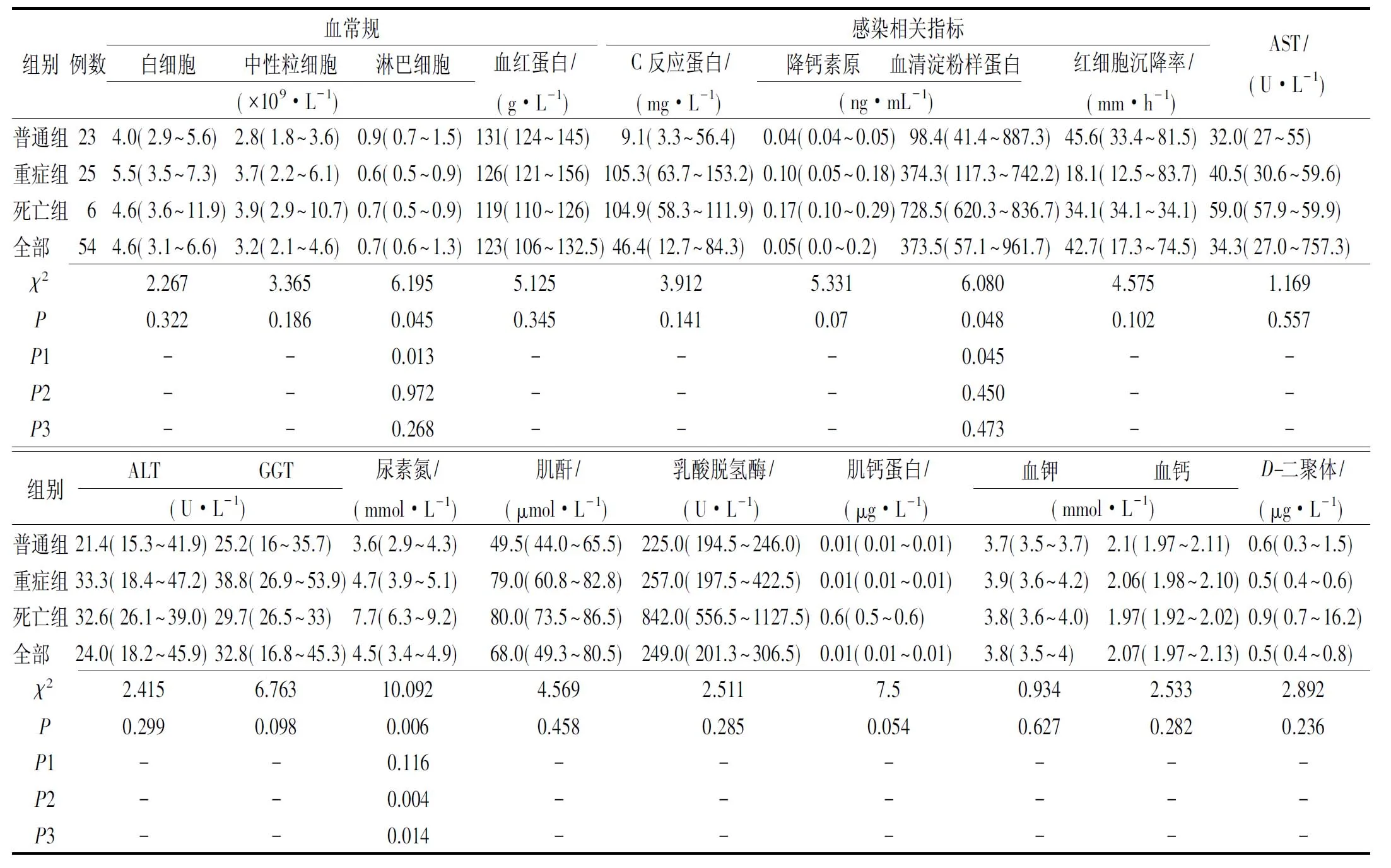
表3 54例COVID-19患者入院时实验室检查结果
数据以中位数(四分位数,IQR)和n/N(%)表示。P值表示普通组、重症组与死亡组之间的比较,P1表示普通组比重症组,P2为普通组比死亡组,P3为重症组比死亡组。
The data is described as median(interquartile range,IQR) andn/N(%).Pvalue represents the comparison among the normal patient group,the severe patient group and death group.P1 represents the normal patient group vs the severe patient group,P2 represents the normal patient group vs the death group,andP3 represents the severe patient group vs the death group.
表4 54例COVID-19患者住院期间药物治疗
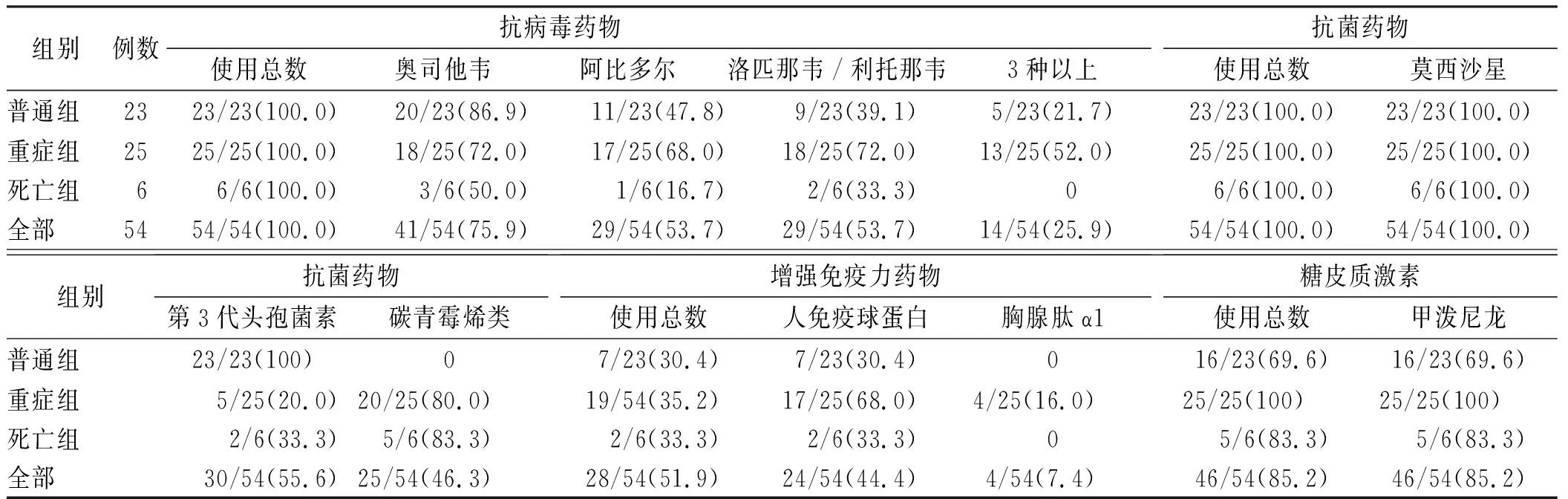
Tab.4 Drug treatment of 54 patients with COVID-19n=54
COVID-19核酸检测存在一定的假阴性。不同患者的临床症状、实验室指标中淋巴细胞计数、C反应蛋白、血清淀粉样蛋白、红细胞沉降率及影像资料存在差异,可作为 COVID-19确诊的参考指标。 COVID-19患者药物治疗普遍存在不合理现象,尤其是抗病毒药物、抗菌药物及糖皮质激素的药物使用,应引起临床重视。

