通过对比NSG小鼠探讨正常免疫小鼠人结肠癌移植瘤模型的特点和意义
程姝敏,张 凯,谌 通,毕研贞,刘铜军,孔令斌,唐慧昕,王全义,洪 丰*,舒振锋
(1.济宁医学院临床学院,山东 济宁272000;2.吉林大学第二医院;3.吉林大学中日联谊医院;4.首都医科大学附属北京佑安医院;5.济宁医学院附属医院;6.上海美峰生物技术有限公司)
CDX(cell-line-derived xenograft)模型是将人肿瘤细胞系接种到免疫缺陷小鼠体内构建的模型[1],此模型均是以裸鼠、NSG小鼠等为实验动物,具有人肿瘤细胞遗传、分子、形态结构等方面的特征,能反映人肿瘤遗传多样性[2,3],但因为缺少正常免疫系统,难以确切、真实地反映肿瘤发生、发展与患者免疫功能变化之间的内在联系。此实验借助新型微载体材料,在具有正常免疫系统C57BL/6小鼠背部种植人源性结肠癌细胞,同样方法种植于NSG小鼠背部,通过比较两种小鼠的成瘤情况及肿瘤病理特点等,探讨具有正常免疫功能C57BL/6小鼠人结肠癌移植瘤模型构建及其意义。此模型的成功构建为揭示结肠癌发病机制和研制抗结肠癌新药提供了更合适的模型。
1 材料与方法
1.1 微载体、细胞系
微载体:新型微载体microcarrier 6是由美国 ELYON BIOTECHNOLOGIES LLC公司提供的具有低免疫原性、生物兼融性等特点的多孔支架(图1 A)[4]。细胞系:人结肠癌HCT116细胞贴壁培养于由Sigma公司生产的RPMI-1640 DMEM和10%国产胎牛血清的完全培养液(图1 B)。
1.2 实验动物C57BL/6小鼠20只,6-8周龄,22-25 g体质量,雄性小鼠;NSG小鼠20只,6-8周龄,22-25 g体质量,雄性小鼠,均购自济南朋悦实验动物繁育有限公司。饲养于无特定病原体(specific pathogen-free,SPF)级实验动物中心,整个试验过程均符合实验室动物护理和使用委员会指南的要求。
1.3 C57BL/6、NSG小鼠人结肠癌模型的分组及建立将C57BL/6、NSG小鼠分别按移植物的不同分为细胞对照组、细胞-微载体复合物实验组,每组各10只。C57BL/6、NSG小鼠均按照以下要求接种于背部皮下:对照组每只小鼠接种含2×107个/mL HCT116细胞PBS液100 μl;实验组每只小鼠接种含2×107个/mL HCT116细胞和20 μg微载体的复合物悬液100 μl。细胞-微载体复合物(图1 C)是由对数生长期HCT116细胞与处理修饰后的微载体混合而成,调整细胞及微载体浓度后,为使微载体内细胞达到饱和,放于5%CO2、37℃培养箱中培养24 h。
1.4 C57BL/6、NSG小鼠肿瘤生长观察指标皮下注射移植物后每日观察小鼠的食欲、活动度及体质量变化,记录成瘤时间、瘤体大小和成瘤率[5]。接种后4周处死荷瘤小鼠,常规解剖,记录肿瘤的体积、质地、浸润以及坏死程度。移植瘤病理组织行常规HE染色、免疫组化染色,一抗CDX-2、CEA均由福州迈新生物技术开发有限公司提供。

图1 A新型微载体microcarrier 6(100×);B人结肠癌HCT116细胞(200×);C细胞-微载体复合物(200×)
2 结果
2.1 C57BL/6、NSG小鼠生存及肿瘤生长情况
2.1.1C57BL/6小鼠生存及肿瘤生长情况 实验组和对照组均无小鼠死亡。实验组小鼠于13天开始,食欲、活动度较前减少,体质量较前增加;对照组小鼠食欲、活动度,体质量较前无显著性差异。
实验组C57BL/6小鼠共接种10只,8只成瘤,成瘤率达80%(图2 A)。接种的第7-9天,背部可触及肿瘤,13-17天肉眼可见背部皮下隆起肿块,生长迅速,4周时,肿块体积约0.6-1.1 cm3,生长曲线见图3。形态相对规整,圆形或椭圆形,红白相间,表面可见新生血管。对照组C57BL/6小鼠整个实验过程中均未成瘤。
2.1.2NSG小鼠生存及肿瘤生长情况 实验组NSG小鼠10只,无死亡;细胞对照组NSG小鼠10只,死亡1只。实验组、对照组小鼠均于5天开始,食欲、活动度较前减少,体质量较前增加。
实验组NSG小鼠9只成瘤,成瘤率达90%(图2 B);对照组共接种10只,死亡1只未成瘤,余均成瘤,成瘤率达90%。实验组、对照组均于接种的第5-7天,背部可触及肿瘤。10-15天肉眼可见背部皮下隆起肿块,生长迅速,4周时,肿块体积约0.8-1.3 cm3,生长曲线见图3,形态相对规整,圆形或椭圆形,红白相间,表面可见新生血管。
2.2 C57BL/6、NSG小鼠病理组织学检查
C57BL/6、NSG小鼠病理组织学均表现为:移植瘤包膜完整,易与周围组织分离,形态多样,以椭圆形为主,表面见新生血管网(图2 C)。光镜下可见大量核大深染的异型性细胞杂乱排列,染色质呈粗颗粒状,核仁明显,核分裂像增多,并向周围组织浸润生长,肿瘤边缘见新生血管生成,中央偶见坏死(图4A、4B)。实验组肿瘤组织内偶见未被清除的少量残余微载体(图4 C)。
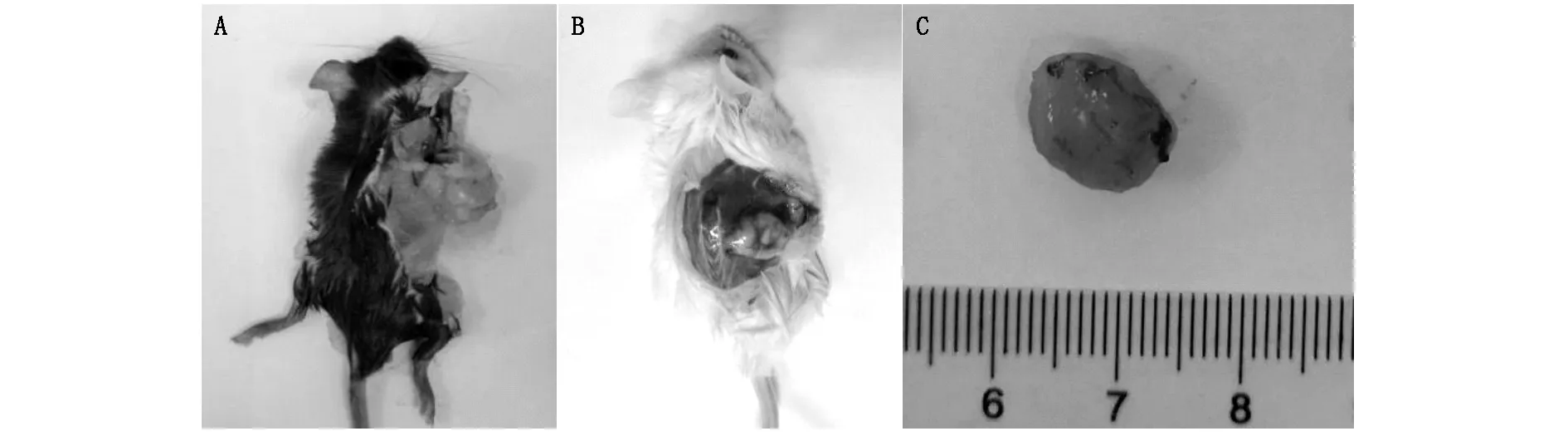
图2 A C57BL/6荷瘤小鼠;B NSG荷瘤小鼠;C 移植瘤

图3 移植瘤生长曲线
2.3 免疫组化检测结果
免疫组化染色示CDX-2、CEA均为阳性表达(图5A、5B),染色结果判定:阳性颗粒定位于肿瘤细胞质内,阳性细胞数≤5%为阴性(-),阳性细胞数≥5%为(+),证实异型细胞为人源性结肠癌细胞(图5)。

图4 移植瘤HE染色 A移植瘤(100×);B移植瘤(200×);C移植瘤(200×)箭头:残余微载体。

图5 移植瘤免疫组化染色(200×) A:CDX-2;B:CEA
3 讨论
目前国内外常用于研究肿瘤的动物模型有CDX模型和人源肿瘤异种移植(patient-derived xenograft,PDX)模型[6]。这些模型均采用免疫缺陷小鼠,其中NSG小鼠为免疫缺陷程度最高的小鼠,对异源性细胞几乎没有排斥反应,是最适合异源性移植的工具鼠[7]。然而肿瘤的发生发展与机体免疫力密切相关,该模型鼠缺少免疫系统,不能阐明肿瘤形成过程中与宿主免疫系统之间的相互影响,也无法筛选一些通过免疫功能激活的抗肿瘤药物。
该实验借助一种新型微载体—microcarrier6,成功构建了以正常免疫小鼠为动物模型的人结肠癌移植瘤模型,弥补了因免疫缺陷小鼠缺乏免疫细胞而不能准确模拟机体免疫系统对肿瘤的免疫攻击等重要缺点。microcarrier6具备低免疫源性,可减小不同种属间免疫相关冲突,大量肿瘤细胞以微载体为支架,聚集并快速生长,经胶原蛋白和SDF-1a修饰后,有利于新生血管深入微载体网状结构内,为肿瘤的生长提供足够的营养[8,9]。该实验中,C57BL/6小鼠实验组成瘤率可达80%,对照组均未成瘤,提示微载体具有屏障作用,能减少免疫系统对异源性结肠癌细胞的直接杀伤及/或排斥作用。同样将结肠癌细胞系种植于NSG小鼠,实验组与对照组均成瘤,成瘤率达90%,镜下病理除实验组偶有残余微载体,其余结果两组均一致,表明在免疫系统缺陷的情况下,无论是否存在microcarrier6,结肠癌细胞系均可在NSG小鼠移植部位成瘤。C57BL/6小鼠与NSG小鼠相比,虽然成瘤速度慢,但镜下病理组织均表现为大量核大深染的异型肿瘤细胞杂乱排列,并向周围组织浸润生长,肿瘤边缘见新生血管生成,中央偶见坏死。免疫组化示CDX-2、CEA均为阳性表达,证实异型细胞为人源性结肠癌细胞。
综上所述,本实验借助新型材料—微载体,成功构建了正常免疫小鼠的结肠癌移植瘤模型,此方法成瘤率高、操作简单,可重复性强,为研究结肠癌发病机制和临床抗肿瘤药物筛选,尤其是免疫抗肿瘤药筛选以及抗结肠癌新药的研发提供了新的更理想的动物移植瘤模型。

