体外膜氧合治疗成人急性呼吸窘迫综合征影响因素分析
王立强,程周,廖小卒,李斌飞,陈郡兴
据相关报道[1],急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)现已经是一种临床常见病,占据了所有进入ICU病因的10%。ARDS是一种可导致低氧血症、高碳酸血症、肺动脉高压、肺死腔增加和肺顺应性降低的过度的肺部炎性反应;现通常采用机械通气,并结合小潮气量、高呼气末正压(positive end -expiratory pressure,PEEP)、肌松药物和俯卧位进行治疗;虽然治疗方案不断优化,但重症患者的院内死亡率仍高达40%以上,极重度ARDS患者的死亡率更高[2]。在常规方案效果不佳时,静脉-静脉体外膜氧合(veno-venous extracorporeal membrane oxygenation,V-V ECMO)是首选的援救策略[3],为肺的后续恢复提供宝贵时间。本研究旨在对2017年1月至2019年4月期间一组应用V-V ECMO辅助治疗成人ARDS患者的临床资料进行回顾性分析,以总结影响预后的危险因素。
1 对象与方法
1.1 研究对象系统性的回顾中山市人民医院2017年1月至2019年4 月期间18岁及以上患者建立V-V ECMO治疗重度ARDS患者病例;排除标准:ECMO辅助不足24 h者或患者怀孕。
1.2 研究方法回顾患者ECMO过程中的基本情况,包括术前情况、行ECMO期间的相关临床情况、并发症及预后情况等资料。将患者分为2 组:成功撤离ECMO组(成功组)及未成功撤离ECMO组(失败组)。成功撤离ECMO定义为撤离后患者存活超过24 h,且此期间不需再次行ECMO辅助治疗。
1.3 ECMO上机时机患者均符合2012 年重度ARDS诊断“柏林标准”[4]:重度ARDS患者,在传统治疗方法(呼吸机、俯卧位等)氧合指数[动脉氧分压/吸入氧浓度分数(PaO2/FiO2)]<60 mm Hg 超过2 h或PaO2/FiO2<80 mm Hg 超过6 h;同时不合并严重的心脏疾病,心脏彩超提示心脏射血分数(ejection fraction,EF)≥0.40;禁忌证:①肿瘤晚期、不可逆的疾病;②存在严重中枢神经系统损害。上机时机评估均由固定医务人员完成。
1.4 ECMO应用行ECMO辅助的患者均使用美敦力ECMO机器(型号ECMO 560)、成套ECMO管路(美敦力公司:型号CB1Q91R6)、膜式氧合器(麦道斯医疗公司:型号hilite 7000LT),置管采用美敦力整体股静脉、动脉插管(静脉型号CB96670-021/019、动脉型号CB96570-019/017/015),所有患者的管道型号均由同一组医生根据患者情况决定,均采用V-V ECMO模式对患者进行辅助,选择超声引导下经皮穿刺行左或右股静脉置管、右侧颈内静脉,置管完成后利用彩超或X光确定管道位置,股静脉置管位置一般在下腔入口下方,右颈内置管位置在上腔入口处,经股静脉引流血液,注入颈内静脉。
1.5 ECMO管理
1.5.1 ECMO辅助期间所有患者均给予镇静镇痛,深镇静患者每天至少停药尝试唤醒一次,及时观察患者神志及瞳孔变化。
1.5.2 呼吸机采用小潮气量联合PEEP 的“肺保护性通气”,均联合压力控制通气,目标吸气峰压为20 ~25 cmH2O,呼吸频率为10 ~15次/min,PEEP通气为10~15 cmH2O,以及FiO2为0.3~0.6,必要时结合肌松药物及俯卧位等措施。
1.5.3 根据活化凝血时间(activite clotting time,ACT)、部分凝血活酶时间(activated partial thromboplastin time,APTT)等结果以及全身出凝血情况调整肝素抗凝用量,全身无出血倾向的情况下维持ACT 值在180 ~220 s,维持APTT 在60 ~80 s,如有出血或出血倾向相应降低抗凝要求。
1.5.4 根据血压情况调整血管活性药物应用,维持平均动脉压(mean arterial pressure,MAP)在60 mm Hg以上,如患者出现循环难以维持甚至心脏骤停时,及时更改ECMO模式为静脉-动脉(veno-arterial,VA)或V-V-A ECMO模式。
1.5.5 待患者肺部病情好转后,逐步降低流量至1.5 L/min,最后拔除ECMO氧气源,观察超过2 h,血气监测及生命体征满意情况下撤离ECMO。以上主要操作与评估均由固定医务人员完成。
1.6 数据采集提取患者一般资料(性别、年龄、疾病史等),ECMO期间相关临床情况(辅助时间、并发症等),ECMO期间生化指标(乳酸、生化检查等),以及是否成功撤离ECMO。
1.7 统计学分析采用SPSS 23.0统计软件。计量资料根据分布类型,采用(±s)表示或中位数(M)及四分位数间距(Q)进行统计描述,组间比较采用独立样本t检验或秩和检验。计数资料比较采用χ2检验或Fisher 确切概率法;通过组间单因素分析筛选出影响ECMO辅助撤离的可能危险因素,对单因素有差异的计量资料进行ROC曲线分析,以临界值为分割点分为二分类变量,将所有有差异变量纳入Logistic回归,进行多因素分析,确定影响预后的独立危险因素,以P<0.05为差异具有统计学意义。
2 结果
2.1 患者的一般资料及临床合并症情况本研究共纳入研究对象52例,其中男性32例,女性20例,年龄21~77(48.3±15.1)岁,成功组为27例(52%),失败组为25例(48%),成功组患者后续院内失败4例,总存活出院率为44%(23/52)。
成功组和失败组患者的一般情况:年龄、性别、估测体重、术前合并疾病(高血压/糖尿病)等方面比较无明显差异(P>0.05);ECMO辅助期间数据:V-V ECMO辅助前机械通气时间、潮气量、PEEP、最差氧合指数、乳酸、MAP,ECMO后24 h流量、24 h PaO2,ECMO总的辅助时间方面无明显差异(P>0.05);但两组患者在以下因素:ECMO前APACHEⅡ评分、ECMO后24 h 乳酸水平、需行连续性肾脏替代治疗(continuous renal replacement therapy,CRRT)、肺部并发症(气胸或肺出血)、脑出血、需更改ECMO模式,均有统计学差异(P<0.05)。同时,本研究发现ECMO辅助后,除失败组的乳酸水平有升高外,其他指标均有好转,且组内在ECMO后24 h氧合指数及动脉氧分压变化方面与ECMO前比较均有统计学差异(P<0.001)。见表1、2。
2.2 ROC曲线分析对单因素有差异的计量资料绘制ROC曲线,结果显示:ECMO前APACHEⅡ评分、ECMO后24 h 乳酸水平的ROC曲线P均<0.05,计算得出ECMO前APACHEⅡ评分临界值18.5、ECMO后24 h 乳酸水平临界值:3.10 mmol/L。见图1。
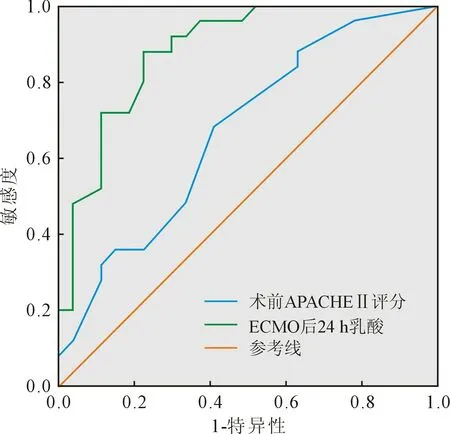
图1 ECMO前APACHEⅡ评分/ECMO后24 h乳酸水平ROC曲线
2.3 多因素分析将成功组与失败组比较有差异的变量以二分类形式纳入Logistic多因素回归分析,其中ECMO前APACHEⅡ评分、ECMO后24 h乳酸水平以临界值为分割点分为二分类变量(ECMO前APACHEⅡ评分为>18.5或≤18.5,ECMO后24 h乳酸水平为>3.10 mmol/L 或≤3.10 mmol/L),采用自变量逐步进入法,选取分类表中预测准确率总计百分比较高(预测总计百分比为82.7%)的模型,该模型排除了以下变量:ECMO前APACHEⅡ评分、肺部并发症、脑出血、更改ECMO模式。结果表明:ECMO后24 h 乳酸水平、是否行CRRT 是影响患者ECMO成功撤离的独立危险因素(P<0.05)。见表3。
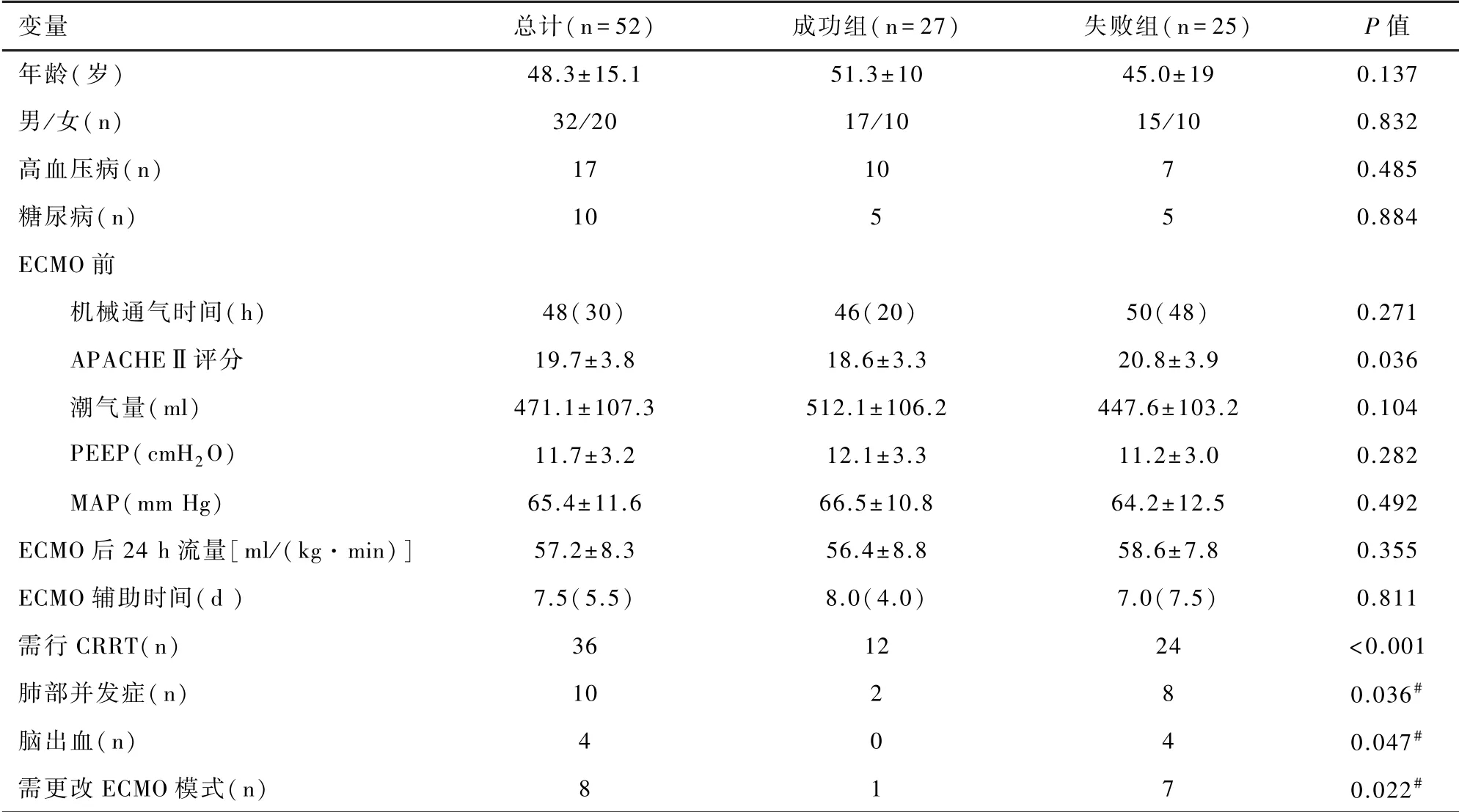
表1患者一般情况及ECMO期间数据分析
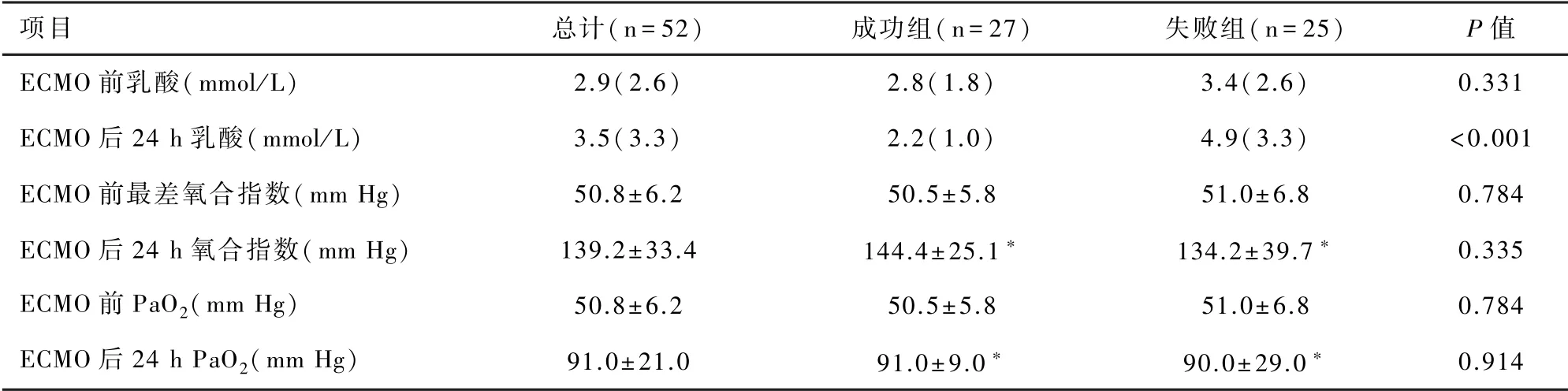
表2 ECMO前后相关参数的变化
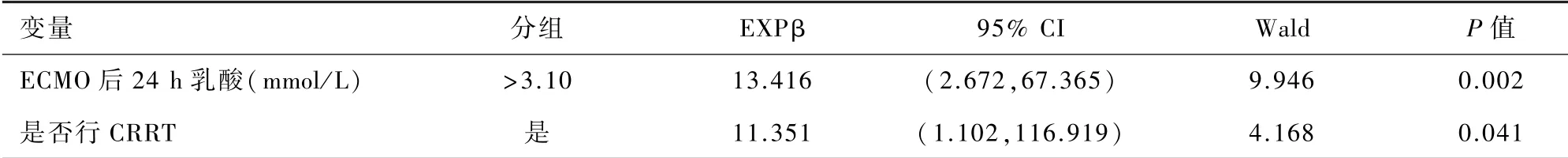
表3患者ECMO辅助期间Logistic多因素分析
3 讨论
多项研究表明[3,5],ECMO辅助能否撤离是关乎患者后续存活出院的关键因素之一。本研究共52例患者,病因包括肺部感染合并ARDS 45例(86.5%)、stanford A型主动脉夹层术后ARDS 4 例(7.7%)、其他如严重创伤等引起ARDS 3例(5.8%);其中成功组27例(52%)和失败组25例(48%),成功组患者后续院内失败4例,总存活出院率为44%(23/52)。本组病例的存活出院率(44%)与Natt 等[5]统计的2008年至2012年美国使用ECMO治疗重度ARDS病例(36%)比较略高;本研究中成功撤离ECMO组85%的患者存活出院,与Brogan 等[6]的研究结论相近。
本研究发现ECMO后24 h乳酸水平及需行CRRT 治疗是患者ECMO撤离失败的独立危险因素。乳酸水平反映全身组织氧合灌注情况,缺氧或低灌注时,组织利用氧障碍,无氧代谢增强,从而导致乳酸升高。ARDS患者肺部病变严重,氧合情况差,全身氧供难以维持,乳酸水平升高,本组病例所有患者在ECMO辅助前乳酸水平均高于正常,且失败组高于成功组,但两组没有显著差异,而ECMO后24 h 乳酸水平失败组显著高于成功组;在ECMO辅助后,如果乳酸水平仍不能得到改善或仍继续增加,提示病情危重,疾病进展难以逆转,预示着不良的结局,这与Bonizzoli等[7]研究结论相似。同时,绘制ECMO后24 h 乳酸水平的ROC曲线,得出其临界值:3.10 mmol/L(敏感度0.880,特异度0.778)。
本研究中96%失败组患者(24/25)均使用CRRT,而成功组使用率为44%(12/27)。CRRT 的使用与肾功能不全、液体超负荷、内环境紊乱、低血压、儿茶酚胺分泌增加及全身炎症反应等因素有关[8],ECMO联合CRRT 使用也会增加血液破坏、溶血、出血、感染等风险[9-10];因此,ECMO辅助期间的并发症如出血、血栓、肾功能不全等发生率较高,并且会影响成功率[2]。若ARDS患者在V-V ECMO期间不需使用CRRT,预示着较好的临床预后;保护良好的肾脏,对提高V-V ECMO救治成功有重要意义。
本研究单因素分析结果表明:ECMO前APACHEⅡ评分、肺部并发症(成功组2例/失败组8例)、脑出血(成功组0例/失败组4例)、需更改ECMO模式(成功组1例/失败组7例)均可能是影响ECMO辅助能否成功的因素,这与Park 等研究[2,6]相似。本组中有8例患者发生一侧或双侧气胸,2例发生肺部严重出血。气胸是ARDS期间较常见的并发症,原因可能与ECMO前呼吸机相关的肺部损伤、肺部顺应性降低、后期肺部炎症加重等相关[11]。因此,在ECMO期间要注意肺部保护,避免持续过高的气道峰压等造成的肺部损伤。据报道[10-11]大约有20%的V-V ECMO患者会出现不同严重程度的出血(置管处出血、脑出血、呼吸道出血等),出血的原因如使用抗凝药物、血小板减少以及凝血因子消耗等。本组有2例肺出血、4例脑出血(经过CT 影像学诊断)均出现在失败组。ECMO期间,应全面评估抗凝与凝血的平衡,严密观测全身出凝血的情况及意识瞳孔变化[12-13]。严重的ARDS患者,广泛的肺部病变及高条件的机械通气均会影响肺血管功能,加重右心后负荷[14],同时患者可能合并脓毒症(脓毒性心肌病)和酸中毒等代谢紊乱也会影响心脏功能,在V-V ECMO治疗期间出现循环难以维持甚至心脏骤停时,需及时更改ECMO 模式,本组有8例患者ECMO 模式后续更改为V-A或V-V-A ECMO模式,其中成功组1例,失败组7例,需更改ECMO 模式常提示患者预后欠佳[9],因此,在V-V ECMO期间应注意维持循环稳定。但以上几点因素在本研究的多因素分析中未显示有显著差异,可能与研究样本量较少等有关。
本研究尚存在一定的不足之处:①研究为回顾性分析;②单中心,样本量较少;③缺乏对患者的病因及存活时间的分析;④研究中有部分病例因为经济原因要求放弃ECMO及呼吸机治疗,选择出院回家,此类病例均被认定为失败组(撤离ECMO 24 h内死亡),可能会对实验结果产生一定影响。未来将联合多中心更全面的开展临床研究。
综上,在ECMO辅助治疗成人ARDS期间,ECMO后24 h乳酸水平(>3.10 mmol/L)与需行CRRT是导致ECMO撤离失败的两个独立危险因素。ECMO前APACHEⅡ评分(>18.5)、ECMO辅助期间合并肺部并发症、颅内出血、需更改ECMO模式等因素可能是导致ECMO辅助失败的不利因素。

