氧糖剥夺再灌注后星形胶质细胞活化、损伤、凋亡、自噬变化及意义
胆迎,李晨
天津市第五中心医院,天津300450
脑卒中是由于脑组织缺血或出血导致局部供血中断而引起脑组织损伤的严重疾病,可导致神经功能障碍、神经退行性疾病甚至死亡[1~3]。星形胶质细胞作为脑内最为丰富的神经胶质细胞,负责水和电解质稳态、谷氨酸摄取、脑血流调节、血脑屏障的维持、神经可塑性的调节以及神经营养和神经保护因子的分泌[4~6]。脑缺血后星形胶质细胞活性降低[7]。减轻星形胶质细胞在脑缺血期间损伤是研究的主要方向。自噬通过降解受损细胞器和错误折叠的蛋白质以维持细胞稳态和正常细胞功能[8]。缺血性卒中后,大脑中各种类型细胞中自噬被激活。然而,自噬在缺血性脑卒中过程中的具体作用和分子机制尚未阐明[9]。2019年1~10月,本研究采用体外培养的原代小鼠星形胶质细胞制作氧糖剥夺再灌注(OGD/R)模型模拟体内脑卒中损伤,观察了OGD/R后星形胶质细胞活化、损伤、凋亡、自噬水平的变化,探讨自噬在星形胶质细胞缺血性损伤中的作用。
1 材料与方法
1.1 实验动物与主要材料 出生3 d内的C57BL/6小鼠12只,购自北京维通利华实验动物有限公司。LC3抗体购自Sigma-Aldrich公司。GFAP抗体、GAPDH抗体、Caspase-3抗体购自Proteintech公司。自噬抑制剂3-MA购自美国Sigma公司。乳酸脱氢酶(LDH)检测试剂盒购自南京碧云天生物科技有限公司。CCK-8细胞活力检测试剂盒购自南京恩晶生物科技有限公司。TNF-α检测试剂盒购自南京金益柏生物科技有限公司。
1.2 小鼠星形胶质细胞分离 取出生3 d的C57BL/6小鼠,麻醉并处死小鼠,分离脑组织,加入DMEM洗涤3次,将血管和脑膜组织剔除,去大脑皮质,剪碎,在组织中加入0.25%胰蛋白酶,37 ℃孵育8 min,150目筛网过滤。加入DMEM洗涤,1 500 r/min离心5 min。添加含有青霉素-链霉素的DMEM培养液(含有10%胎牛血清),接种到多聚赖氨酸(PLL)包被的T25细胞培养瓶中。放入细胞培养箱中孵育3 d,换液,待细胞长满后,在37 ℃、220 r/min条件下振荡孵育18 h,将小胶质细胞和神经元去除,用0.25%胰蛋白酶将贴壁细胞消化,接种到24孔细胞培养板中。
1.3 OGD/R对小鼠星形胶质细胞活化、存活率、损伤、凋亡、自噬的影响观察
1.3.1 细胞分组及OGD/R处理 将星形胶质细胞接种到24孔板中,将细胞分为对照组和OGD/R组。对照组不做特殊处理。OGD/R组建立OGD/R模型:吸去正常培养基,用PBS清洗细胞2次,加入无糖DMEM培养基,将24孔板放入厌氧罐中,于37 ℃细胞培养箱中培养,分别于3、6、12 h后换成正常培养基,继续在37 ℃细胞培养箱中培养12 h。
1.3.2 活化标志物检测 采用Western blotting法检测星形胶质细胞活化标志物胶质纤维酸性蛋白(GFAP)。将两组细胞加入细胞裂解液在冰上提取总蛋白。4 ℃、12 000 r/min离心20 min。用BCA法进行蛋白定量。SDS-PAGE电泳分离蛋白,湿转法将蛋白转印至PVDF膜上。用TBST洗涤PVDF膜3次,每次15 min。5%脱脂牛奶室温封闭2 h。加入一抗(GFAP,1∶2 000),4 ℃过夜。用TBST洗3次,每次15 min。加入辣根过氧化物酶标记的羊抗兔或羊抗鼠IgG二抗(1∶2 000),室温孵育2 h。用TBST洗3次,每次15 min。用化学发光显色法显影。以目的蛋白灰度值与内参GAPDH灰度值的比值表示目的蛋白相对表达量。
1.3.3 细胞存活率测算 采用CCK-8法。将两组细胞接种到96孔板中,在每个孔内加入10 μL的CCK-8溶液,放入培养箱中继续培养4 h。酶标仪测定在450 nm处的吸光度值(A值)。细胞存活率=(OGD/R组A值/对照组A值)×100%。
1.3.4 LDH漏出率及TNF-α检测 向细胞培养板中加入LDH释放试剂,400 r/min离心5 min,取各组上清液120 μL,加入到新的96孔板中;各孔分别加入60 μL的LDH检测工作液,混匀,室温避光孵育30 min;测量490 nm处的A值;LDH漏出率=(实验组A值-对照组A值)/(细胞最大酶活性A值-对照组A值)×100%。采用ELISA法检测两组细胞培养液中的TNF-α。
1.3.5 凋亡蛋白检测 采用Western blotting法检测凋亡相关蛋白Caspase-3。方法参照“1.3.2”。
1.3.6 自噬相关蛋白检测 采用Western blotting法检测自噬相关蛋白LC3B-Ⅱ。方法参照“1.3.2”。
1.4 自噬对星形胶质细胞活化、存活率、损伤、凋亡的影响观察 取出生3 d的C57BL/6小鼠,参照“1.2”方法分离星形胶质细胞,分为对照组、3-MA对照组、OGD/R组、OGD/R+3-MA组。对照组不做特殊处理。OGD/R组、OGD/R+3-MA组建立OGD/R模型(缺氧缺糖培养后6 h更换正常培养基)。3-MA对照组及OGD/R+3-MA组造模前加入1 mmol/L的3-MA[10]。参照前述方法检测GFAP、细胞存活率、LDH漏出率、TNF-α水平、Caspase-3。
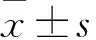
2 结果
2.1 OGD/R后星形胶质细胞活化、存活率、凋亡、自噬变化 OGD/R组不同处理时间细胞GFAP表达、LDH漏出率、TNF-α水平均高于对照组,细胞存活率低于对照组(P均<0.05);OGD/R组6 h、12 h时的Caspase-3/Pro-Caspase-3及LC3B-Ⅱ表达高于对照组(P均<0.05)。详见表1。
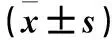
表1 两组细胞GFAP表达、细胞存活率、LDH漏出率、TNF-α水平、Caspase-3及LC3B-Ⅱ表达比较
注:与对照组比较,*P<0.01。
2.2 自噬抑制的星形胶质细胞活化、存活率、凋亡情况变化 OGD/R组细胞GFAP表达、LDH漏出率、TNF-α水平、Caspase-3/Pro-Caspase-3表达均高于对照组,细胞存活率低于对照组(P均<0.05)。OGD/R+3-MA组细胞GFAP表达、LDH漏出率、TNF-α水平、Caspase-3/Pro-Caspase-3表达均低于OGD/R组,细胞存活率高于OGD/R组(P均<0.05)。见表2。
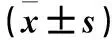
表2 各组细胞GFAP表达、细胞存活率、LDH漏出率、TNF-α水平、Caspase-3表达比较
注:与对照组比较,*P<0.01;与OGD/R+3-MA组比较,#P<0.01。
3 讨论
脑卒中可影响各种脑功能区,涉及复杂的损伤反应[11]。脑缺血通过多种机制诱导神经损伤,包括神经兴奋毒性、线粒体反应、自由基释放、蛋白质错误折叠和炎症改变[12]。星形胶质细胞的损伤和凋亡以及白质损伤也会导致脑损伤。星形胶质细胞是营养支持神经元,同时星形胶质细胞的终足与周围毛细血管壁连接,参与血脑屏障维持。故而星形胶质细胞在脑卒中的损伤与恢复中发挥重要作用[13~15]。我们采用体外培养的原代小鼠星形胶质细胞制作OGD/R模型模拟体内脑卒中损伤,观察了OGD/R后星形胶质细胞活化、凋亡、自噬的变化,结果显示,OGD/R组不同处理时间细胞GFAP表达、LDH漏出率、TNF-α水平均高于对照组,细胞存活率低于对照组;OGD/R组中6 h、12 h亚组Caspase-3/Pro-Caspase-3及LC3B-Ⅱ表达高于对照组。这表明星形胶质细胞OGD/R后活化且自噬水平升高,同时细胞分泌TNF-α水平增加,LDH漏出率增加,细胞凋亡增多。TNF-α可以激活凋亡受体,促进细胞凋亡。生理状态下LDH位于细胞内,在外界刺激下,LDH分泌到细胞外。TNF-α和LDH漏出率增加,表明星形胶质细胞活化促进缺血缺氧条件下星形胶质细胞的损伤。
大量研究表明,缺血刺激后脑组织中自噬被激活,但是自噬在脑缺血中的作用及影响尚未达成共识。目前普遍认为脑卒中后自噬激活具有双向作用,一方面具有神经保护作用,可以保护细胞免受缺血损伤;另一方面也会促进缺血后神经元和星形胶质细胞凋亡[16,17]。自噬过度活化会导致细胞“自噬性死亡”[18]。本研究发现,OGD/R后星形胶质细胞中的LC3B-Ⅱ蛋白表达增加,表明自噬被激活,同时凋亡相关蛋白Caspase-3表达水平也显著升高,表明OGD/R诱导星形胶质细胞自噬激活的同时也伴随着凋亡的发生。研究表明,自噬和凋亡虽然是不同的机制,但有一些常见的信号分子共同参与其中,如AMPK、p62等[19]。有学者在大鼠tMCAO模型中使用RNAi方法抑制自噬的同时也抑制凋亡的发生,改善了tMCAO大鼠的预后[20]。这表明“自噬性细胞死亡”可能通过凋亡途径介导细胞损伤作用,因此推测在缺糖缺氧条件下,星形胶质细胞内自噬激活可能通过促进凋亡加重星形胶质细胞的损伤。本研究进一步观察了自噬抑制的星形胶质细胞活化、存活率、凋亡情况,结果显示,OGD/R+3-MA组细胞GFAP表达、LDH漏出率、TNF-α水平、Caspase-3/Pro-Caspase-3表达均低于OGD/R组,细胞存活率高于OGD/R组。这提示抑制OGD/R星形胶质细胞自噬可以抑制凋亡的发生,减少TNF-α分泌,降低LDH漏出率,提高细胞存活率,抑制星形胶质细胞的活化,进一步说明抑制OGD/R后自噬的发生对星形胶质细胞具有保护作用。
综上所述,OGD/R后星形胶质细胞活化增强,凋亡蛋白表达增加,自噬激活。自噬可能促进了星形胶质细胞的活化和凋亡,诱导星形胶质细胞缺血性损伤。上述研究结果对于理解星形胶质细胞自噬和凋亡的相关性有一定参考价值。虽然自噬参与了缺糖缺氧条件下星形胶质细胞的活化过程,并通过调节凋亡的进程影响星形胶质细胞的存活,但是由于自噬和凋亡调控机制的复杂性,许多相关调控因子在自噬和凋亡通路中的作用仍有待于进一步研究阐明。

