改良电抽搐疗法治疗精神分裂症的生物学机制探讨
王萍,刘可智,向波,谭清宇,陈德超,梁雪梅
1西南医科大学附属医院,四川泸州646000;2宜宾市第四人民医院
精神分裂症是最常见的重型精神病之一,抗精神病药物是其基础治疗方法。复杂的遗传性缺陷是精神分裂症发病的最大已知风险因素。改良电抽搐疗法(MECT)是一种安全、有效、快速的精神疾病物理治疗方法[1],目前认为治疗急性精神分裂症有效,疾病缓解率达60%[2]。越来越多的研究表明,MECT联合抗精神病药物治疗精神疾病效果显著[3]。MECT的治疗机制与多种分子途径有关。有学者在大鼠实验中发现BRD1 mRNA表达变化可能与MECT的疗效有关[4]。另一项研究表明,转录因子(TCF)家族可能在MECT治疗中发挥作用[5]。还有研究发现脑源性神经营养因子(BDNF)可能是精神病易感性生物学途径中的下游基因[6]。然而,MECT治疗精神分裂症的机制仍不明确。第二代测序(NGS)法加速了疾病病理学的研究进程,产生了新的研究方向,如基因组学、转录组学、基因表达分析等[7]。本研究对采用MECT治疗的精神分裂症患者进行疗效评估,通过Illumina测序法及生物信息学方法,分析不同MECT治疗反应者表达差异基因,并进行GO富集分析、KEGG通路功能富集分析、疾病相关分析、药物相关分析、表型分析和全表型组关联分析,初步探讨MECT治疗精神分裂症的生物学机制。
1 资料与方法
1.1 临床资料 选择2018年11月~2019年1月宜宾市第四人民医院住院精神分裂症患者16例进入研究。入选标准:①符合精神疾病诊断和统计手册(DSM)5的诊断标准;②接受MECT治疗(≥6次,3次/周);③年龄15~55岁,右利手,汉族;④小学毕业及以上文化。排除标准:①患有严重躯体疾病,神经系统疾病,物质依赖者;②入组时被诊断为精神分裂症,在随访6个月后不能确定为精神分裂症或诊断为其他精神障碍患者。选择年龄、性别、学历等一般资料相匹配的健康志愿者8例为正常对照组。排除患有精神障碍和人格障碍者,患器质性精神障碍、神经系统疾病、物质依赖者,二系三代精神疾病家族史阳性者,曾服用过抗精神病药、抗抑郁药者。受试者均自愿加入本研究,并签署知情同意书。本研究由西南医科大学附属医院伦理委员会批准。
1.2 疗效评估及分组 采用DSM-Ⅳ的定式检查工具SCID-I/P(患者版)及SCID-NP(非患者版)分别对入组患者和正常对照组进行系统精神检查。采用阳性和阴性症状量表(PANSS)评估临床疗效,要求病例组基线分数≥60分,并计算MECT治疗后减分率。减分率=(治疗前评分-治疗后评分)/(治疗前评分-30)×100%。将病例组根据减分率分为治疗应答组8例(减分率≥60%)、治疗无应答组8例(减分率<60%)。治疗应答组男、女各4例,年龄(31.63±6.28)岁,学历为初中5例、高中及以上3例,基线PANSS(83.63±7.11)分;治疗无应答组男、女各4例,年龄(34.69±11.01)岁,学历为小学3例、初中2例、高中及以上3例,基线PANSS(89.13±9.00)分;正常对照组男、女各4例,年龄(31.25±11.22)岁,学历为小学2例、初中3例、高中及以上3例。三组一般资料具有可比性。治疗应答组和治疗无应答组用药方案及基线PANSS差异无统计学意义。
1.3 外周血RNA提取及测序 分别于MECT治疗前和治疗后1~3 d清晨(07:00~09:00)采集各组受试者全血2 mL,使抗凝剂与血液混匀,按250 μL/管分装于单独冻存管中,加750 μL的TRIzol混匀,液氮速冻(≥1 h)后转移至-80 ℃保存。正常对照组仅采血1次。7~10 d内提取总RNA。用Nanodrop2000检测RNA的浓度和纯度,琼脂糖凝胶电泳检测RNA完整性,Agilent2100测定RIN值。单次建库要求RNA总量1≥μg,浓度≥50 ng/μL,OD260/280为1.8~2.2。从总RNA中分离出mRNA,加入裂解液(fragmentation buffer)将mRNA随机断裂成300 bp左右的小片段,在逆转录酶的作用下逆转录合成cDNA。加入End Repair Mix将双链cDNA的黏性末端补成平末端,随后在3′末端加上腺嘌呤(A)碱基。用PCR扩增15个循环,2%低量程超琼脂糖回收目的条带,按数据比例混合上机,在cBot上进行桥式PCR扩增并进行Illumina Hiseq测序(PE文库,读长2×150 bp)。使用fastx_toolkit_0.0.14软件对每个样本的原始测序数据进行质控,将质控后的原始数据与参考基因组比对获得用于后续转录本组装、表达量计算等的映射数据(mapped Reads),同时运用TopHat2(http://ccb.jhu.edu/software/tophat/index.shtml)和HISAT2(http://ccb.jhu.edu/software/hisat2/index.shtml)软件对该次转录组测序的比对结果进行质量评估,包括测序饱和度、基因覆盖度、数据(Reads)在参考基因组不同区域分布及Reads在不同染色体分布分析。
1.4 差异表达基因筛选 基于所选参考基因组序列,使用StringTie软件对Mapped Reads进行拼接并与原有基因组注释信息进行比较,发掘新基因,补充和完善原有基因组注释信息。将基因与六大数据库(NR、Swiss-Prot、Pfam、EggNOG、GO和KEGG)进行比对,对基因的表达水平进行定量分析。获得基因的表达量后,使用DESeq2软件进行样本间基因的差异表达分析,用FDR(Benjamini/Hochberg法)进行多重检验矫正,筛选校正P<0.05者作为差异表达基因。分别获得病例组治疗前与正常对照组、治疗应答组治疗前后、治疗无应答组治疗前后的差异表达基因。
1.5 重叠基因功能富集分析 将“1.4”中筛选的病例组治疗前与正常对照组、治疗应答组治疗前后、治疗无应答组治疗前后的差异表达基因进行对比分析,获得重叠基因,并根据基因表达水平的变化分为表达上调组和表达下调组,用WebGestalt(http://www.webgestalt.org)软件[8]分别对表达上调组和表达下调组的重叠基因进行功能富集分析即GO分析、KEGG通路分析、疾病相关分析、药物相关分析表型分析(哺乳动物、人类表型)、全表型组关联分析(即PheWAS)。以adjP<0.05作为筛选标准,选择每项分析中校正P值最低的前5项作为富集结果。
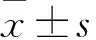
2 结果
2.1 差异表达基因分析结果 病例组治疗前与正常对照组差异表达基因4 964个,表达上调2 618个、下调2 346个。治疗无应答组治疗前后未发现差异表达基因。治疗应答组治疗前后差异表达基因343个,表达上调129个、下调214个。将病例组治疗前与正常对照组差异表达基因、治疗应答组治疗前后差异表达基因进行对比分析,发现176个重叠基因,其中表达上调55个(ABCA13、SPTY2D1、ZNF654、EDEM3、USP38、SEC24A、PIK3CG、SMC4、LMBRD2、DENND1B等),下调121个(VASH1-AS1、AC135050.1、SLC5A2、PPP1R14A、AC006213.1、AL021707.5、ETFB、HRAS、SIRT6、ZNF337-AS1等)。
2.2 差异表达基因GO富集分析结果 在重叠基因中,表达上调组显著富集于生物学功能,涉及磷脂酰肌醇二磷酸激酶活性、磷脂酰肌醇-4,5-二磷酸-3-激酶活性、胰岛素受体底物结合、磷脂酰肌醇-3-激酶活性、1-磷脂酰肌醇-3-激酶活性;表达下调组显著富集于细胞组分,包括核糖体亚单位、核糖体结构、核糖体、胞质核糖体和结构分子活性的生物学功能。见表1。
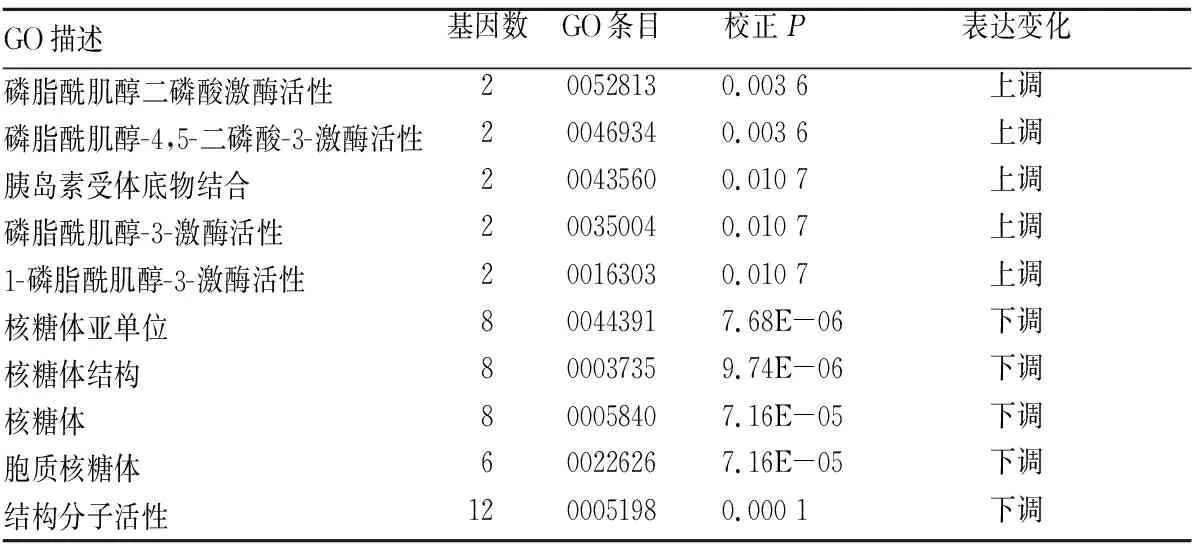
表1 差异表达基因的GO富集分析
2.3 差异表达基因KEGG通路分析结果 表达上调的差异表达基因主要与慢性粒细胞白血病、肾细胞癌、神经营养因子信号通路、丙型肝炎、白细胞内皮迁移通路有关,表达下调基因主要与核糖体、亨廷顿病、类风湿关节炎、紧密连接、哮喘生物通路有关。见表2。
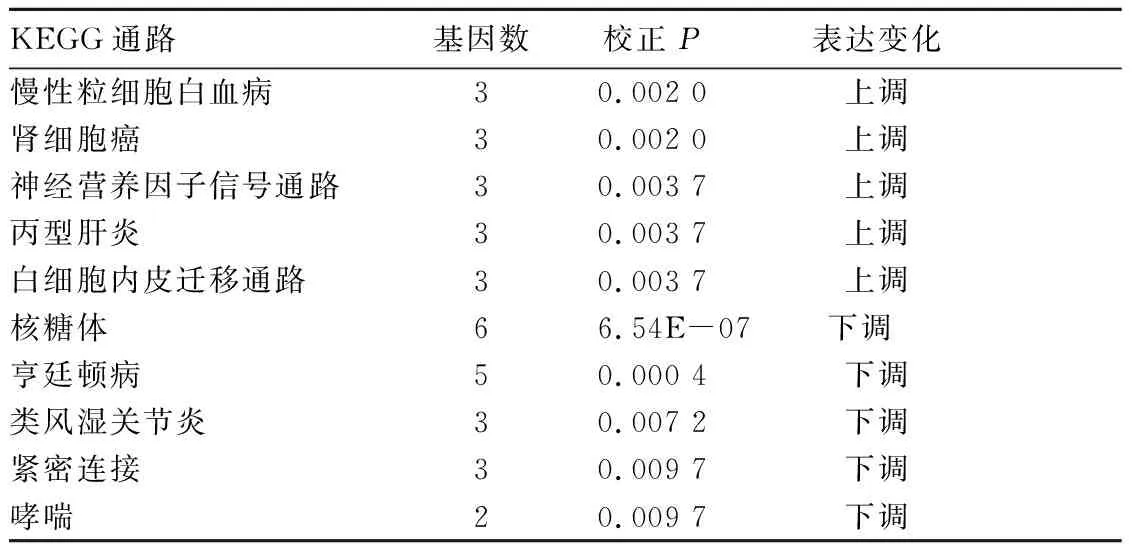
表2 差异表达基因KEGG通路分析
2.4 差异表达基因疾病相关分析 重叠的差异表达基因表达上调者与共济失调有关(校正P=0.045),表达下调基因与HIV有关(校正P=0.023)。
2.5 差异表达基因药物相关分析 未发现重叠的差异表达基因与药物有显著关联。
2.6 差异表达基因表型分析 重叠的差异表达基因表达上调者与肾发育不全、眼球突出、房间隔缺损、外周动脉异常、动脉狭窄显著相关。见表3。
2.7 全表型组关联分析 重叠的差异表达基因表达上调者与心房颤动和扑动、血压升高、细菌感染、女性生殖器相关症状、维生素B复合物缺乏有关。表达下调基因与肠道吸收不良有关。

表3 差异表达基因的表型分析
3 讨论
虽然已有研究发现了一些能预测MECT对精神分裂症疗效的生物学标志物,但其生物学机制至今尚不清楚。研究者通过动物模型或精神分裂症患者对各种神经递质、受体及激素进行了广泛的探索,发现了与MECT抗精神病效应有关的因素,并形成了众多的假说,如神经营养作用、中枢免疫系统调节、神经再生等。脑源性神经营养因子在成年期神经细胞的存活、分化、维持和连接中起着重要作用,也参与应激反应中下丘脑-垂体-肾上腺轴的功能。MECT后的精神分裂症患者血清BDNF水平升高,且临床症状得到改善。有学者通过探究MECT对血清中细胞因子水平的影响,来阐明免疫功能在MECT疗效中的重要作用。已有多项研究显示,精神分裂症患者MECT前后血液中某些蛋白水平发生改变且与临床症状相关,但从基因转录水平去探索MECT治疗精神分裂症机制的研究极少。本研究通过分析精神分裂症患者MECT前后外周血mRNA转录水平的差异,探索MECT治疗精神分裂症的生物学机制。
本研究发现,MECT联合抗精神病药物治疗精神分裂症疗效显著,这与先前的研究一致[9]。对病例组治疗前与正常对照组、治疗应答组治疗前后、治疗无应答组治疗前后的差异表达基因进行对比分析,发现176个重叠的差异表达基因,其中表达上调55个(ABCA13、SPTY2D1、ZNF654、EDEM3、USP38、SEC24A、PIK3CG、SMC4、LMBRD2、DENND1B等),下调121个(VASH1-AS1、AC135050.1、SLC5A2、PPP1R14A、AC006213.1、AL021707.5、ETFB、HRAS、SIRT6、ZNF337-AS1等)。重叠基因GO富集分析发现,表达上调基因显著富集于磷脂酰肌醇激酶活性,与相关研究一致[10]。有研究发现磷脂酰肌醇-4-磷酸-5-激酶Ⅱa(PIP5K2A)在异源基因表达系统中调节神经元kcnq2/kcnq3和kcnq3/kcnq5通道功能,从而导致精神分裂症相关突变体(N251S)-PIP5K2A被破坏,有助于精神分裂症症状缓解[11]。现有临床和临床前期数据表明,MECT治疗精神分裂症的疗效可能与部分激活磷脂酰肌苷3-激酶-蛋白激酶B途径(PI3K-PKB)通路有关。表达下调基因主要富集于核糖体,与核糖体蛋白S28、L28、P2、S9、S19、L36显著相关,而人类基因组核糖体基因复制数升高导致的rRNA失调可能是精神分裂症发展的遗传因素之一[12]。
KEGG通路分析显示,表达上调基因与神经营养因子信号通路相关,主要由SH-PTP2和PI3K介导。神经营养因子在神经元生长、可塑性和存活的信号通路中起重要作用。研究表明,MECT可导致海马组织体积增加,其机制可能与神经发生、胶质生成、突触形成、血管生成相关,而神经营养因子似乎在这些过程中起着重要的中介作用[13]。神经营养因子相关的细胞内信号通路在精神分裂症等神经精神疾病的病理生理学过程中至关重要[14]。神经营养因子信号通路中的PIK3CG、PIK3CA、PTPN11参与神经网络形成的关键阶段。SH-PTP2是一种参与多种信号转导途径的多功能酪氨酸磷酸酶,在神经系统中分布广泛,参与介导神经元存活的途径,也是多种神经反应的重要参与因子。调控PI3K/Akt信号通路有助于保护神经功能,促进血管生成[15]。我们推测MECT通过调节神经营养因子信号通路而产生疗效。未来研究可从神经营养因子的生物学、表观遗传调控及其在发育过程中的相互作用方面作进一步探索[16]。表达下调基因与亨廷顿病通路相关,与通路中亨廷顿基因(HTT)显著相关。亨廷顿病的发病机制与HTT序列中CAG三核苷酸扩增有关。小鼠实验表明,电休克治疗可通过刺激脑源性神经营养因子产生、保护神经元免受应激、减少突变型HTT对纹状体神经元的损害,从而延缓亨廷顿疾病的发展。未来的研究可探索精神分裂症与HTT的关联。同时,表达下调基因也与紧密连接通路相关。紧密连接通路与谷氨酸能、γ-氨基丁酸能突触的形成和神经传递有关,在紧密连接途径中TNNA1和MYH2基因的高甲基化也参与了神经管缺陷的发生[17]。
疾病相关分析发现,表达下调的差异表达基因与HIV显著相关。HIV患者患精神分裂症的风险更高,且能增加病死率[18]。精神分裂症与HIV具有正相关的遗传关系,因为两者拮抗性多效性的单核苷酸多态性鉴定的基因功能富集于突触传递和神经递质传递的调节[19]。重叠基因表型分析和全性状组关联分析显示,差异表达基因与心血管疾病及症状相关,如动脉狭窄、心房颤动和扑动等。心血管疾病是精神分裂症患者过早死亡的最常见原因,精神分裂症的阴性症状可增加心血管疾病风险[20]。MECT对精神分裂症患者心律的影响可能与麻醉药物的使用有关。
综上,本研究发现药物联合MECT治疗精神分裂症疗效显著。MECT治疗精神分裂症的机制可能与调节神经元通路、促进神经元生长、存活和可塑性、调节突触传递和神经递质有关。未来的研究可从大脑内部基因差异表达探索MECT治疗精神分裂症相关的生物机制。本研究也存在一定局限性,如在MECT治疗过程中药物使用可能会对结果产生影响、基于外周血基因表达差异并不能反映大脑组织中基因表达的变化、样本量较小等,未来我们还将进一步扩大样本量,深入研究MECT的治疗机制。

