14AA复方氨基酸口服液的配制*
张雪华,邓乾华,杨善彬,王晓楠,余双双,陈孝飞
(1 重庆师范大学化学学院,重庆 401331;2 重庆师范大学活性物质生物技术教育部工程研究中心,重庆 401331)
红枣又叫良枣、华枣,是鼠李科类植物枣属的果实,原产于中国。红枣中含有糖类、蛋白质等可促进肝脏合成蛋白,是肝脏的营养剂。枸杞中含有丰富的枸杞多糖、甜菜碱、氨基酸等活性成分有养肝明目、补气补血、增强非特异性免疫功能等作用,且来源广泛,具有极高的医疗和保健功能,在保健品的研发中具有广阔的应用前景。口服液是一种具有携带方便,治疗急性病的口服体制剂[1]。近代研究发现,肝昏迷是血浆中支链氨基酸与芳香氨基酸比例失调导致的,当两者的比值降低至1.0~1.5时就会发生昏迷[2]。所以可通过调节口服液中两种氨基酸配比的方式来治疗肝昏迷。本实验以市场上所售的14AA复方氨基酸口服液的配方为基础,提取红枣枸杞的有效中药成分对14AA口服液进行优化。常见的中药提取成分方法有超临界流体萃取法,组织破碎提取法、超声微波法等。超声微波法简单易操作、穿透能力强,能快速提取出药材中的有效成分,所以本实验采用超声微波法对红枣枸杞中的有效成分进行提取,并对配制的口服液中进行各指标质量检测。
1 实 验
1.1 仪器和原料
DF-101S超声清洗仪,巩义市予华仪器有限公司;pH计(批号20180910),上海馨晟试化工有限公司;UV-2550紫外可见分光光度计,岛津仪器有限公司;FA2004分析天平,上海恒平科学仪器有限公司;DHG-9076A电热恒温鼓风干燥箱,上海精宏实验设备有限公司。
红枣产地为新疆,枸杞产地为宁夏中宁,葡萄糖、苯酚、浓硫酸、无水乙醇均为AR,购于成都市科隆化学品有限公司。
1.2 绘制标准曲线
精确称取100 mg干燥至恒重的葡萄糖标准品于100 mL的容量瓶中,加蒸馏水定容,摇匀备用。用移液枪分别移取一定体积的葡萄糖溶液于带塞试管中,加入相应体积的超纯水,配制浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/mL的葡萄糖溶液,加蒸馏水至体积为2 mL。分别加入5 mL质量分数为0.5%的苯酚溶液,然后快速分别加入8 mL浓硫酸,摇匀,静置20 min 至室温,另外取一支带塞试管,加入2 mL蒸馏水后,同上操作,作为空白对照溶液。用紫外分光光度计在300~600 nm范围内进行波长扫描,在489 nm处检测到最大吸收波长,取489 nm处的吸光度,绘制标准曲线。
1.3 多糖的提取
称取3 g干燥至恒重的红枣枸杞(红枣枸杞各1.5 g),剪碎过筛后置于锥形瓶中,加入60 mL的蒸馏水,置于固定功率和温度的超声清洗仪中,经过一定时间的提取后,抽滤。向提取液中加入三倍体积80%的无水乙醇,摇匀,静置24 h后进行抽滤,将沉淀物放入真空干燥器中进行干燥得粗多糖。
(1)称取3 g干燥至恒重的红枣枸杞(红枣枸杞各1.5 g),剪碎过筛后置于锥形瓶中,加入60 mL的蒸馏水,温度设置为70 ℃,超声功率分别为120 W、140 W、160 W、180 W、200 W。经过一定时间的提取后,测得粗多糖的提取率。
(2)设置液料比分别为1:30、1:35、1:40、1:45、1:50,同上述方法,得出各个液料比下粗多糖的提取率。
(3)设置超声时间分别为25 min、35 min、45 min、55 min、65 min,同上述方法,得出各个液料比下粗多糖的提取率。
(4)设置提取温度分别为50 ℃、60 ℃、70 ℃、80 ℃、90 ℃,同上述方法,得出各个液料比下粗多糖的提取率。
采用Origin 8.1软件绘制各因素对多糖提取率的影响曲线。
1.4 口服液的配制
将冷藏3 h后的红枣枸杞提取液取出,加入0.025 g亚硫酸氢钠作为抗氧化剂、加入3.8%的柠檬酸钠作为酸味调节剂至pH=4.4,然后加入相应质量的14种氨基酸[4]。14种氨基酸的质量比例:L-亮氨酸0.688 g、L-异亮氨酸0.563 g、L-缬氨酸0.525 g、L-甘氨酸0.563 g、L-脯氨酸0.500 g、L-丙氨酸0.481 g、L-赖氨酸0.476 g、L-精氨酸0.375 g、L-丝氨酸0.313 g、L-苏氨酸0.281 g、L-组氨酸0.150 g、L-蛋氨酸0.063 g、L-苯丙氨酸0.063 g、L-色氨酸0.041 g,然后加蒸馏水定容至500 mL,摇匀后得到棕黄色的口服液[7]。
2 结果与讨论
2.1 绘制标准曲线
取489 nm处的吸光度,以葡萄糖浓度为横坐标,以吸光度(A)为纵坐标,绘制标准曲线。由图1可知,该标准曲线方程为y=0.50762x+0.00238,R2=0.9997。
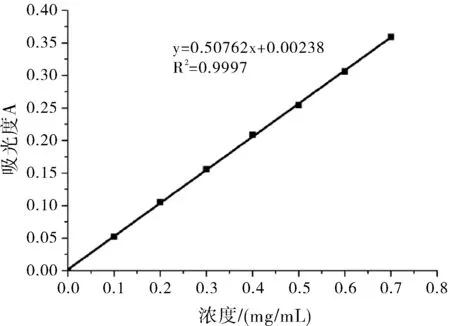
图1 标准曲线图Fig.1 The standard curves
2.2 单因素实验
2.2.1 超声功率对多糖提取的影响
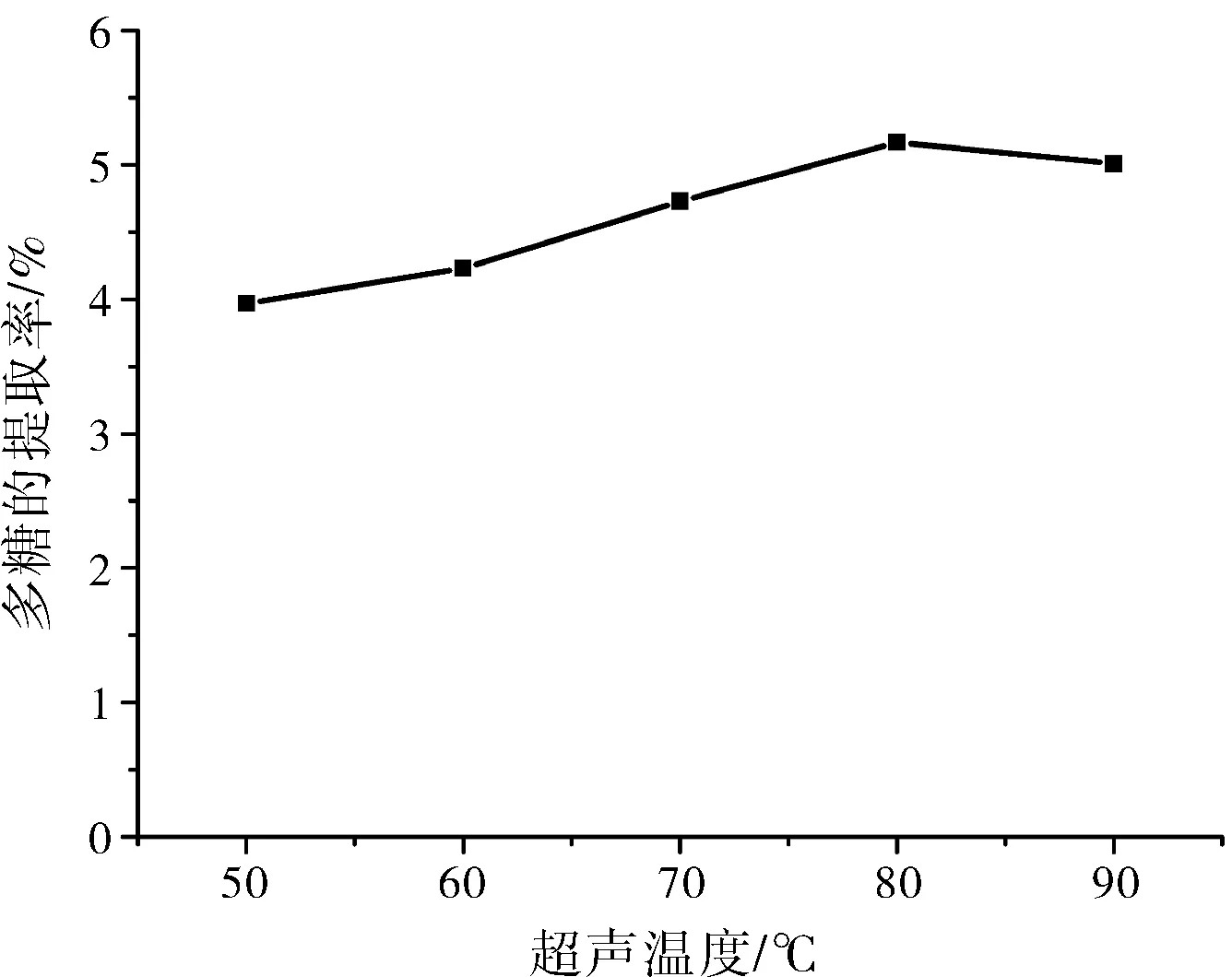
图2 超声温度的影响Fig.2 The effect of ultrasonic temperature
由图2可知,随着超声功率的增大,红枣提取率增大,因为随着功率的增大穿透力增强,更多的多糖渗透到水溶剂中,当功率超180 W时,多糖提取率降低,可能是由于穿透力太大,使部分多糖结构破坏。因此,最佳超声功率为180 W。
2.2.2 温度对多糖提取的影响

图3 超声时间的影响Fig.3 The effect of ultrasonic time
由图3可知,随着温度的升高,红枣提取率增大,当温度大于80 ℃时,多糖提取率增大的幅度降低,因为随着温度的升高,伴随着一些可溶性杂质析出,因此适宜的提取温度为80 ℃。
2.2.3 提取时间对多糖提取的影响

图4 超声功率的影响Fig.4 The effect of ultrasonic power
由图4可知,随着时间的增长,红枣提取率增大,多糖可以充分的渗透到溶剂中,但当时间超过45 min时,多糖提取率降低,可能随着时间的延长,细胞壁结构被破坏。因此最佳提取时间为45 min。
2.2.4 液料比对多糖提取的影响

图5 液料比的影响Fig. 5 The effect of extracting solid liquid ratio
由图5可知,随着液料比的增大,红枣提取率增大,但液料比超过1:40时,多糖的提取率反而降低,可能是太多的溶剂把提取出的多糖稀释了,因此最佳液料比为1:40。
2.3 正交实验
通过单因素实验,筛选出的影响多糖提取率的三个主要因素为:超声时间、液料比、超声温度,设计三因素三水平实验,实验因素如表1所示。

表1 正交实验因素水平表Table 1 Orthogonal factor level table
通过正交实验数据分析可得,最佳提取工艺为超声功率180 W,超声时间40 min,提取温度为80 ℃,液料比1:40。
2.4 各种氨基酸含量的测定
利用氨基酸分析仪在pH=5.0~5.5、温度为100 ℃、反应时间为13 min、每种的上样量为0.1 μmol的条件下进行氨基酸含量的测定[3],结果见表2。

表2 氨基酸含量分析结果Table 2 Analysis of amino acids content
2.5 pH值的测定
在19 ℃的温度下,用pH计对配制的口服液进行pH值的测定[4]。重复测量五次,测量结果显示:氨基酸口服液的pH值稳定在4.4~4.7之间,测量五次取平均值为4.6,与配制时的pH值有差距,可能与两次测量校准过程或测量室温等实验因素有关。
2.6 相对密度测定(比重法)
取一个25 mL洁净干燥的比重瓶,精密称量其质量为m0,装满该氨基酸口服液密封,置于19 ℃恒温水浴锅中20 min[6],取出比重瓶,用滤纸将瓶身擦干,精密称其质量为m1,口服液的质量m=m1-m0,同理将口服液换成蒸馏水,用上述方法测得同一温度下水的质量m水,相对密度=m/m水[7],重复五次实验得出,氨基酸口服液的相对密度保持一致,均在1.0858~1.0908 g/cm3之间。
3 结 论
市面上的14AA复方氨基酸口服液为棕黄色的澄清液体,规格为50 mL/瓶,每瓶含氨基酸总量为5.082 g。本实验配制的复方氨基酸口服液颜色为棕黄色,pH为4.4,呈弱酸性,符合氨基酸口服液质量标准中要求pH在3.8~4.5之间[5]。利用茚三酮试剂的鉴定实验中,氨基酸口服液呈现紫红色,说明口服液中氨基酸稳定。在氨基酸口服液相当于标示量90.0%~110.0%时,相对密度应在1.140~1.170之间,但实验结果为1.088,经分析可能是在配制过程中口服液被稀释,应再做加标测定实验才更准确可靠,经氨基酸分析仪检测,该口服液中含有14种氨基酸,与理论结果吻合。

