核蛋白14对黑素瘤新生血管形成的影响及机制研究
李璟蓉 赵瑞 王康玮 方锐华
1广州市第一人民医院皮肤科 510180;2广州市第一人民医院病理科 510180
核蛋白14(nucleolar protein 14,NOP14)是一种含有857 个氨基酸的核蛋白,是40S 核糖体成熟所必 需 的 蛋 白 质[1⁃2]。 在 卵 巢 癌 患 者 血 液 中 发 现NOP14 表达下调,低表达的NOP14 显著降低卵巢癌患者的总生存期[3]。体内和体外研究表明,过表达NOP14 能够抑制乳腺癌的发生和转移[4]。但NOP14 在胰腺导管癌细胞系及临床肿瘤组织样本中表达水平上调,抑制NOP14 可抑制胰腺导管癌细胞的迁移和侵袭,NOP14 通过突变型p53 调控miR⁃15对P21的表达,从而促进胰腺导管癌的生长和侵袭[5]。我们的前期研究结果表明,NOP14 在黑素瘤组织中低表达,与肿瘤的大小和淋巴转移情况显著相关,发挥抑制黑素瘤细胞生长和转移的作用[6⁃7]。鉴于血管形成和黑素瘤生长转移的密切关系[8],我们推测NOP14可能参与调控黑素瘤的血管新生。本研究中我们探讨NOP14 表达与黑素瘤血管形成的关系,进一步探索NOP14 抑制黑素瘤细胞生长和转移的机制,为黑素瘤的靶向治疗提供新的靶点和理论基础。
对象与方法
1.对象:纳入 2016 年 1 月至 2018 年 12 月在广州市第一人民医院经病理确诊的40 例黑素瘤患者的黑素瘤组织作为实验组。所有标本均为广州市第一人民医院病理科留存的石蜡标本。本研究取得广州市第一人民医院伦理委员会批准(批件号:K⁃2017⁃107⁃01和 K⁃2017⁃083⁃01)。
2.材料:人脐静脉内皮细胞(HUVEC)、黑素瘤细胞 A375 和 SK⁃MEL⁃1 产自上海中科院细胞库。NOP14 抗体产自美国 Proteintech 公司。CD31 抗体产自中国台湾Arigo Biolaboratories 公司。血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)一抗产自美国Abcam 公司。血管内皮生长因子(VEGF)和甘油醛-3-磷酸脱氢酶(GAPDH)一抗以及Western 印迹所需二抗产自美国 Cell Signaling Technology 公司。Transwell 小室产自美国Corning 公司。免疫组化二抗NovoLink 聚合物检测系统RE7280⁃K 检测试剂盒产自德国Leica公司。人VEGFB 和人VEGFR 1/Flt1 ELISA 检测试剂盒产自武汉华美生物工程有限公司。Lipofectamine 2000 产自美国Promega 公司。CCK8试剂盒产自日本Dojindo Molecular Technologies 公司。Trizol试剂来自美国Invitrogen公司。
3.免疫组化及结果判定:组织切片脱蜡后,按常规行抗原修复、CD31 或者NOP14 一抗孵育和显色反应。封片后,按照文献[9]方法判读CD31 和NOP14染色结果。NOP14染色强度计分标准:无色为 0 分,黄色为 1 分,棕黄色为 2 分,棕褐色为 3 分;阳性率计分标准:未染色为0 分,1% ~25%细胞阳性为 1 分,26% ~ 50% 为 2 分,51% ~ 75%为3 分,>75%为4 分。NOP14 染色强度计分和阳性率计分的乘积即为NOP14 表达的总评分,总评分 1 ~ 4 分为低表达,5 ~ 8 分为中表达,9 ~ 12 分为高表达。 CD31 的染色结果以微血管密度(microvessel density,MVD)表示:以任何一个独立的淡黄-棕褐色的内皮细胞或内皮细胞群作为1 个血管,在低倍镜下选取血管高密度区,在400 倍视野下,分别随机计数5 个不重叠视野的微血管数,取其平均值即为每例的MVD 值。以上判读均由3 位病理诊断医师分别以双盲方法综合评估完成后取平均值,忽略组间及组内观察者差异。
4.NOP14 过表达载体的构建及NOP14 siRNA合成:通过PCR 调取NOP14 的全长编码区,所需引物如下,正向引物5′⁃ tacaagtccggactcagatctGCCACC ATGGCGAAGGCGAAGAAGG⁃3′和反向引物 5′⁃gtaccgtcgactgcagaattcTTATTTTTTGAACTTTTTCCTC TTCAG⁃3′。回收 NOP14 PCR 扩增产物,连接到pEGFP⁃C1 载体中,通过测序确定连接成功。靶向NOP14 的siRNA(siNOP14)序列为5′⁃GGAAAGAG CUGAUUGAAGA ⁃3′ ,阴 性 对 照 siRNA 的 序 列(siNC)为5′⁃AGGUGGAAAUAUGGAAGAC⁃3′。引物和siRNA由上海吉玛制药技术有限公司合成。
5.实验分组:按照上海中国科学院细胞库提供的方法培养A375和SK⁃MEL⁃1细胞,当细胞融合度50% ~ 60% 时 ,将 0.5 μg NOP14 过 表 达 载 体(NOP14 组)、0.5 μg pEGFP⁃C1 空载体(空载体组)、50 nmol/L siNOP14(siNOP14 组)以及 50 nmol/L siNC(siNC 组)分别转染到A375和SK⁃MEL⁃1中,转染方法参考Lipofectamine 2000 说明书。转染24 h后收集以上各组 A375 和 SK⁃MEL⁃1 细胞,分别与HUVEC共培养作为共培养组。
6.荧光定量 PCR 检测 NOP14 mRNA 的表达:收集各组A375 和SK⁃MEL⁃1 细胞(约106个),Trizol试剂提取总RNA。按照前期报道的方法[6]检测细胞中NOP14 和内参照18S mRNA 的表达水平。采用2-△△Ct法计算NOP14 mRNA的相对表达水平。
7.细胞计数试剂盒 8(CCK8)检测 HUVEC 增殖:将1×105HUVEC接种于Transwell小室下室,培养箱内过夜;次日,上室加入各组A375和SK⁃MEL⁃1细胞200 μl(2 × 105个/ml),培养24 h 后,收集下室细胞及培养基,接种在96孔培养板中,分别于1、2、3 和 4 d 后,按照 CCK8 试剂盒说明,检测 450 nm 波长处吸光度(A值)。以只加CCK8 试剂的孔作为空白孔,每组细胞的A450 值减去空白孔的A450 值作为实验组最终A450值,表示细胞增殖活性。
8.Transwell 实验检测HUVEC 迁移和侵袭能力:迁移实验中,于Transwell 小室的下室分别加入各组 A375 和 SK⁃MEL⁃1 细胞悬液 600 μl(2 ×105个/ml),待贴壁后换成600 μl 无血清培养基,上室加入HUVEC 200 μl(2×104个/ml),培养24 h后,0.1%结晶紫染色。于200倍相差显微镜下拍照,计数5 个视野下的穿膜细胞数,取平均值作为迁移细胞数。侵袭实验中Transwell 上室用Matrigel 胶包被,其余步骤同上,计数5 个视野下的穿膜细胞数,取平均值作为侵袭细胞数。
9.Matrigel 血管拟态实验检测细胞的管腔形成能力:实验前 1 天使用 Matrigel 胶包被 Transwell 下室,取500 μl(2×104个/ml)HUVEC 接种在Matrigel胶上;上室加入各组A375 和SK⁃MEL⁃1 细胞 200 μl(2 × 105个/ml),37 ℃、5% CO2培养箱培养 6 h,于200 倍相差显微镜下拍照,计数5 个视野下分支节点数,取平均值作为各组细胞的分支节点。
10.Western 印迹检测 NOP14、VEGF 和 VEGFR在各组细胞中的表达:收集各组A375 和SK⁃MEL⁃1细胞(约106个),RIPA 裂解液提取总蛋白。按照文献[7]中方法检测NOP14、VEGF 和VEGFR 在各组细胞中的表达,并利用美国Media Cybernettics 公司的 Image Pro⁃Plus 6.0 软件分析 Western 印迹的条带灰度值,目的蛋白的相对表达量= 目标蛋白灰度值/内参蛋白灰度值。
11.ELISA 检测培养基上清液中VEGF 和VEGFR 的含量:收集各组细胞的培养基上清液,按照人VEGFB 和VEGFR 1/Flt1 ELISA 试剂盒说明书检测VEGF和VEGFR的含量。
12.统计处理:应用SPSS 19.0 软件,计量资料以表示,采用线性回归模型分析黑素瘤组织中NOP14 表达水平与MVD 的关系,多因素方差分析检验细胞增殖活性的差异,独立样本t检验分析两组间实验指标的差异。以P<0.05 为差异有统计学意义。
结果
1.黑素瘤组织中NOP14 表达和CD31 表达的相关性:免疫组化检测NOP14 和CD31 表达的代表图见图1。NOP14 高表达组(20 例)CD31 相对表达水平(MVD)为44±13,中表达组(17例)为58±16,低表达组(3 例)为62 ± 11。相关性分析显示,NOP14 表达和 MVD 呈负相关(r= -0.525,P=0.017),见图2。
2.NOP14 过表达和RNA 干扰验证:见图3。与siNC 组相比,siNOP14 组 A375 和 SK⁃MEL⁃1 细胞中NOP14 mRNA(t值分别为25.00、40.92,均P< 0.01)及蛋白表达水平(t值分别为3.76、4.16,均P< 0.01)均显著降低,说明NOP14 被成功沉默。与空载体组相比,NOP14组A375和SK⁃MEL⁃1细胞中NOP14的mRNA(t值分别为4.06、5.35,P< 0.05、0.01)和蛋白表达水平(t值分别为4.30、4.35,均P< 0.01)显著升高,且可以检测到相对分子质量为126 000 的NOP14 和 EGFP 的融合蛋白,说明 NOP14 已成功过表达。
3.NOP14 对黑素瘤细胞 VEGF 和 VEGFR 表达的影响:Western 印迹检测(图4)显示,与空载体组相比,NOP14 组 A375 和 SK⁃MEL⁃1 细胞中 VEGF(t值分别为 5.60、2.91,P值分别 < 0.01、0.05)和VEGFR 的表达水平显著降低(t值分别为3.18、3.38,均P< 0.05);与siNC 组相比,siNOP14组A375和SK⁃MEL⁃1 细胞中 VEGF(t值分别为 15.81、3.88,P值分别 < 0.01 和 0.05)和 VEGFR(t值分别为3.97、3.46,均P< 0.01)表达水平显著增加。ELISA结果(图5)显示,与空载组相比,NOP14 组A375 和SK⁃MEL⁃1 细胞培养基中 VEGF(t值分别为 224、113.7,均P< 0.01)和 VEGFR(t值分别为 59.12、22.16,均P< 0.01)含量显著降低;与siNC 组相比,siNOP14 A375 和 SK⁃MEL⁃1 细胞培养基中 VEGF(t值分别为30.91、121.20,均P< 0.01)和VEGFR 的含量显著增加(t值分别为14.45、14.23,均P< 0.01)。
4.NOP14 对 HUVEC 增殖能力的影响:见图 6。与 A375 或 SK⁃MEL⁃1 空载体共培养组相比,A375或SK⁃MEL⁃1 NOP14共培养组HUVEC 的A450值在培养后第1、2、3 和4 天均显著降低,不同时间的增殖活性差异有统计学意义(F值分别为168.61、172.37,均P< 0.01),不同分组间增殖活性差异亦有统计学意义(F值分别为131.85、189.10,均P<0.01),分组和时间存在交互作用(F=28.08、35.44,均P< 0.01)。与 A375 或 SK⁃MEL⁃1 siNC 共培养组相比,A375 或者 SK⁃MEL⁃1 siNOP14 共培养组HUVEC 的A450 值在培养后第 1、2、3 和 4 天均显著升高,不同时间共培养组HUVEC 细胞的增殖活性差异有统计学意义(F值分别为477.76、394.20,均P< 0.01),不同分组间差异亦有统计学意义(F值分别为79.92、157.02,均P< 0.01),分组和时间存在交互作用(F值分别为9.95、17.89,均P< 0.01)。

图1 免疫组化检测黑素瘤组织中核蛋白14(NOP14)和CD31的表达(×200)

图2 40 例黑素瘤组织中核蛋白14(NOP14)与CD31 表达量(微血管密度)的相关性分析

图3 实时PCR和Western印迹分别检测转染核蛋白14过表达载体(NOP14 组)或者siNOP14(siNOP14 组)后 A375 和SK⁃MEL⁃1 细胞中NOP14 mRNA(3A)和蛋白(3B、3C、3D)表达水平 NOP14组和siNOP14 组细胞NOP14 分别被成功过表达和沉默。siNC:阴性对照siRNA;siNOP14:靶向NOP14 的siRNA;GAPDH:甘油醛-3-磷酸脱氢酶。n=3,a:P < 0.05
5.NOP14 对HUVEC 迁移和侵袭能力的影响:见图7。与A375 空载体共培养组HUVEC 相比,A375 NOP14 共培养组HUVEC 的迁移和侵袭细胞数显著降低(迁移:22 ± 5 比 63 ± 8,t= 7.07,P=0.002;侵袭:14 ± 5 比45 ± 10,t=4.94,P=0.008)。与 A375 siNC 共培养组 HUVEC 相比,A375 siNOP14 共培养组HUVEC 的迁移和侵袭细胞数显著增加(迁移:152 ± 30 比 59 ± 4,t= 5.36,P=0.006;侵袭:134 ± 21比50 ± 8,t=6.40,P=0.003)。与不同组SK⁃MEL⁃1细胞共培养后,HUVEC 迁移和侵袭能力的变化趋势和与A375细胞共培养一致。
6.NOP14 对HUVEC 管腔形成能力的影响:见图 8。与 A375 或 SK⁃MEL⁃1 空载体共培养 组HUVEC 相比,A375 或 SK⁃MEL⁃1 NOP14 共培养组HUVEC 形成的分支节点数显著降低(A375:8 ± 2比14 ± 3,t= 5.06,P< 0.001;SK⁃MEL⁃1:11 ± 1 比19 ± 3,t= 6.93,P< 0.001)。与 A375 或 SK⁃MEL⁃1 siNC 共培养组 HUVEC 相比,A375 或 SK⁃MEL⁃1 siNOP14 共培养组HUVEC 形成的分支节点数显著增加(A375:27 ± 3 比15 ± 4,t= 6.10,P< 0.001;SK⁃MEL⁃1:28 ± 4比16 ± 2,t=7.25,P< 0.001)。
讨论
2012 年的一项调查显示,在较发达地区黑素瘤的发病率和死亡率分别为9.3/10 万和1.2/10 万,欠发达地区分别为 0.7/10 万和 0.3/10 万[10]。据估计,2015 年在美国有73 870 例新病例被诊断,并有9 940 人将死于黑素瘤[11⁃12]。我国等亚洲国家的黑素瘤发病率与欧美国家相比较低,但发病率增长较快。2003—2007 年中国44 个肿瘤登记地区黑素瘤发病率合计为0.49/10万,死亡率合计为0.24/10万[13]。与1988 年相比,2007 年北京市和上海市黑素瘤发病率和死亡率明显上升[13]。转移是导致黑素瘤患者死亡的重要原因,一旦发生转移其5 年生存率大约只有16%[14],中期生存时间大约只有11 个月[15]。因此,如何抑制黑素瘤的转移是目前亟待突破的关键问题。
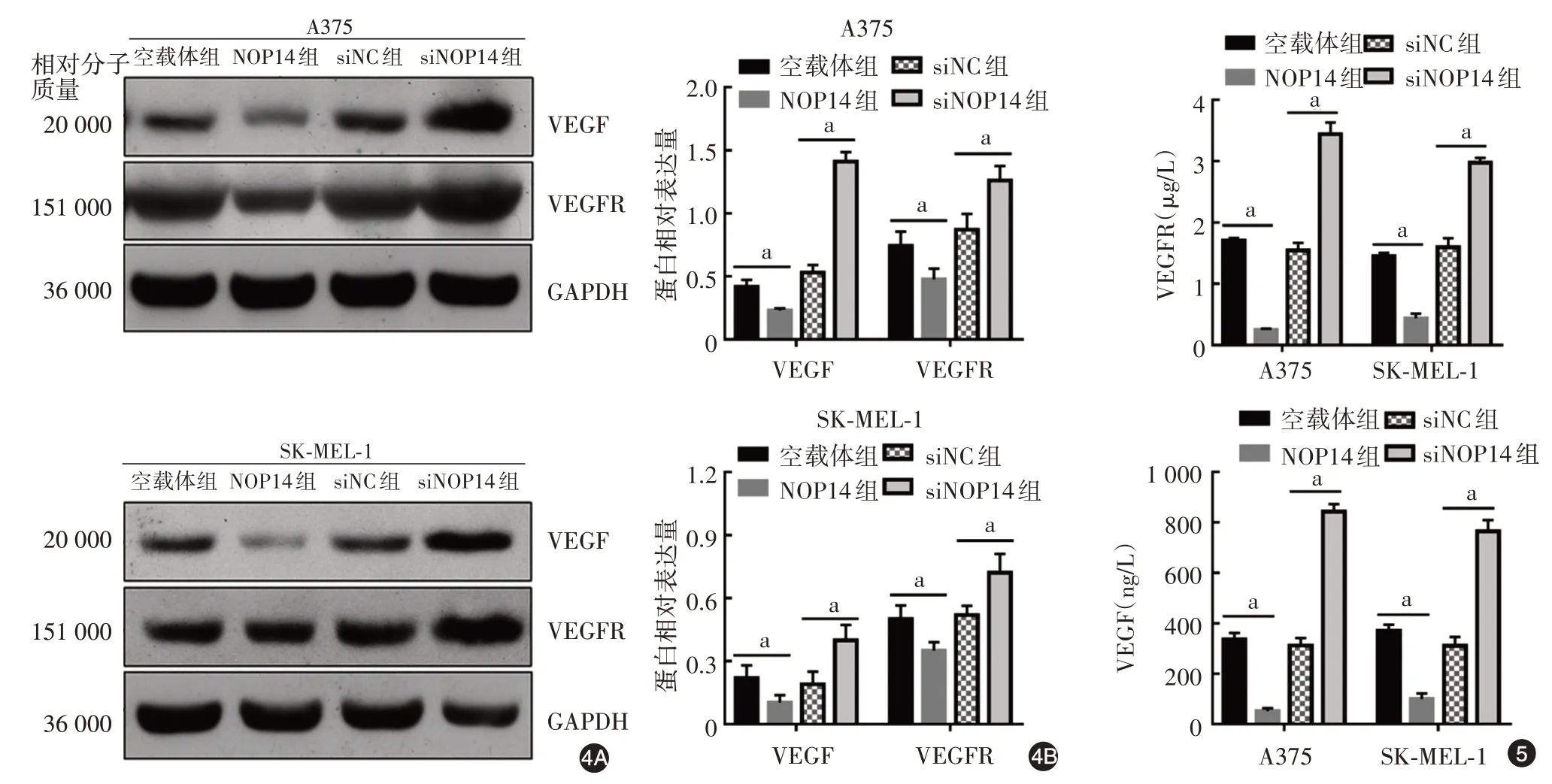
图4 Western 印迹检测转染核蛋白14(NOP14)过表达载体(NOP14 组)或者NOP14 siRNA(siNOP14 组)对A375 和SK⁃MEL⁃1 细胞中血管内皮生长因子(VEGF)和VEGF受体(VEGFR)表达水平的影响 4A:代表性电泳图谱;4B:蛋白相对表达量统计结果。siNC:阴性对照siRNA;siNOP14:靶向NOP14 的siRNA。n = 3,a:P < 0.05图5 ELISA 检测转染核蛋白14(NOP14)过表达载体(NOP14 组)或者NOP14 siRNA(siNOP14 组)后A375 和SK⁃MEL⁃1 细胞培养基中血管内皮生长因子(VEGF)和VEGF 受体(VEGFR)表达水平 siNC:阴性对照siRNA;siNOP14:靶向NOP14 的siRNA。n=3,a:P < 0.05

图6 CCK8 实验分析核蛋白14(NOP14)对人脐静脉内皮细胞(HUVEC)增殖能力的影响 与空载体共培养组相比,NOP14 共培养组HUVEC 增殖能力降低;与siNC 共培养组相比,siNOP14 共培养组HUVEC 增殖能力增强。siNC:阴性对照siRNA;siNOP14:靶向NOP14 的siRNA。n=3,a:P < 0.05
血管形成是黑素瘤转移的关键环节[8]。研究显示,癌组织中微血管增加可促进癌细胞的合成代谢,为肿瘤细胞的快速增长及物质代谢提供物质基础[16]。MVD 越高,进入血循环的肿瘤细胞数及其诱发微血管形成的能力越强。因此研究肿瘤血管形成对了解恶性肿瘤发生、发展、侵袭和转移的生物学行为和机制以及抗肿瘤血管形成有重要的理论意义和临床应用价值。本研究结果表明,黑素瘤中NOP14 的表达水平和MVD(CD31 的表达)呈负相关,提示NOP14 可能在调控血管新生中发挥重要作用。随后的细胞实验表明,过表达NOP14 的黑素瘤细胞表达VEGF 和VEGFR 的能力明显减弱,且干扰NOP14 表达的黑素瘤细胞表达VEGF 和VEGFR 的能力明显增强。VEGF 可通过结合临近血管内皮细胞表达的VEGFR 来启动肿瘤血管新生,在肿瘤的血管新生过程中扮演重要角色[17]。这些结果表明,NOP14 可能通过调控肿瘤细胞VEGF分泌影响临近血管内皮细胞的血管再生能力。通过建立黑素瘤细胞和血管内皮细胞HUVEC 的Transwell共培养模型,我们发现过表达NOP14的黑素瘤细胞可明显抑制HUVEC的增殖、迁移、侵袭和管腔形成能力,反之干扰NOP14 表达的黑素瘤细胞则可明显促进HUVEC的增殖、迁移、侵袭和管腔形成能力。既往研究表明,血管内皮细胞增殖、迁移、侵袭和管腔形成能力的增强是血管新生的必备条件[18]。因此,我们推测,NOP14 在调控血管新生中发挥重要作用,NOP14可以作为抑制黑素瘤血管新生的潜在重要靶点。

图7 Transwell 实验检测核蛋白14(NOP14)对人脐静脉内皮细胞(HUVEC)迁移和侵袭能力的影响 与空载体共培养组相比,NOP14 共培养组HUVEC 迁移和侵袭能力降低;与siNC 共培养组相比,siNOP14 共培养组HUVEC 迁移和侵袭能力增强。siNC:阴性对照siRNA;siNOP14:靶向NOP14 的siRNA

图8 Matrigel 血管拟态实验检测核蛋白14(NOP14)对人脐静脉内皮细胞(HUVEC)管腔形成能力的影响 与空载体共培养组相比,NOP14 共培养组HUVEC 管腔形成能力降低;与siNC 共培养组相比,siNOP14 共培养组HUVEC 管腔形成能力增强。siNC:阴性对照siRNA;siNOP14:靶向NOP14 的siRNA
我们首次提出NOP14 参与调控肿瘤血管新生,NOP14可以抑制黑素瘤血管新生。NOP14在其他肿瘤中的作用可以从另一个方面支持我们的结论[4]。以往研究表明,过表达NOP14可以明显抑制黑 素 瘤 细 胞 的 迁 移 和 侵 袭 能 力[6⁃7],且 过 表 达NOP14 能够抑制乳腺癌肿瘤的发生和转移[4],同样发挥抑制肿瘤恶化的作用。这些结果表明,NOP14在调控肿瘤的发生发展中可能发挥重要的作用,但其具体作用需要进一步探讨。
虽然蛋白融合技术是蛋白研究中常用的实验技术,但融合的EGFP 可能会影响目标蛋白质的折叠,进而影响其功能的发挥。我们的实验结果证明融合EGFP 后NOP14 可以明显影响黑素瘤细胞的功能,且与干扰NOP14 表达的功能相反,说明融合EGFP 对NOP14 的功能没有本质上的改变。但是,仍可能存在其他影响,这是本文的缺陷之一。另外,瞬时转染的稳定性不如慢病毒感染,可能会影响本文结论的可靠性,我们将在后续实验中采用慢病毒感染构建稳定低表达或者过表达NOP14 的细胞株的方式进一步验证本文的结论。
总之,本研究表明,NOP14 在调控黑素瘤的血管新生中发挥重要作用,该结果进一步明确了NOP14在调控黑素瘤发生发展中的作用,并将为抗肿瘤血管新生药物的研发提供新的理论基础。将来我们将验证NOP14 和其他血管新生标志物(如CD34和CD105)表达的相关性,分析NOP14和血管新生标志物的相关性在不同类型的黑素瘤组织中是否存在差异,进一步明确NOP14 和黑素瘤血管新生的关系。
利益冲突所有作者均声明不存在利益冲突

