左心室舒张功能不全联合左房容积指数预测急性ST段抬高型心肌梗死患者血运重建后持续性房颤的发生风险
任 锋,寇 进,马兰香,杨 鲲
持续性房颤(atrial fibrillation,AF)是急性心肌梗死最常见的并发症之一[1]。既往研究报道,通过心脏磁共振评估,虽然合并AF的急性心肌梗死患者的梗死面积与未合并AF者无显著差异,但合并AF者发生心脏收缩功能不全和1年内主要不良心脏事件的风险显著升高[2,3]。在STEMI的急性期,接受PCI治疗的患者中,出现新发的AF也是短期死亡率和长期死亡率的独立预测因素[4,5]。由此可见AF对于STEMI患者心血管总体预后的不良影响。目前对于STEMI急性期的新发AF研究较多,但对于心肌梗死后患者远期发生持续性AF风险的相关因素研究较少。本研究通过收集连续性收集和随访接受PCI治疗的STEMI患者,以2年内发生7 d内无法自行恢复窦性心律的持续性AF为终点事件,通过单因素和多因素回归分析,来研究PCI治疗后陈旧性心肌梗死患者的AF发生风险,为临床医师预测心肌梗死患者PCI后远期发生新发AF的风险,从而改善陈旧性心肌梗死患者的随访管理策略提供依据。
1 对象与方法
1.1 对象 收集2013-01至2017-12因急性STAMI入我院并接受急诊PCI的患者。STEMI的诊断由患者典型的胸痛病史、具有诊断意义的心电图改变和心肌损伤生物标志物升高确定。对于症状持续时间≤12 h或症状持续时间在12~24 h但缺血症状在入院时持续存在的患者进行初次PCI。除非有禁忌证,否则在就诊时开始使用阿司匹林和P2Y12抑制剂的双重抗血小板治疗12个月疗程,并提供抗凝治疗。患者入院期间入住冠心病监护病房,予以连续性心电检测。初次PCI后,在48 h后利用多普勒超声心动图评估所有患者的左心室射血分数、左心室舒张功能和左心房内径。
1.2 纳入标准和排除标准 纳入标准:既往无AF病史;住院期间无持续性AF或反复发作的阵发性AF;接受初次PCI血运重建的STEMI患者。排除标准:心律无法自行电转复;住院期间连续3次发生阵发性AF;心房扑动或其他房性心律失常;急性心肌梗死合并预激综合征或并发房室传导阻滞;心肌梗死再发;急性心肌梗死合并左心室收缩功能严重下降(LVEF<35%)和心源性休克;存在其他心脏结构异常和器质性疾病。我们对年龄>60岁、LVEF<40%、合并左前降支病变、LAVI>31ml/m2及合并左心室舒张功能不全等因素是否是可影响2年内持续性AF发生风险的预测因子进行了分析,通过计算卡方检验和计算危险度(risk ratio,RR)比发现以上变量均为2年内AF事件发生的危险因素。在logistics多因素回归模型分析中,我们还纳入了随访期是否出现ACS事件这一变量。
1.3 左心室容积指数的测量和左心室舒张功能不全的定义 利用双平面面积长度法,在收缩末期使用心尖四腔和二腔视图中来估计左心房(left atrial,LA)容积。 两名高年资心脏超声专业医师对患者的超声心动图进行独立评价,取平均值。 LAVI计算为LA体积除以体表面积。组织多普勒评估二尖瓣瓣环舒张早期速度(e′)和舒张早期快速充盈期血流峰速度(E)。以下标准用于定义左心室舒张功能不全:e′<7或E/e′>15。
1.4 随访和主要终点事件的定义 本研究主要终点事件定义为患者出院后出现连续7 d无法自行转复的持续性AF。所有患者随访期为2年,每2周进行1次常规心电图检查,每2个月进行1次24 h动态心电图检查。记录出现首次AF后,分别于1、3、7 d再次行常规心电图检查,由心电图室医师对患者的心电图结果作出诊断,7 d后房颤心律无法转复者即诊断为持续性AF。所有拟诊为持续性AF的患者均需根据CHA2DS2-VASc评分进行卒中风险评估,根据评估结果启动口服抗凝药治疗或考虑进行药物复律和射频消融。
2 结 果
2.1 一般资料和随访结果 276例中,92例在随访期内被诊断为持续性AF达到主要终点事件,82例接受华法林和新型口服抗凝药治疗,12例接受了AF射频消融术,20例失访。最终256例纳入分析,其中男178例,女78例。随访期内最终达到主要终点事件的患者和未达到主要终点事件的患者的人口学信息和临床基线资料如表1所示。在2年内出现达到主要终点事件的患者平均65.31岁,未达到终点的患者平均56.78岁,两者差异具有统计学意义(P=0.032)。在达到主要终点事件的患者中,相对于未达到终点的患者,随访期出现ACS的患者比例更高,差异具有统计学意义(P=0.035)。达到主要终点事件的患者基线左心室射血分数水平相对于未达到的患者具有降低的趋势,但差异无统计学意义。同时合并左前降支病变的患者比例在达到主要终点事件的患者中差异无统计学意义但有增加趋势。患者人口学信息和临床基线的比较,提示年龄、随访期是否再次出现ACS事件和左心室射血分数可能影响STEMI患者2年内出现新发AF的风险。

2.2 确定2年内主要终点事件的独立危险因子 logistics多因素回归模型分析显示,随访期出现ACS事件,合并左前降支病变、LAVI>31 ml/m2及合并左心室舒张功能不全为2年内发生持续性AF事件的独立危险因素。年龄>60岁和LVEF<40% 虽然与2年内出现持续性AF风险增加相关,但在logistics多因素回归分析中不是主要终点事件的独立危险因素(表2、表3)。
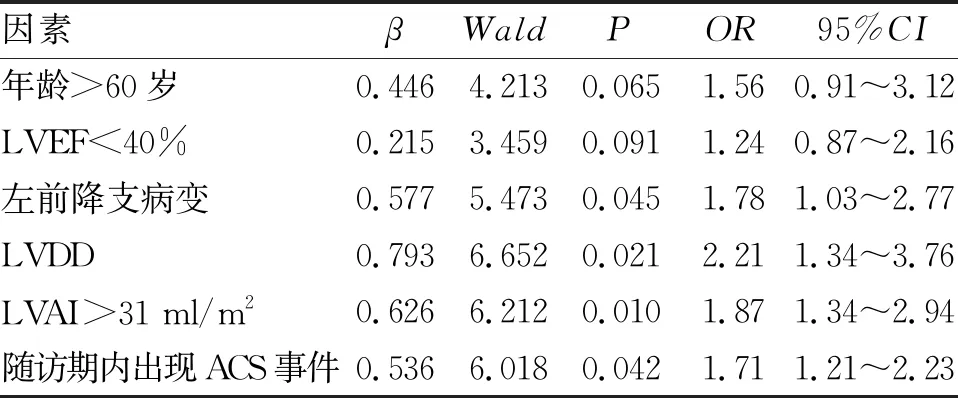
表3 logistics 多因素回归模型分析2年内发生持续性房颤主要终点事件的独立危险因素
2.3 ROC曲线评估LAVI和LVDD 对于2年内发生持续性AF诊断的预测价值采用ROC曲线法通过LAVI指数对于2年内发生持续性AF的诊断价值进行评估,发现LAVI对于预测2年内发生持续性AF的曲线下面积(area under curve,AUC)为0.71,最佳截断值31 ml/m2。LAVI对主要终点事件预测敏感度0.89,特异度0.60,约登指数0.49。 LVDD对主要终点事件的预测敏感度0.76,特异度0.74,约登指数0.50,AUC为0.76。同时合并LVDD和LAVI指数增大预测2年内主要终点事件发生风险敏感度为0.85,特异度为0.89,约登指数0.74,AUC为0.87。说明LAVI指数联合多普勒超声心动图定义的左心室舒张功能障碍能够对于STEMI患者PCI术后远期房颤发生风险具有更好的预测价值。
3 讨 论
本研究讨论了STEMI患者PCI术后发生影响心脏电重构,导致患者出现持续性AF的危险因素。研究发现,随访期出现ACS事件,年龄>60岁、左前降支病变、LAVI>31 ml/m2,及左心室舒张功能不全为2年内发生持续性AF事件的独立危险因素。其中LAVI>31 ml/m2,和左心室舒张功能不全的OR值分别为1.87和2.12,是在logistics多因素风险回归模型中OR值最大的两项独立危险因素。STEMI患者PCI术后的基线LAVI值>31 ml/m2增加0.87倍2年内发生持续性AF的风险,合并左心室舒张功能不全增加1.12倍2年内发生持续性AF的风险。该研究利用LAVI和是否合并左心室舒张功能不全作为预测因子,通过ROC曲线法评价LAVI和左心室舒张功能不全对于2年出现持续性AF的诊断预测价值。最终发现,LAVI联合左心室舒张功能不全对于STEMI患者初次PCI 2年内出现持续性AF具有比单一变量更好的预测能力。
研究表明,由于左心房扩张的不对称性,左心房容积指数相对于左心房内径是预测射频消融术后AF复发更好的预测因子[6]。但是左心房出现结构重构之前左心房的电学基质往往已经发生改变。左房电学基质的改变可能与年龄、代谢改变、炎性因子、压力容积负荷增加等有关[6-8]。由于从力学机制上左心室舒张功能不全可能导致慢性持续性的左房压力负荷增加,因此研究发现 LA压力的升高与左心室舒张功能障碍的严重程度呈显著正相关[9]。长期的升高的左室充盈压力会对左心房基质造成损害,存在左心室舒张功能不全的AF患者,房颤导管射频消融手术术后具有更高的复发率,说明左心室舒张功能障碍的存在和严重程度会增加发生AF的风险[10,11]。此外,LA直径或体积随着舒张功能障碍严重程度的增加而增加,舒张功能障碍会导致慢性舒张性心房压力超负荷,进而导致LA发现电重塑和结构性重塑,从而导致AF形成[12,13]。年龄与左心室舒张功能障碍具有相关性[14,15]。因此本研究中,笔者发现年龄并非主要终点事件的独立危险因素,年龄可能通过直接影响患者的左心室舒张功能,从而导致了持续性AF风险增加。
本研究根据射频消融术后导致AF复发与心房功能性电重构的因素来研究STEMI患者接受PCI术后2年内发生新发持续性AF的危险因子,用于预测和评价这些患者未来发生持续性AF的风险。STEMI患者的原发性缺血性心肌损伤,继发性的缺血再灌注损伤,和冠脉缺血本身导致的能量代谢障碍均可导致舒张功能异常,从而增加远期持续性房颤的发生风险。而STEMI患者本身即有的慢性左房结构性重构,表现为LAVI基线水平的升高,也会显著增加未来持续性房颤的风险。因此左室舒张功能不全联合LAVI能够较好的预测STEMI患者术后持续性AF的发生风险。综上所述,本研究的结果对STEMI患者PCI术后心脏电重构和未来AF发生风险预测提供了依据,临床医师可以根据患者LAVI和左心室舒张功能改变高风险患者的随访管理策略,对PCI术后的STEMI患者加强心电学随访,及早发现新发的持续性AF,从而改变冠心病PCI术后合并房颤抗栓治疗策略,对最终改善患者总体心血管预后具有一定的临床意义。

